高校化学など、有機化学の基礎では芳香族化合物を学びます。芳香族化合物とは、ベンゼン環を有する有機化合物を指します。
ベンゼン環を有する化合物は非常に多く、有機化学を理解するとき、ベンゼン環の性質を学ぶのは欠かせません。
また芳香族化合物では、ベンゼン環にさまざまな側鎖が結合することになります。そこでベンゼン環の性質を学んだら、芳香族炭化水素の特徴を覚えましょう。有名な芳香族炭化水素にはトルエンとキシレンがあります。
それでは、芳香族化合物の性質や合成反応にはどのようになっているのでしょうか。ベンゼン環を有する化合物について、高校化学で学ぶ基本的な内容を解説していきます。
もくじ
ベンゼン環の性質:結合はすべて等価であり、炭素原子は同一平面上にある
ベンゼン環の構造式はどのようになっているのでしょうか。C6H6で表される化合物がベンゼンであり、以下の構造式になっています。
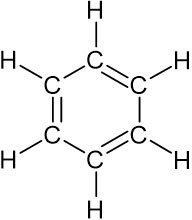
なお通常、ベンゼン環ではCやHを記すことなく、以下のようにベンゼン環を記述します。
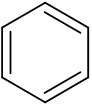
ベンゼン環には二重結合が3つ存在します。ただすべての結合について、単結合と二重結合の区別をすることはできず、等価である(すべての結合は性質が等しい)と判断します。ベンゼン環の構造式を記すときは二重結合と単結合を利用するものの、実際にはベンゼン環の結合はすべて同じ性質となっています。
事実、ベンゼン環ではすべての結合について長さが等しいです。本来、二重結合は単結合よりも結合の距離が短いです。ただベンゼン環ではすべての結合が等価であるため、結合の長さや性質に違いはありません。ベンゼン環に存在する二重結合というのは、特定の位置に固定されているわけではないのです。
またベンゼン環では、すべての炭素原子と水素原子が同一平面上に存在します。炭素同士の角度は120°であり、これによって正六角形となっています。
ベンゼン環の置換反応:ハロゲン化、ニトロ化、スルホン化
それでは、ベンゼン環はどのような反応を起こすのでしょうか。ベンゼン上で起こる反応として置換反応があります。ベンゼン環には水素Hが存在するため、水素が他の置換基と置き換わるのです。ベンゼン環への置換反応では、ハロゲン化やニトロ化、スルホン化が有名です。
大学の有機化学の研究室では、ベンゼンへの置換反応はひんぱんに行われます。そのためベンゼンの置換反応は重要な合成反応です。
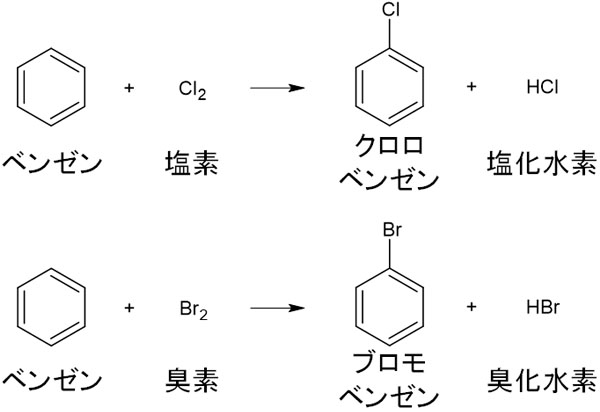
・ハロゲン化:Cl、Br
鉄を触媒として利用し、Cl2やBr2と反応させると、ハロゲン化によって水素がClやBrに置き換わります。
・ニトロ化
-NO2で表される置換基をニトロ基といいます。ベンゼンと硝酸を反応させることによってニトロ化が可能です。具体的には、濃硫酸と硝酸を混ぜてベンゼンと反応させるとニトロ化が進行します。

なお、濃硫酸は触媒として働きます。
・スルホン化
-SO3Hで表される官能基にスルホ基があります。ベンゼンに濃硫酸を加え、加熱すると水素がスルホ基に置換されます。
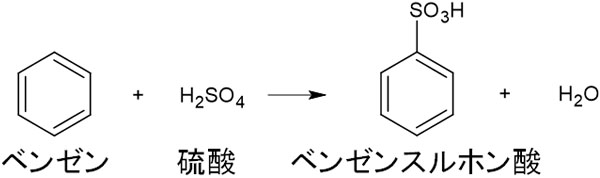
ベンゼンにスルホ基が結合し、ベンゼンスルホン酸を生成する反応をスルホン化といいます。
ベンゼンの付加反応:水素付加、塩素付加
先ほどの置換反応に比べて重要度は劣るものの、ベンゼンでは付加反応も起こります。
ベンゼン環は非常に安定しているため、通常は付加反応が起こりません。そのため高温・高圧条件にて、触媒を用いたり、光を照射したりなど、高いエネルギーを加えることでようやく付加反応が進行します。
高校化学で学ぶベンゼンへの付加反応では、水素付加とハロゲン付加を学びましょう。参考までに、大学の研究室でベンゼンへの付加反応を利用することはほぼありません。
・ベンゼンへの水素H2の付加
ニッケルNiを触媒として利用し、高温・高圧条件でベンゼンと水素H2を反応させるとシクロヘキサンを生じます。
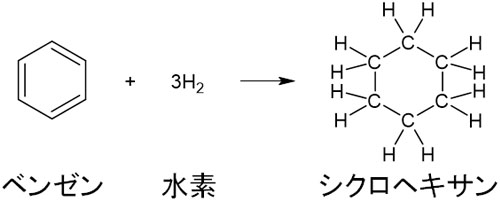
水素が付加することにより、ベンゼン環の二重結合が消えてすべて単結合になります。
・ベンゼンへの塩素Cl2の付加
ベンゼンへ塩素を付加させるとき、紫外線を照射しましょう。これによってラジカル反応という非常にエネルギーの高い反応が起き、ベンゼンはヘキサクロロシクロアルカンになります。
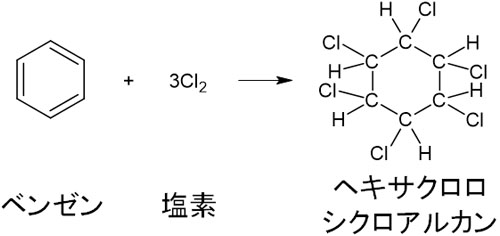
塩素Cl2に光を当てて反応させると、ベンゼンだけでなく、反応性の悪いアルカンやシクロヘキサンについてもクロロ化が進行します。これは、ラジカル反応による高エネルギー反応が起こるからです。
芳香族炭化水素の種類:トルエンとキシレン
ここまで、ベンゼンの性質や合成反応を解説してきました。ただ多くの場合、有機化学ではベンゼン環に置換基が結合した化合物を取り扱います。そこで芳香族化合物(ベンゼン環を含む化合物)の中でも、置換基として炭化水素が結合している化合物の性質を確認しましょう。
芳香族炭化水素の代表例としてトルエンとキシレンがあります。ベンゼン環にメチル基が一つ結合している化合物がトルエンです。また、ベンゼン環にメチル基が二つ結合している化合物がキシレンです。
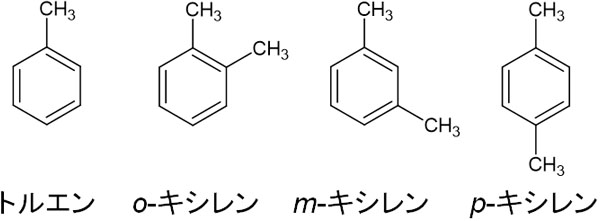
有機化学では、化合物の名前は必ず覚えなければいけません。そのためトルエンとキシレンの構造式を覚えてしまいましょう。
参考までに、芳香族炭化水素ではナフタレンやアントラセンもあります。以下の構造をしています。
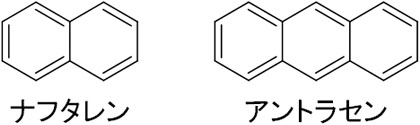
トルエンやキシレンに比べると、ナフタレンやアントラセンの重要度は劣ります。ただ有機化学では、ナフタレンやアントラセンを利用することもあります。
キシレンの異性体:o(オルト)、m(メタ)、p(パラ)の違い
先ほど、キシレンの構造式を示しました。キシレンには異性体が存在し、3種類あります。3種類のキシレンは明確に区別しなければいけません。
芳香族化合物では、2つの置換基が結合しているケースがひんぱんにあります。その場合、o(オルト)、m(メタ)、p(パラ)を利用して位置決定します。そこで一つの置換基を固定し、以下のように場所に名前を付けましょう。
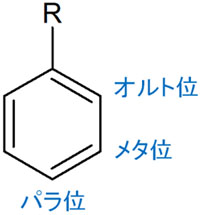
キシレンの場合、一つのメチル基を固定します。このとき、メチル基のオルト位に2つ目のメチル基がある場合はo-キシレンです。またメチル基に対して、メタ位に2つ目のメチル基がある場合はm-キシレンです。メチル基に対して、パラ位に2つ目のメチル基がある場合はp-キシレンです。
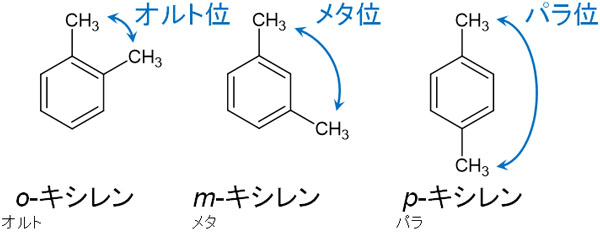
オルト、メタ、パラの概念は有機化学で重要であり、ひんぱんに利用されます。そのため、それぞれの位置関係を覚えましょう。
・ベンゼン環に結合しているカルボン酸は酸性であり、水酸化ナトリウムやアルコールと反応する
なお、カルボン酸が弱酸性を示すことは既に理解していると思います。そのためベンゼン環に結合しているカルボン酸についても弱酸性を示します。つまり、安息香酸は水酸化ナトリウムなどの塩基と中和反応を起こします。
またカルボン酸の性質として、アルコールと縮合反応を起こすことでエステルを形成することがあります。ベンゼン環にカルボン酸が存在する場合についても、アルコールと反応してエステル結合を作ります。
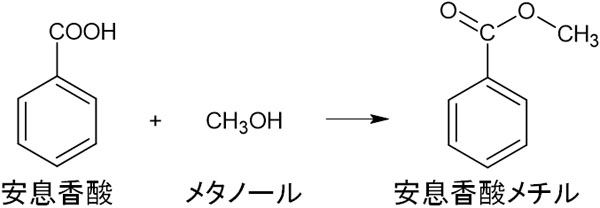
カルボキシ基(カルボン酸)の特徴はベンゼン環上に存在する場合であっても変わりません。
酸化によってトルエンやキシレンの側鎖はカルボン酸になる
次に、芳香族炭化水素を用いる合成反応を確認しましょう。トルエンが関わる合成反応では、酸化反応が重要です。トルエンを酸化すると、安息香酸を得られます。つまり、側鎖として存在するメチル基がカルボン酸になります。
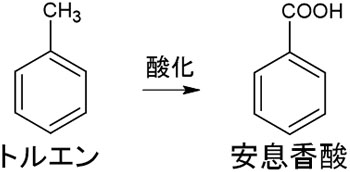
なおトルエンではなく、エチルベンゼンやアセトアミノフェン、フェニル酢酸を酸化させる場合であっても安息香酸を得られます。
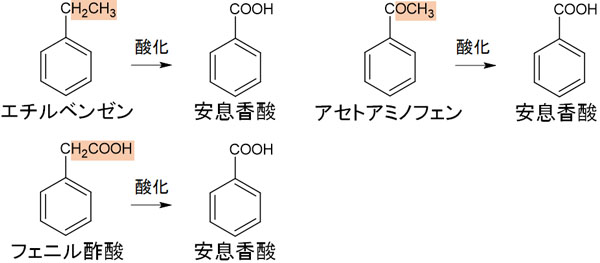
つまり芳香族炭化水素を酸化するとき、ベンゼン環に結合している炭素を基準にしてカルボン酸が作られると考えましょう。炭化水素の末端が酸化されるのではなく、ベンゼン環に直接結合している炭素がカルボン酸になります。
またキシレンを酸化する場合、2つのメチル基はカルボン酸へ変化します。ナフタレンを酸化する場合についても、「ベンゼン環に2つの炭素が結合している」と考え、フタル酸(オルト位にカルボン酸をもつ芳香族化合物)を得ることができます。

重要なのは、ベンゼン環に直接結合している炭素を起点にカルボン酸が生成されることです。
置換反応により、トルエンにニトロ基が結合する
芳香族炭化水素の有機合成反応では、ほかにも重要な反応がニトロ化です。先ほど、ベンゼンと硝酸を利用することでニトロ化する反応を解説しました。同様に、トルエンについても硝酸と反応させることでニトロ化します。
ベンゼンでのニトロ化との違いとしては、トルエンにニトロ化する場合はオルト位とパラ位にそれぞれ3つのニトロ基が結合します。置換反応により、一つではなく三つのニトロ基に置き換わるのです。
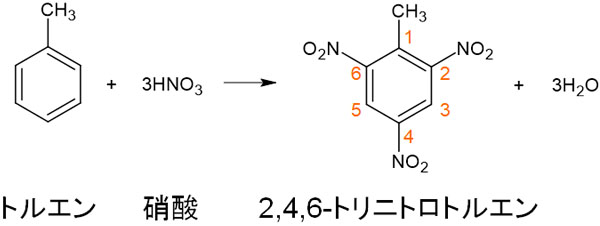
メチル基が結合している部分を1とします。その後、順番に番号を付けると2位、4位、6位にニトロ基が結合しているとわかります。そのため、生成物は2,4,6-トリニトロトルエンです。
なぜニトロ基が3つ結合するのかは大学の有機化学で学びます。トルエンはベンゼンよりも反応性が高いため、3つのHがニトロ基に置き換わるのですが、大学の有機化学でこの理由を学びましょう。またメタ位ではなく、なぜオルト位とパラ位にニトロ基が結合するのかについても大学の有機化学で学びます。
なお当然ながら、ニトロ基に限らず、ベンゼンと同様にトルエンはさまざまな化合物と反応して置換反応を起こします。ひとまず、トルエンはベンゼンと同じように置換反応を起こすことを理解しましょう。
芳香族化合物の基礎がベンゼンと芳香族炭化水素
多くの有機化合物はベンゼン環を保有しています。例えば、私たちが服用する薬のほとんどは芳香族化合物です。有機化学では、芳香族化合物は最も重要な分野の一つです。
芳香族化合物の性質を理解するため、ベンゼンの特徴を学びましょう。二重結合を3つ有するものの、すべての結合が等価である特殊な化合物がベンゼンです。ベンゼンを用いる化学反応では、置換反応と付加反応を覚えましょう。
また芳香族炭化水素ではトルエンとキシレンが重要になります。芳香族炭化水素で重要な合成反応には酸化反応と置換反応があります。また芳香族化合物ではオルト位、メタ位、パラ位と置換基の位置も重要になります。
芳香族化合物を学ぶとき、ベンゼンと芳香族炭化水素は基本的な内容です。そこで、これらの化合物の性質を理解しましょう。