重要な化学反応として酸化還元反応があります。酸化というと、金属のサビを私たちは思い浮かべます。金属がサビるのは酸化還元反応によるものです。
化学反応の中でも、電子を放出するときは酸化反応になります。一方で電子を得る場合は還元反応になります。
酸化還元反応というのは、それぞれの原子の酸化数を数えることによって、ようやく酸化されたのか、それとも還元されたのか判断できるようになります。このとき、酸化数を数えるルールを覚えなければいけません。
酸化還元反応は少し内容が複雑です。そこで、どのように酸化と還元を考えればいいのか解説していきます。
もくじ
酸化還元反応を酸素と水素で理解する
私たちの身の回りで発生しているさまざまな現象を化学で学びます。その一つが酸化還元反応です。例えば、以下のような金属のサビを私たちは何度も見ていると思います。

金属が酸化すると、金属は光沢を失ってボロボロの状態となります。
また、洗濯や殺菌をするときに漂白剤を利用することがあります。漂白剤には次亜塩素酸(HClO)が入っており、これは強力な酸化剤です。そのため酸化作用によって服の色を落としたり、細菌・ウイルスを殺したりするのです。
こうした酸化還元反応を理解するとき、最もわかりやすい考え方として、酸素と水素の動きを利用する方法があります。鉄(Fe)や銅(Cu)などの金属は酸素と結合することによって光沢を失います。つまり、酸化反応が起こります。
- 4Fe + 3O2 → 2Fe2O3
- 2Cu + O2 → 2CuO
そのため酸素を得る場合(酸素と反応する場合)は酸化反応です。
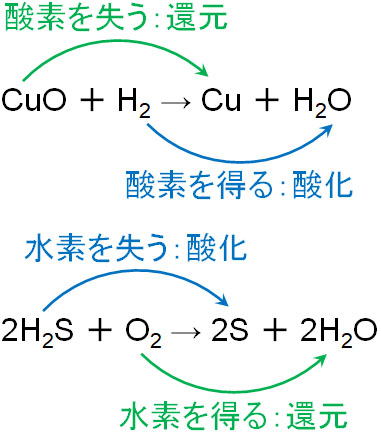
一方、酸化してしまった物質であっても、水素を利用することによって元の状態に戻すことができます。以下のように、酸化鉄(Ⅲ)や酸化銅を水素と反応させることによって、これらの酸化物質は光沢をもつ金属へと変化します。
- Fe2O3 + 3H2 → 2Fe + 3H2O
- CuO + H2 → Cu + H2O
この場合、酸素を失っています。酸素を失うとき、この現象を還元といいます。
また水素を得る場合(水素と反応する場合)についても還元と判断します。以下の反応では、O2は水素を得て水になっています。この反応が還元です。
- 2H2S + O2 → 2S + 2H2O
一方、硫化水素(H2S)に着目すると、水素を失っています。この場合、酸化になります。
- 酸化:酸素を得る or 水素を失う
- 還元:水素を得る or 酸素を失う
酸化還元反応を理解するとき、最もわかりやすい説明の方法は「酸素と水素の動きで化学反応を捉える」ことです。
なお酸化還元反応では、酸化のみまたは還元のみが起こるわけではありません。一つの化学反応が起こるとき、酸化と還元の両方が起こります。
電子の受け渡しが酸化還元反応で重要
ただ酸化還元反応では、必ずしも酸素や水素が関わるとは限りません。そのため、酸化と還元をほかの方法によって定義しましょう。具体的には、以下のように酸化と還元を見極めます。
- 酸化:電子e–を放出する
- 還元:電子e–を得る
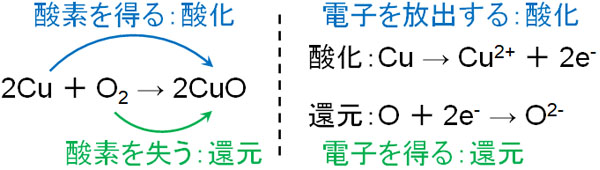
例として、銅と酸素の酸化反応を確認しましょう。
- 2Cu + O2 → 2CuO
CuOというのは、共有結合(電子を共有している状態)ではなく、イオン結合によって形成されています。おさらいすると、金属元素と非金属元素の結合はイオン結合になります。
銅がイオンになるとCu2+になります。そのため銅が酸素と結合するとき、2つの電子e–を放出することによって、以下のように陽イオンになる必要があります。
- Cu → Cu2+ + 2e–
電子を放出しているとき、銅は酸化されていると判断します。
一方、銅と酸素が反応するとき、1つの酸素原子がイオンになるためには、2つの電子を受け取ることによってO2-となる必要があります。以下のような反応です。
- O + 2e– → O2-
電子を得る場合、酸素原子は還元されています。つまり酸化還元反応というのは、電子の受け渡しを行う化学反応なのです。
- 酸化:電子を放出する(電子を失う)
- 還元:電子を得る
どちらが酸化であり、どちらが還元なのか忘れてしまった場合、ここまで解説した「銅が酸化されるケース」を思い出しましょう。銅に着目すると、銅は酸素と結合するので酸化されています。このときイオンになる必要があり、電子を放出しているため、電子を失う場合は酸化と判断できます。一方、その反対は還元です。
なお電子の受け渡しで酸化と還元を定義する場合、イオン結合を形成している化合物だけでなく、共有結合によって構成されている分子についても酸化や還元を判断できるようになります。
それぞれの原子の酸化数を数える
次に、それぞれの原子について酸化数を数えられるようにしましょう。ここまで解説した「電子を放出する(電子を失う)」「電子を得る」というのは、酸化数を確認することによって把握できます。
酸化数とは、その原子がどれだけの電子をもっているのかを表します。言い換えると、原子の酸化状態を表しているのが酸化数です。酸化数の値がマイナスであると、多くの電子を保有しているため、電子密度は高くなります。
例えばCu2+の場合、2つの電子を放出することによってCuからCu2+になります。酸化されるためには電子e–を放出する必要があり、酸化数はプラスとなり、電子を失うので電子密度は低くなります。
1つの電子を失う場合、正に帯電するため、酸化数は+1です。2つの電子を失う場合、酸化数は+2です。一方で1つの電子を得る場合、マイナスに帯電するので酸化数は-1です。2つの電子を得る場合、酸化数は-2です。このようにして、酸化数を数えていきます。
このとき、酸化数を確認するための手順を理解しましょう。物質の酸化数というのは、以下のルールに従って数える必要があります。
1. 一つの元素で構成されている場合、酸化数は0
FeやCu、O2、H2などは一つの元素のみで構成されています。この場合は、必ず酸化数は0です。そのためFeの酸化数は0ですし、O2の酸化数も0です。
2. 化合物の場合はH、Na、Kの酸化数を+1とし、Oの酸化数を-2とする(化合物全体の酸化数は0)
一方、2つの異なる原子が結合している場合、酸化数は0ではありません。酸化数を数えるとき、あなたが覚えなければいけない元素は4つです。H、Na、Kの酸化数を+1とし、Oの酸化数を-2としましょう。
H、Na、Kがイオンになる場合、電子e–を放出してH+やNa+、K+になります。そのため、これらの原子の酸化数は+1になります。ただ化合物全体の酸化数をゼロにしましょう。
例えばNaClについて、Naの酸化数は+1です。このとき化合物全体では酸化数をゼロにする必要があるため、Clの酸化数は-1になります。
またH2Sであれば、Hの酸化数は+1です。このとき化合物全体では酸化数がゼロなので、Sの酸化数を-2にします。+1の酸化数をもつHが2つあり、-2の酸化数をもつSが1つあるため、合計では0になります。
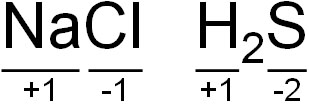
酸化数を数えるとき、着目しなければいけない元素は決まっています。そこで、足し算と引き算をすることによって原子の酸化数を数えましょう。
また、酸素原子も酸化数を数えるときに重要です。Oがイオンになるとき、2つの電子を得ることでO2-となります。電子を受け取ることで電子密度が高くなり、酸化数は-2となります。例えばFe2O3やCuOの酸化数は以下のようになります。
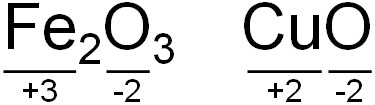
酸素原子を基準にすることによって、鉄や銅の酸化数がわかります。酸化数を数えるとき、着目する原子は決まっています。酸素を含む化合物であれば、酸素の酸化数を-2にしましょう。
例えば、過マンガン酸カリウム(KMnO4)について、マンガン(Mn)の酸化数はいくらでしょうか。
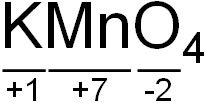
Kは酸化数が+1であり、Oは酸化数が-2です。そこで全体の酸化数を0にするためには、Mnの酸化数は+7である必要があります。こうして、原子ごとの酸化数を数えましょう。
・酸化数を数えるときの例外
なお酸化数を数えるとき、例外があります。例えば過酸化水素(H2O2)であれば、Oの酸化数は-1になります。また水素化ナトリウム(NaH)であれば、Hの酸化数は-1になります。
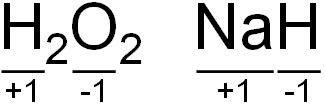
例外については、酸化数を覚えるようにしましょう。ただこれらの例外を除くと、ここまで説明した方法によって酸化数を数えることができます。
3. イオンの場合、価数を考慮して酸化数を数える
なおイオンの場合、化合物全体の酸化数は0にはなりません。例えばイオンの電荷が+1の場合、全体の価数は+1になります。そのためNa+の酸化数は+1です。またイオンの電荷が-1の場合、全体の価数は-1になります。そのためC–の酸化数は-1です。
複数の原子をもつイオンについても同様に考えましょう。例えば、硫化物イオン(SO42-)の酸化数はどのようになるでしょうか。
酸素原子の酸化数は-2です。またイオンの価数に着目すると電荷は-2であるため、全体の酸化数が-2になるようにしましょう。そうすると、以下のような酸化数になります。
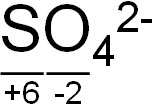
酸素原子の酸化数は-2であり、これが4つあります。ただ全体の酸化数が-2であるため、硫黄原子の酸化数は+6になります。イオンでは価数を考慮する必要があるものの、酸化数を数えるときの考え方は同じです。
酸化還元反応により、酸化数が増減する
なぜ酸化数を数えることが重要かというと、「反応前後で酸化数が増えたのか、それとも減ったのか」を確認することによって、「酸化されたのか、それとも還元されたのか」を確認できるからです。
酸化数が増えるというのは、電子を失っていることを意味しています。電子を放出するからこそ、酸化数がプラスになるのです。そのため化学反応が起こることによって酸化数が増えている場合、その原子は酸化されています。
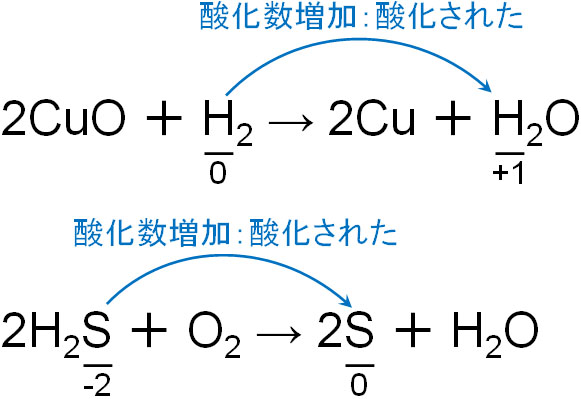
一方、電子を受け取ると酸化数は減ります。そのため化学反応が起こり、酸化数が減っている場合、その原子は還元されています。
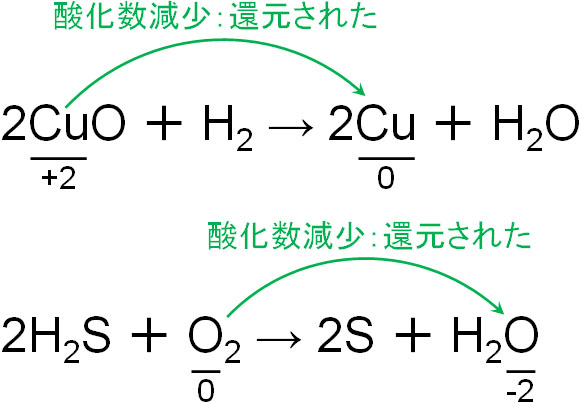
酸化と還元の基準は一つだけであり、電子を放出したのか、それとも受け取ったのかで判断しましょう。
マイナスに荷電している電子e–を放出すれば、それに応じて酸化数は増えるため、原子は酸化されたと判断できます。それに対して電子e–を受け取る場合、受け取る電子の数に応じて酸化数は減り、原子は還元されたと判断できます。
酸化還元反応と中和反応の違い
ここまでの内容を理解すると、多くの人で疑問に思うこととして「酸化還元反応と中和反応は何が違うのか」があります。
酸化還元反応では、化学反応に酸化と還元が関わります。一方で中和反応の場合、酸と塩基による反応であるため、酸化や還元は起こりません。中和反応というのは、あくまでもイオンの交換が起こるだけです。
例えば中和反応で学ぶ以下の化学反応について、反応の前後で酸化数は変化していません。
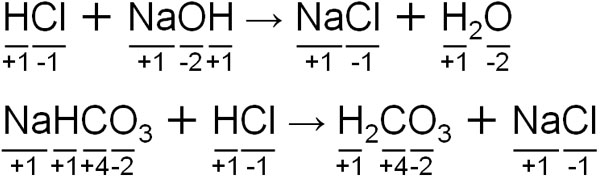
化学反応の前後で酸化数の変化が一ヵ所でもある場合、それは酸化還元反応です。一方で中和反応の場合、酸化数の変化はありません。そのため、酸化還元反応と中和反応はまったく異なる化学反応です。
酸化数を数え、酸化と還元の区別を行う
重要な化学反応の一つが酸化還元反応です。酸化還元反応というのは、電子の動きを伴う化学反応です。そのため、反応の前後で必ず電子の移動が起こります。その結果、酸化数が変化します。
どのようなケースが酸化であり、どのようなケースが還元なのか理解しましょう。電子を放出する場合は酸化であり、電子を得る場合は還元です。
またマイナスの電荷を有する電子e–を放出する場合、酸化数は増えます。酸化数が増えたら、原子は酸化されています。それに対して電子e–を得る場合、酸化数は減ります。酸化数が減っている場合、原子は還元されています。
酸化還元反応では、電子に着目しましょう。電子の動きや酸化数を確認すれば、原子が酸化されているのか、それとも還元されているのか判断できます。






