分子同士は互いに引き付けあいます。このような力を分子間力といいます。分子間力にはさまざまな種類があり、静電気的な引力や水素結合、ファンデルワールス力などが有名です。
高校化学では、これら基本的な分子同士の引き合う力について学びます。分子間力が強い場合、分子は互いに強く引き合います。その結果、融点や沸点が高くなります。分子間力というのは、分子の性質に大きく関与するのです。
なお、すべての分子で働く力にファンデルワールス力があります。非常に弱い力であるものの、非極性分子であっても引き合う力が存在します。また、これら分子同士で引き合う力が発生することにより、分子結晶を作ることができます。
分子間で働く力を理解すれば、分子の性質がわかります。そこで、分子間力の種類やファンデルワールス力の詳細、分子結晶について解説していきます。
もくじ
分子間力:極性分子による結合
分子と分子の間に働く引力を分子間力といいます。通常、分子は離れて存在しています。ただ、分子が互いに引き合うことによって影響を与えるのです。
例えば温度を下げると、水は氷になります。分子が密接にくっつくことによって氷となるのです。なぜ固体になるかというと、分子が互いに引き合うことで凝集するからです。
こうした分子間力として、高校化学では以下の種類を学びます。
- 静電気的な引力
- 水素結合
- ファンデルワールス力
電気陰性度によって、分子内に電荷の偏りを生じることがあります。例えば塩化水素(HCl)では、塩素原子の電気陰性度が強いです。そのため、電子は塩素原子に引き寄せられることによって少しマイナスの電荷を帯びるようになります。
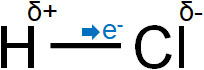
このように正の電荷と負の電荷を分子内で生じる場合、分子同士が互いに引き合うようになります。プラスとマイナスがあると、静電気的な力によって引き寄せ合うのです。
イオン結合とは異なり、強くプラスやマイナスの電荷に分かれているわけではありません。そのためイオン結合のように強い結合ではないものの、分子同士が静電気的な力によって引き合うのです。
なお、こうした静電気的な力がより大きい場合、水素結合と呼ばれます。水素結合というのは、静電気的な力による分子間力の一種です。F-H結合、O-H結合、N-H結合の場合、電気陰性度による電荷の偏りが非常に大きくなります。そのため、より強力に静電気的な引力を生じるようになります。
![]()
つまり水素結合というのは、静電気的な力の特殊バージョンと理解しましょう。
無極性分子でもファンデルワールス力による力が働く
ただ分子間力というのは、極性分子だけでなく無極性分子にも存在します。無極性分子で働く分子間力をファンデルワールス力といいます。
なぜ、無極性分子であるにも関わらず分子同士が互いに引き合うのでしょうか。この理由として、原子には電子が存在しており、電子は分子内を移動しているからです。
例えばヘリウムを例にファンデルワールス力を考えましょう。ヘリウムは希ガスであり、原子として存在しています。ヘリウムであっても互いに引き合う力としてファンデルワールス力があります。
ヘリウムについて、写真を撮影するときのように、特定の瞬間を切り取りましょう。そうすると、ヘリウムは瞬間的に原子内で電子の偏りを生じていることがわかります。
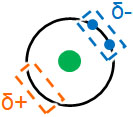
当然、ヘリウム以外の原子や分子についても、特定の瞬間を切り取ると、電子によって電荷の偏りを生じています。そのため、静電気的な力によって互いに引き合うようになるのです。
極性分子ではないため、ファンデルワールス力は非常に弱い分子間力です。ただ、無極性分子であっても分子間力を有するのです。
・分子量が大きいとファンデルワールス力は強くなる
このとき、分子量が大きいとファンデルワールス力は強くなります。分子が大きいほど、多くの場所で瞬間的な電荷の偏りを生じることになります。つまり、ほかの分子と引き合う力が強くなります。
また分子間力が強い場合、互いの分子が強く引き合うことによって凝集しやすくなります。そのため分子量が大きい分子であるほど融点や沸点が高くなります。
結合の強さはどうなっているのか
高校化学では多くの化学結合を学びます。そこで、結合の強さを順に並べられるようになりましょう。結合の強さは以下の順になります。
- 共有結合 > イオン結合 > 金属結合 >> 水素結合 > 静電的な引力 > ファンデルワールス力
共有結合については、原子同士が強固に結合することによって分子を作ります。イオン結合についても、陽イオンと陰イオンによる力(クーロン力:静電気力)によって極力な結合を作ります。
一方、分子内のわずかな電荷の違いによる引力が静電気的な力です。また前述の通り、より極性が強い場合は水素結合と呼ばれます。そして、最も弱い力がファンデルワールス力です。
極性分子の場合、ファンデルワールス力に加えて静電気的な引力が存在するので融点や沸点が高くなります。一方、非極性分子の場合は融点や沸点が低いです。
分子間力により、分子結晶が作られる
共有結合やイオン結合について、分子は結晶を作ります。共有結合やイオン結合は非常に強い結合であるため、共有結合の結晶やイオン結晶の融点は非常に高いです。
水素結合や静電気的な引力、ファンデルワールス力などの分子間力についても、分子が規則正しく配列し、結晶を作ることがあります。これを分子結晶といいます。
ただ共有結合やイオン結合のように、強力に結合しているわけではありません。分子同士が互いに引き合うことによって、弱く結合しているのが分子結晶です。そのため共有結合の結晶やイオン結晶に比べて柔らかくてもろく、融点が低いという特徴があります。
ドライアイスと氷は分子結晶の例でひんぱんに利用される
こうした分子結晶の例として、ドライアイスがよく利用されます。二酸化炭素(CO2)を固体にしたのがドライアイスです。
二酸化炭素は無極性分子です。ただファンデルワールス力をもつため、低温(-78.5℃)では他の二酸化炭素と互いに引き合い、最も密な状態にて固体となります。
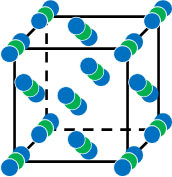
二酸化炭素を冷やすとドライアイスを得られるのは、ファンデルワールス力によって規則正しく分子が配列するからなのです。
なおファンデルワールス力に加えて、ほかの分子間力が加わる場合、融点や沸点は高くなります。例えば水(H2O)の場合、ファンデルワールス力だけでなく、水素結合によって水分子同士が結合しています。そのため、分子量が小さいにも関わらず融点や沸点が高いです。
また水には水素結合やファンデルワールス力があるため、分子結晶を作ります。なお、一つの水分子は以下のように4カ所で水素結合を作ります。
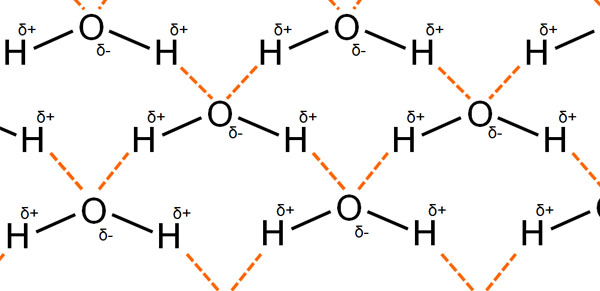
そのため水分子が氷になるとき、規則正しい構造で分子結晶を作るためには、正四面体構造になる必要があります。水分子は折れ曲がった形をしており、分子結晶を作るときの形が決まっているのです。
通常、液体が固体になるときは体積が少なくなります。分子が規則正しく並んで結晶を作るためには、最も密度が高い構造を取る必要があるからです。
ただ水分子の場合、前述の通り正四面体構造によって氷になります。正四面体構造はすき間の大きい構造であるため、水を液体から固体にすると体積が大きくなります。その結果、氷は水よりも密度が低くなります。
氷を水に入れると、氷は浮かびます。この理由として、氷は水よりも密度が低いからです。なぜ氷の密度が低いのかについては、分子間力と分子結晶を学ぶことによって理解できます。
分子間力の性質とファンデルワールス力の詳細を学ぶ
共有結合やイオン結合のように原子同士が結合を作るのではなく、それぞれの分子同士で働く引力が存在します。それが分子間力です。
極性分子の場合、静電気的な引力(水素結合を含む)が働きます。イオン結合のような強い結合ではないものの、プラスとマイナスの電荷によって分子同士は引き合います。また非極性分子であっても、ファンデルワールス力によって互いに引き合います。
こうした分子間力によって、化合物が凝集して固体になります。分子間力の影響によって作られる固体が分子結晶です。
高校化学で学ぶ結合には種類があります。それぞれの結合がどのような性質をもつのか理解し、区別できるようになりましょう。






