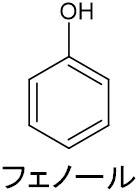
有機化学で重要な化合物の一つにフェノールがあります。ベンゼン環に-OHが結合している化合物がフェノールです。
高校化学で学ぶフェノール類では、フェノールの性質や反応、製法を覚えましょう。詳細な反応機構は大学の有機化学で学ぶことになり、高校化学では合成反応による結果を覚えることになります。
フェノール類で重要な化合物はフェノールであり、フェノール以外の化合物は重要ではありません。フェノールの性質や合成反応を理解すれば十分です。
それでは、フェノールの特徴には何があるのでしょうか。またフェノールはどのような合成反応に関与するのでしょうか。高校化学で重要なフェノールの性質や合成反応、製法について解説していきます。
もくじ
フェノール類の種類
まず、フェノールの構造を理解しましょう。以下のように、ベンゼン環に-OHが結合している化合物がフェノールです。
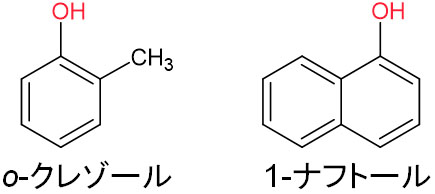
また、フェノールに派生する化合物をフェノール類といいます。例えば、以下の化合物が該当します。
前述の通り、フェノール類で重要な化合物はフェノールのみです。そのためフェノール類を学ぶとき、フェノールの性質を理解しましょう。なおフェノールで重要な特徴は以下の3つです。
- 弱酸性を示す
- 塩化鉄(Ⅲ)と反応する
- 無水酢酸と反応し、エステルを作る
それぞれの内容を確認していきましょう。
フェノールの性質:アルコールと違い、弱酸性を示す
-OHを有する化合物としてアルコールが知られています。ただ、フェノールはアルコールと比べて性質が大きく異なります。
まず、アルコールは中性です。一方、フェノールは弱酸性を示します。なぜフェノールが弱酸性を示すのかは大学の有機化学で学びます。高校化学では、フェノールが弱酸性である事実を覚えましょう。
フェノールは弱酸性を示すため、塩基と中和反応を起こします。例えば水酸化ナトリウムを加える場合、フェノールはナトリウムフェノキシドになります。
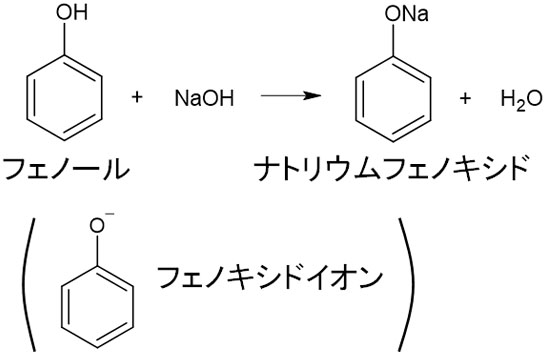
フェノールのイオンをフェノキシドイオンといいます。なお化合物によって酸性の強さに違いがあります。酸性の強さは以下のようになっています。
- HCl, H2SO4 > R-COOH > H2CO3 > フェノール
つまり、フェノールはカルボン酸-COOHや炭酸H2CO3よりも弱い酸です。酸性の強さを理解するのは重要であり、この理由は弱酸の遊離に関係するからです。つまりNa+のように、強塩基に由来する物質はより強い酸と結合を作りたいと考えているのです。
例えば炭酸H2CO3とフェノールを比べると、炭酸のほうが強い酸です。そのためナトリウムフェノキシドを含む水溶液にCO2を吹き込むと、炭酸を生じることによって炭酸水素ナトリウムとフェノールを生じます。
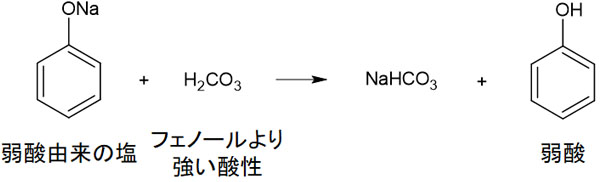
前述の通り、Na+はより強い酸とイオン結合を作りたいと考えています。そのためフェノールではなく、Na+は炭酸と新たな結合を作るのです。こうして、弱酸としてフェノールが遊離します。フェノールは非常に弱い酸であるため、弱酸の遊離が起こりやすいです。
塩化鉄(Ⅲ)水溶液により、青紫~赤紫色になる
ほかにも、フェノール類で重要な性質に塩化鉄(Ⅲ)との反応があります。塩化鉄(Ⅲ)水溶液を加えることで青紫~赤紫色になる場合、フェノール類が存在すると判断できます。
アルコールとフェノール類の違いとして、酸性かどうか以外にも、塩化鉄(Ⅲ)との反応があります。ベンゼン環をもたないアルコールの場合、塩化鉄(Ⅲ)水溶液を加えても反応は起こりません。一方、フェノール類では塩化鉄(Ⅲ)を加えることで反応します。
塩化鉄(Ⅲ)水溶液の使用というのは、含まれている化合物がアルコールなのか、それともフェノール類なのかを判断するときに有効です。
酸無水物(無水酢酸)と反応し、フェノールはエステルを作る(アセチル化)
フェノール類は-OHをもつため、アルコールと同じ性質をもつケースもあります。その一つがエステル結合を作ることです。
アルコールとカルボン酸を反応させると、エステルを作ることが知られています。同様にフェノールとカルボン酸を反応させるとエステルを得ることができます。
ただアルコールとは異なり、フェノールはカルボン酸と反応しにくいです。そこでフェノールのエステル化ではカルボン酸ではなく、酸無水物を利用します。有名な酸無水物に無水酢酸があります。無水酢酸をフェノールに加えると、エステル化(アセチル化)をすることができます。
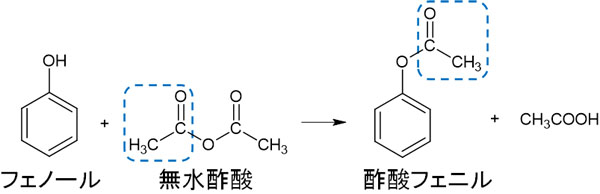
フェノールをエステル化(またはアセチル化)するとき、酸無水物を利用しましょう。
フェノールで起こる置換反応:ハロゲン化とニトロ化
なおフェノールではエステル化以外にも重要な反応があります。それがハロゲン化とニトロ化です。フェノールでは、ベンゼン環上で置換反応が起こるのです。
ベンゼン環上で置換反応を起こす化合物にベンゼンとトルエンがあります。これらの化合物と同様に、フェノールではハロゲン化とニトロ化が可能です。またハロゲン化やニトロ化が起こるとき、オルト位とパラ位で置換反応が起こります。
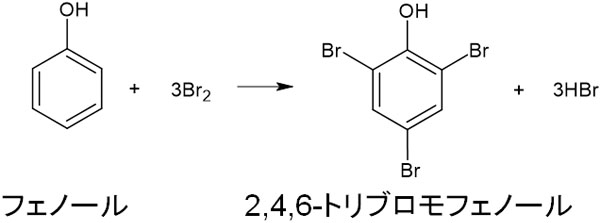
・ハロゲン化(クロロ化やブロモ化)
塩素Cl2や臭素Br2と反応させることにより、クロロ化またはブロモ化をすることができます。例えばフェノールと臭素を反応させる場合、2,4,6-トリブロモフェノールを得ることができます。
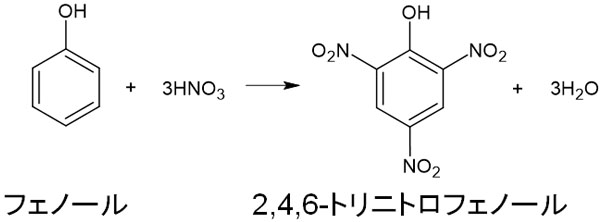
・ニトロ化
濃硝酸と反応させる場合、濃硫酸を触媒として利用することによって2,4,6-トリニトロフェノール(ピクリン酸)を得ることができます。
生成物の名前を覚える必要はありません。重要なのは、「フェノールはベンゼン環上で置換反応を起こす」という事実です。
3つ存在するフェノールの製法
有機化学の基礎ではフェノールの製法を学びます。どのようにフェノールが合成されるのか学びましょう。重要なフェノールの製法には以下があります。
- クメン法
- アルカリ融解法
- クロロベンゼンの加水分解
すべての方法に共通しているのは、ベンゼンを出発物質として、置換反応によって置換基を加えることです。その後、置換基をフェノールに変化させることで目的物質を得ます。
なお、フェノール合成の反応機構はどれも難しく、詳細は大学の有機化学で学びます。そのため高校化学の知識では、フェノールの製法を問われる問題が出題される場合、フェノールの製法を覚えるしかありません。
クメン法でのフェノール生成
フェノールの大量生産をするとき、一般的な方法がクメン法です。クメン法では、ベンゼンとプロペン(プロピレン)を利用し、クメンを合成します。プロペンがベンゼンに対して置換反応を起こすのです。
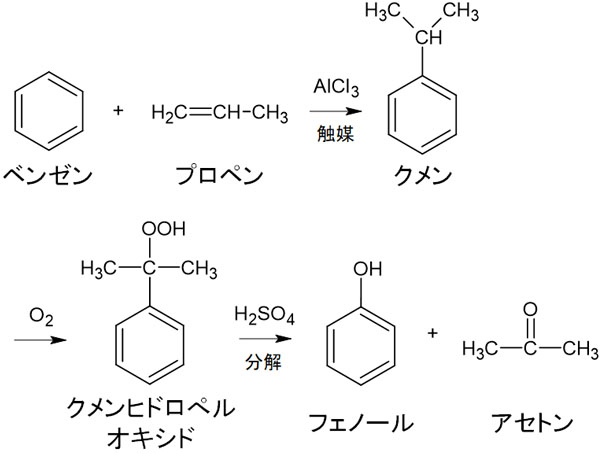
その後、クメンを酸化して酸で分解します。これにより、フェノールを得ることができます。参考までに、クメン法は大学有機化学であっても難しい反応機構です。
アルカリ融解法:フェノールの古い工業的製法
クメン法が開発される以前に利用されていたフェノールの工業的製法がアルカリ融解法です。アルカリ融解法では、ベンゼンと硫酸を利用することによってベンゼンスルホン酸を作ります。ベンゼンに対して硫酸を置換反応させると、ベンゼンスルホン酸を得られることは既に理解していると思います。
その後、ベンゼンスルホン酸を中和し、固体の水酸化ナトリウムを加えることでナトリウムフェノキシドを得ます。

固体の水酸化ナトリウムと反応させるとき、熱することで水酸化ナトリウムを融解させます。この方法をアルカリ融解法といいます。
ナトリウムフェノキシドを合成したら、炭酸などの酸を加えることでフェノールにします。前述の通り、炭酸はフェノールよりも酸性が強いため、炭酸を加えることで弱酸の遊離が起こり、フェノールが生成されるのです。
クロロベンゼンの加水分解によるフェノール合成
鉄触媒を利用することによって、ベンゼン環上のHをClに置換することができます。そこでベンゼンとCl2を反応させ、ベンゼンをクロロベンゼンにします。
その後、高温・高圧条件で水酸化ナトリウムと反応させることによってナトリウムフェノキシドを得ることができます。つまり、加水分解することによってClをOHに置き換えることができます。

ナトリウムフェノキシドを得たら、炭酸ガスを用いることによって弱酸の遊離を起こさせ、フェノールを得ることができます。
フェノールの性質を覚える
フェノール類で重要な化合物はフェノールのみです。その他のフェノール類は重要ではありません。つまり、フェノールの性質と重要な合成反応を覚えればフェノール類の理解は十分です。
-OHをもつものの、アルコールとフェノールは性質が大きく異なります。フェノールは弱酸性であり、塩化鉄(Ⅲ)と反応します。またカルボン酸とは反応しにくいため、エステル化するときは無水酢酸などの酸無水物を利用します。
またフェノールはベンゼン環上でハロゲン化とニトロ化を起こします。置換反応により、Hが他の官能基に置き換わるのです。
フェノールの製法を覚えるのも重要です。反応機構は難しいものの、それぞれのフェノールの製法を理解しましょう。高校化学でフェノール類を学ぶとき、これらフェノールの性質を覚えることが重要です。