無機化学を学ぶとき、それぞれの元素の特徴を理解しなければいけません。このとき、最も基本的な内容に水素や希ガスの性質があります。
無機化学で最初に学ぶ元素が水素と希ガスです。水素や希ガスについて、どのような性質があるのか覚えるのです。
またこれらの性質を覚えるだけでなく、製法も学びましょう。どのようにして水素や希ガスを作るのか知っておくのです。水素や希ガスは日常生活の多くの場面で利用されています。そのため、私たちにとって身近な元素でもあります。
それでは、水素や希ガスの性質には何があるのでしょうか。水素や希ガスの特徴や製法を確認していきましょう。
もくじ
水素の性質を学ぶ
無機化学で最初に学ぶ元素が水素です。元素周期表の最初に現われるのが水素です。また、元素周期表の2番目に現われるのがヘリウム(希ガス)です。
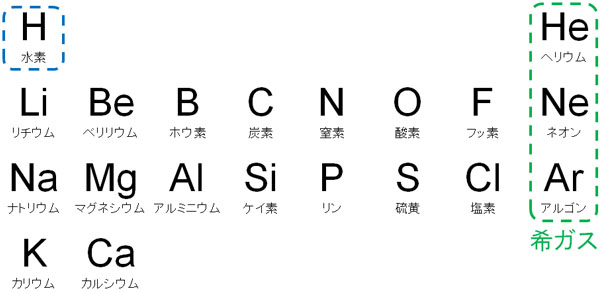
まず、水素の性質を確認しましょう。元素周期表というのは、原子の重さ順に並んでいます。そのため元素周期表の最初にある水素というのは、あらゆる物質の中で最も軽いです。また最も軽いというのは、最も密度が小さいことを意味しています。
なお酸素(O2)や窒素(N2)と同じように、水素(H2)は水にほとんど溶けません。水に溶けにくい性質があるため、水素を発生させるとき、水素の採取で水溶液を利用するケースが多いです。水素は水に溶けないので、水上置換によって効率よく水素を集めることができるのです。
また水素と酸素を反応させると、爆発を起こして水が発生することは有名です。
- 2H2 + O2 → 2H2O
水素は燃えやすい気体であるため、水素エネルギーとして利用されます。また燃焼後に生成されるのが水のみです。そのため、水素はクリーンエネルギーとしても知られているのです。
ここまでの内容が水素の主な性質です。多くの人にとって既に知っている内容であるため、水素の性質を覚えるのは難しくありません。
水素には還元作用がある
なお水素の性質では、もう一つ重要な働きがあります。それは還元作用です。
酸化還元反応を学んでいる場合、「水素には還元作用がある」と習っているはずです。水素は還元剤の一つであり、相手から酸素を奪う(電子を渡す)ことによって相手を還元します。そのため酸化している金属と水素を反応させると、還元作用によって金属は酸化されていない状態に戻ります。
- CuO + H2 → Cu + H2O
金属単体に戻ると、金属は光沢をもつことで輝くようになります。
水素の製法:実験的製法と工業的製法
それでは、水素を作るにはどのようにすればいいのでしょうか。水素の製法については、実験的製法(少量の水素を得る方法)と工業的製法(大量の水素を得る方法)に分けて考えましょう。
研究室で実験をするときなど、少量の水素を発生させたい場合、イオン化傾向を利用してH2を作りましょう。具体的には、塩酸または希硫酸を用意した後、水素よりもイオン化傾向の高い金属を水溶液の中に入れます。
このとき、イオン化傾向の順番は以下の通りです。
例えば亜鉛(Zn)を希硫酸の中に入れます。亜鉛は水素よりもイオン化傾向が高く、積極的に亜鉛イオン(Zn2+)になろうとします。そのため、以下の化学反応が起こります。
- Zn + H2SO4 → ZnSO4 + H2
なお、ナトリウムと水を利用することによって水素を発生させることもできます。ナトリウムと水が反応すると以下のようになります。
- 2Na + 2H2O → 2NaOH + H2
ただ実際には、金属ナトリウムを利用しても水素を得ることはできません。金属ナトリウムを水に入れる場合、大量の水素が発生すると同時に空気中の酸素と反応し、大爆発を起こします。前述の通り、水素と酸素が反応すると水が生成されます。
「金属ナトリウムを利用して水素を得られる」などのような記述は教科書的には正しいものの、現実世界では間違っていることがよくあるのです。
・水素の工業的製法
一方、大量の水素を作るときはどうすればいいのでしょうか。工場などで大量の水素を作るとき、イオン化傾向を利用して水素を発生させることはしません。その代わり、電気分解を利用します。
水に電気を流せば、水が分解することによって水素と酸素が発生します。電気分解による水素の製法は古くから知られています。
- 2H2O → 2H2 + O2
なお電気分解を利用して水素を発生させる場合、コストが非常に高くなります。そのため実際には、ほかの方法によって水素ガスの大量生産が行われています。水素ガスはクリーンエネルギーとして非常に重要なため、大量生産するために多くの研究が行われているのです。
ただ学問として水素の性質を学ぶとき、古い手法を最初に学ぶのが大原則です。そこで、水素の工業的製法では電気分解が利用されることを理解しましょう。最新の手法は常に変化するため、必要になれば最新手法を学ぶといいです。
希ガスは安定して存在する気体:ヘリウム、ネオン、アルゴン
水素を学んだら、次は希ガスの性質を理解しましょう。元素周期表の右端に存在するのが希ガスです。重要な希ガスは以下になります。
- He:ヘリウム
- Ne:ネオン
- Ar:アルゴン
希ガスは最外殻電子が8個(ヘリウムは2個)となっており、オクテット則を満たしています。言い換えると、閉殻構造となっています。そのため非常に安定な物質であり、ほかの物質と化学反応を起こすことはほぼありません。これは分子を作らず、原子で存在することを意味しています。
なおヘリウムは前述の通り、元素周期表で2番目(水素の次)の位置にあります。この世で2番目に軽い物質であり、空気(酸素と窒素の混合物)よりも軽いです。そのため、テーマパークなどで配られる風船にはヘリウムが入っています。

なぜ水素ではなくヘリウムを利用するかというと、水素は酸素と反応して爆発するからです。一方、ヘリウムは原子で存在しており、非常に安定な物質であるため、ほかの物質と化学反応を起こしません。この性質により、風船の中に入れる気体ではヘリウムが利用されるのです。
多くの場面で希ガスが利用される
なおヘリウムだけでなく、ネオンやアルゴンも多くの場面で利用されています。例えばネオンについてはネオンサインが有名です。夜に都市を歩けば、必ずネオンサインを見かけることになります。

ガラス管にネオンを入れ、放電することによって光を発します。ネオンサインでは、この性質を利用しています。LEDが主流となる以前では、ネオンが利用されていたのです。
なお、アルゴンも利用用途が多いです。アルゴンは安定な物質であるため、アルゴンガスを利用することによって酸素を排除すれば、化合物の酸化を防げます。アルゴンは不活性ガスであり、例えば容器内にアルゴンを充填させることにより、容器内で起こる劣化(酸素による酸化反応など)を避けることができるのです。
希ガスというのは、ほかの物質と反応しない性質があるからこそ、多くの場面で利用されるのです。
水素と希ガス(ヘリウム、ネオン、アルゴン)の性質を知る
重要な元素に水素や希ガス(ヘリウム、ネオン、アルゴン)があります。無機化学を学ぶとき、最初に習うのが水素と希ガスです。
最も軽く、最も密度の小さい物質が水素です。水素は水に溶けにくく、酸素と反応することで勢いよく燃焼します。この性質を利用して、クリーンエネルギーとして水素が利用されています。そこで水素の性質や製法を理解しましょう。
また希ガスも重要な元素です。ハロゲンやネオン、アルゴンは閉殻構造であり、非常に安定な物質です。他の物質と化学反応を起こすことがほぼないため、多くの場面で希ガスが利用されています。
水素や希ガス(ヘリウム、ネオン、アルゴン)は利用されている場面が多いです。そのため重要な元素であり、それぞれの性質を覚えましょう。






