無機化学では金属イオンの分離を学びます。複数の金属イオンが混ざって存在しているとき、試薬を加えることによって特定の金属イオンと反応させ、金属イオンを分離するのです。
金属イオンによって性質が異なります。また、金属イオンによって反応する試薬の種類が異なります。他には、酸性条件では反応しないものの、塩基性条件では反応するケースもあります。
それぞれの金属元素の性質を覚えていないと、金属イオンを分離することはできません。また金属元素の性質を覚えていないと問題を解けないため、無機化学の中で金属イオンの分離は難しい問題になります。そこで、それぞれの元素の特徴を覚えましょう。
金属イオンを分離するとき、方法は決まっています。そこで、どのように金属イオンを分離すればいいのか解説していきます。
もくじ
試薬と反応させ、金属イオンを分離する
金属イオンと試薬を反応させることによって、固体の沈殿を生じることがよくあります。また固体の沈殿を生じた後、ほかの試薬を加えることによって再び溶解することもあります。
また試薬を加えても、反応しないケースはよくあります。金属イオンによって、試薬と反応するかどうかが異なるのです。
なお、金属イオンの分離で重要な反応が以下になります。
- 塩酸を加えるとき
- 硫化水素を加えるとき
- 塩基(アンモニア水または水酸化ナトリウム)を加えるとき
これらの操作をすることによって金属イオンの分離が可能です。
金属と塩基(アンモニア水、水酸化ナトリウム)との反応
なお金属イオンの分離をするとき、金属と塩基との反応を復習しましょう。塩基を加えるとき、以下の3つのパターンがあります。
- 少量のアンモニア水または水酸化ナトリウムを加える
- 過剰のアンモニア水を加える
- 過剰の水酸化ナトリウムを加える
それぞれのパターンで金属と試薬の反応が異なります。また塩基を加えるとき、重要な金属イオンが以下になります。
- 両性元素:Al3+、Zn2+、Sn2+、Pb2+
- 鉄:Fe2+、Fe3+
- 銅:Cu2+
- 銀:Ag+
両性元素に加えて、遷移元素で特に重要な元素である鉄、銅、銀が塩基との反応で重要です。
・少量のアンモニア水または水酸化ナトリウムを加える
これらの元素に少量のアンモニア水や塩化水素を加えるというのは、水溶液中のOH–と反応することを意味します。OH–と反応する場合、先ほど記した金属イオンではすべてのケースで水酸化物イオンによる固体が生成され、沈殿します。
- 白色:Al(OH)3、Zn(OH)2、Sn(OH)2、Pb(OH)2
- 淡緑色:Fe(OH)2
- 赤褐色:Fe(OH)3
- 青白色:Cu(OH)2
- 褐色:Ag2O
両性元素が水酸化物を作る場合、白色の固体を生じます。一方で遷移元素と反応する場合、有色の固体が生成されます。
・過剰のアンモニア水を加える:Zn2+、Cu2+、Ag+
それでは、少量ではなく過剰のアンモニア水を加える場合はどうなるのでしょうか。過剰のアンモニア水を加えるとZn2+、Cu2+、Ag+は錯イオンを作ります。
- 無色:[Zn(NH3)4]+、[Ag(NH3)2]+
- 深青色:[Cu(NH3)4]2+
アンモニア水を過剰に加えると、Zn2+、Cu2+、Ag+は錯イオンを形成して溶解します。
・過剰の水酸化ナトリウムを加える
過剰のOH–を加える場合、錯イオンを形成して溶解することがあります。アンモニア水を過剰に加えてもOH–の量はほとんど増えないものの、水酸化ナトリウムを過剰に加える場合、溶液中に多量のOH–が生成されます。
水酸化ナトリウムを過剰に加えて錯イオンを形成するのは両性元素のみです。なお、以下の錯イオンはすべて無色です。
- [Al(OH)4]–
- [Zn(OH)4]2-
- [Sn(OH)4]2-
- [Pb(OH)4]2-
両性元素について、少量のOH–が存在するのか、それとも過剰のOH–が存在するのかによって、溶液中に存在する状態が異なります。
金属イオンを実際に分離してみる
それでは、実際に金属イオンを分離するときのやり方を学んでいきましょう。それぞれの元素の性質を覚えるよりも、金属イオンを分離するときの操作を学ぶほうが効率的です。
ここでは、「Ca2+、Na+、Fe2+、Al3+、Zn2+、Pb2+、Cu2+、Ag+」が溶けている場面を考えましょう。これらの金属を分離するとき、全体像は以下になります。
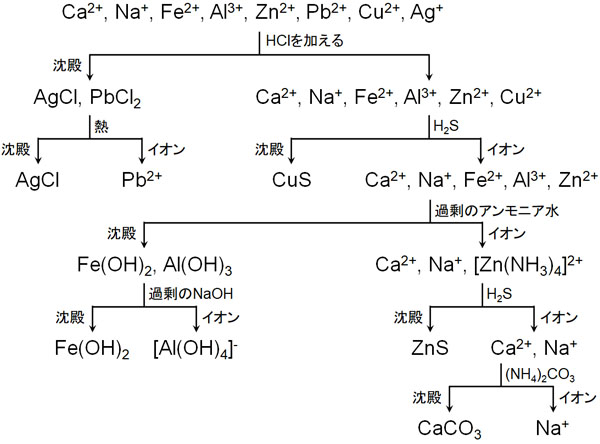
試薬を加える順番を変えると、金属イオンを分離することはできません。そこで、それぞれの操作を確認していきましょう。
なお当然ながら、金属イオンの分離では、出題される金属イオンが異なるケースはよくあります。そこで、さまざまなパターンで金属イオンの分離を行えるようになりましょう。
塩酸HClを加える:銀イオンと鉛イオンの沈殿
塩化物イオンと反応することで固体を生成する金属イオンとしては銀イオンと鉛イオンが知られています。AgCl、PbCl2を形成することで沈殿を生じるのです。
Cl–と反応して固体になる金属イオンは少ないです。そこで、塩酸を加えることで銀イオンと鉛イオンは塩化物を生成し、両方とも白色沈殿を生じることを覚えましょう。
重要なのは、塩酸を加えた後に熱を加えることです。冷水の場合、AgClとPbCl2は固体として存在します。ただ冷水を熱湯にすると、AgClは固体のままであるものの、PbCl2は水に溶けます。この性質を利用して銀と鉛を分けます。
または、過剰のアンモニア水を加えてもいいです。前述の通り、銀イオンはアンモニアと錯イオンを形成します。一方、鉛はアンモニアと錯イオンを作りません。
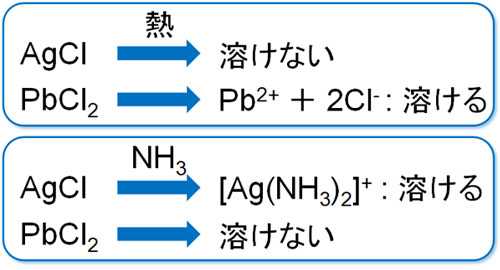
このように、金属元素の性質を利用して銀と鉛を分けることができます。
酸性条件で硫化水素H2Sを加える
次に硫化水素を加えましょう。先ほど、塩酸を加えることで銀イオンと鉛イオンを沈殿させています。つまり、水溶液は酸性になっています。
酸性条件下で硫化水素を加える場合、硫化銅CuSによる黒色沈殿が起こります。硫化水素と金属イオンとの反応性は以下のようになります。
| 必ず沈殿を生じる | SnS, PbS, CuS, HgS, Ag2S, CdS |
| 中性・塩基性で沈殿を生じる | ZnS, FeS, NiS, MnS |
| 沈殿しない | K+, Ca2+, Na+, Mg2+, Al3+, Ba2+ |
銀と鉛は既に分離しています。そのため、酸性条件で硫化水素を加えて沈殿するのは銅のみです。
硫化水素を加えて沈殿を生じるかどうかを見極める方法として、イオン化傾向がひんぱんに利用されます。イオン化傾向が強いと沈殿を生じにくく、イオン化傾向が低いと固体になって沈殿を生じやすくなります。硫化水素を加える場合、以下のように判断しましょう。

この関係性を理解すれば、酸性条件下で硫化水素を加えて沈殿を生じるのは銅イオンと判断できます。
過剰のアンモニア水を加え、水酸化物と錯イオンを作る
次に過剰のアンモニア水を加えましょう。アンモニアを加える場合、水溶液には少量のOH–と過剰のNH3が存在することになります。そのため水酸化物を生成する金属イオンは固体となって沈殿します。ただアンモニアと錯イオンを形成する場合、水溶液中に溶けます。
OH–と反応し、水酸化物(または酸化物)の固体となって沈殿する金属は以下のようになります。

カリウムやカルシウム、ナトリウムはイオン化傾向が高いため、OH–が存在しても固体を生じません。一方、ほとんどの金属で水酸化物を生じて沈殿します。なお銀イオンの場合、AgOHは安定性が低く、すぐに分解されて酸化物(Ag2O)となります。
そのため今回の例題では、アンモニア水を加える場合、Fe(OH)2とAl(OH)3が生成されます。
なお過剰のアンモニアが存在すると、アンモニアはZn2+と錯イオンを作ります。亜鉛は[Zn(NH3)4]2+で存在するため、カルシウムやナトリウムと同様に水溶液中に溶けています。
過剰の水酸化ナトリウムを加え、錯イオンを作る
それでは、Fe(OH)2とAl(OH)3を分けるにはどうすればいいのでしょうか。アルミニウムは両性元素です。前述の通り、両性元素では過剰のOH–が存在すると錯イオンを作ります。
アンモニアは弱塩基であるため、過剰のアンモニアを加えてもOH–の量は多くなりません。それに対して、水酸化ナトリウムは強塩基です。そのため過剰の水酸化ナトリウムを加えると、両性元素は錯イオンを形成するのです。
鉄イオンでは、水酸化ナトリウムを加えても錯イオンを作りません。一方、過剰のOH–があるとアルミニウムは[Al(OH)4]–となります。
- Al(OH)3 + OH– → [Al(OH)4]–
これにより、鉄とアルミニウムを分離することができます。
塩基性条件で硫化水素H2Sを加える
その後、硫化水素H2Sを加えます。先ほどと異なるのは、酸性条件ではなく塩基性条件で硫化水素を加えていることです。過剰のアンモニア水を加えているため、溶液は塩基性になっているのです。
この状態で硫化水素を加えると、亜鉛は硫化亜鉛となって沈殿します。
- Zn2+ + S2- → ZnS
前述の通り、硫化水素を加えてもカルシウムとナトリウムによる沈殿は起こりません。一方、塩基性条件では亜鉛は硫化亜鉛となります。
炭酸アンモニウム(NH4)2CO3を加え、炭酸塩を作る
カルシウムやナトリウムはイオン化傾向が高いため、沈殿物を作るのは難しいです。ただカルシウムについては、CO32-と反応することよって固体となります。
カルシウムCaやバリウムBaなど、アルカリ土類金属の性質を復習すると、アルカリ土類金属の炭酸塩と硫酸塩は水に溶けません。つまり、以下の化合物は固体となって沈殿します。
- CaCO3
- CaSO4
- BaCO3
- BaSO4
Ca2+またはBa2+に炭酸アンモニウム(NH4)2CO3を加えると、炭酸塩の沈殿を生じる問題はひんぱんに出されます。そこで、アルカリ土類金属の性質を復習しましょう。
炎色反応を利用し、ナトリウムが残っていることを確認する
こうして、最後にNa+が残ります。溶液中に存在するのがナトリウムイオンかどうかを確認するためにはどうすればいいのでしょうか。イオン化傾向が高い化合物について、水溶液中に金属イオンが存在するかどうかを確認する方法に炎色反応があります。
炎色反応を利用すれば、以下のように特定の色が表れます。

Na+が水溶液に溶けている場合、炎色反応によって黄色になります。参考までに、溶けている金属イオンがLi+だと赤色になりますし、K+の場合は紫色になります。
なお、炎色反応の有名な覚え方は以下になります。

イオン化傾向の高い金属を固体にするのは難しいため、炎色反応を利用して色を確認しましょう。そうすれば、水溶液中に存在するイオンが何かを確かめることができます。
金属イオンの分離は適切な方法がある
無機化学で最も難しい分野の一つが金属イオンの分離です。金属イオンの分離に関する問題が難しい理由は、すべての無機化学の知識を理解する必要があるからです。
ただ、問題の解き方は決まっています。金属イオンの分離で重要なのは塩酸(HCl)、硫化水素(H2S)、塩基(アンモニア水または水酸化ナトリウム)を加えるときの反応です。これらの反応によって、どの金属イオンと固体を作るのか覚えましょう。
もちろん、塩基を加える量や錯イオンの生成、炭酸との反応、炎色反応なども覚えなければいけません。無機化学で学んだことをすべて利用して、金属イオンの分離を行いましょう。
無機化学で最も難しい内容の一つであるものの、金属イオンの分離を習えば、金属イオンの性質の復習が可能です。そこで、どのように金属イオンを分離すればいいのか理解しましょう。