分析する手法として、非常に多く利用されているのが光の測定です。光を照射することで、そこに化合物がどれだけ存在するのかを確認できるのです。
これら、光を活用した測定技術としては、紫外可視吸収スペクトルが有名であり、非常に多くの研究機関で利用されています。ただ紫外線や可視光を検出するのではなく、蛍光を観測する手法も広く利用されています。これが蛍光分析法です。
どれだけ光を吸収するのかを測定するのではなく、蛍光がどれだけ観測されるのか(どれだけ強い光を発するのか)を測定するのが蛍光分光法です。
特に生化学実験を行う研究機関では、蛍光スペクトルを活用する機会が多いです。そこで、蛍光スペクトルの原理や測定方法の考え方を解説していきます。
もくじ
共役構造により、蛍光を発することがある
化学現象は私たちの身近で起こっています。その中でも、蛍光反応は普段から私たちの身近にあります。蛍光色の製品はたくさんありますし、イベントのときも蛍光製品は活躍します。

これらの蛍光は製品ではなく、科学実験としても広く利用されます。
有機化合物の中で、共役構造を有する場合は蛍光を発することがあります。自然界でも合成品でも蛍光物質が存在します。例えば、以下の物質です。
- クロロフィル
- クマリン
- フルオレセイン
- ローダミン
これらの物質はどれも共役構造をもち、結果として蛍光を発します。もちろん共役構造があれば、すべての分子で蛍光を発するわけではありません。また蛍光を発するにしても、非常に弱い蛍光となることはよくあります。
そこで蛍光分光法では、強い蛍光を発する化合物を利用します。これにより、蛍光スペクトルを得られるようになります。
励起状態の後、光エネルギーとして蛍光が表れる
それでは、なぜ蛍光が表れるのでしょうか。これは、分子が光としてエネルギーを放出するからです。
ほとんどの分子は、電子が安定した場所(基底状態)に位置しています。ただ光エネルギーが分子に当たったとき、光からエネルギーを受け取った結果、電子は不安定な軌道へ移ります。この現象を電子遷移といいます。不安定な状態は励起状態と呼ばれており、電子は不安定な状態を嫌います。
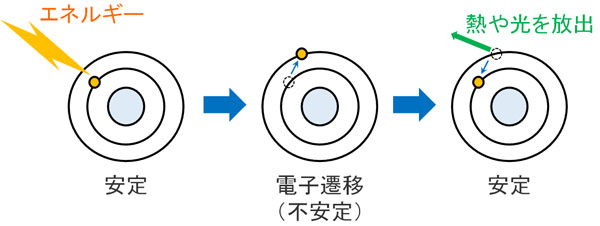
そこで、電子はエネルギーを放出することで安定の状態に戻ろうとします。ずっと励起状態のままで留まっていることはありません。
多くの場合、エネルギーを放出するとき、分子はエネルギーを熱として出します。しかし中には熱ではなく、光としてエネルギーを放出する物質が存在します。構造の中に共役がある化合物では、光エネルギーを放出する確率が高くなります。
これが蛍光物質に光を当てたとき、蛍光を生じる簡単な原理です。光からエネルギーを受け取り、分子が光エネルギーを放出することで、蛍光が観察されます。
励起光と異なる蛍光スペクトルが長波長で測定される
重要なのは、当てた光(励起光)とは異なる波長が蛍光として観察されることにあります。例えばブラックライト(わずかに目で見える長波長の紫外線)を当てたとき、私たちの目に見える光が発せられます。
これは、励起光とは異なる波長の光(蛍光)が分子から発せられていることを意味しています。
先ほど述べた通り、光エネルギーを与えることで電子遷移を起こし、分子は励起状態になります。励起状態から安定した状態に戻りますが、すべて光エネルギーとして放出するわけではありません。それでは効率が悪いため、多くは熱エネルギーとして放出されます。
入ってくるエネルギーと放出されるエネルギーは同じなので、以下のように考えることができます。
- 励起光のエネルギー = 放出される熱エネルギー + 放出される光エネルギー(蛍光)

放出するエネルギーとしては、熱も含まれていることを理解しましょう。そのため励起光と放出される光エネルギー(蛍光)を比べたとき、熱エネルギーの分だけ、蛍光のエネルギーは弱くなっていると予想できます。
その結果、励起光に比べて蛍光は長波長(低いエネルギー)で色が観察されます。
ブラックライトは紫外線の一種でありエネルギーが高く、目に見えにくいです。そこでブラックライトを蛍光物質に当てると、目に見える光(低エネルギーの長波長の光)が観察されるようになります。
測定方法は励起スペクトルを含めた2つのピーク観測
なお一般的なスペクトルとは異なり、蛍光分光法では2つのピークが観測されるようになります。一つ目は励起スペクトルです。蛍光物質に光を当てる必要があり、出力する光が励起光です。励起光によって得られるデータが励起スペクトルです。
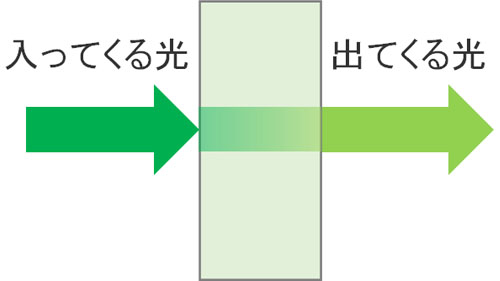
励起光を当てると、分子が光エネルギーを吸収します。つまり、出てくる励起光の光は弱くなっています。そこで励起光の強度を観測することで、励起スペクトルを得ることができます。
一方、励起光を当てることで蛍光が観察されます。励起光に比べて、蛍光は長波長となることは既に説明しました。そのため励起スペクトルだけでなく、蛍光スペクトルも得られます。
- 励起スペクトル:出力する光によって得られるデータ
- 蛍光スペクトル:蛍光として観察される光のデータ
2つはこうした違いがあります。
励起スペクトルについては、分子が光を吸収した結果として得られるため、吸収スペクトルと呼ばれることもあります。厳密には、励起スペクトルと吸収スペクトルは違います。ただ両者は非常に似ており、違いを理解する意味はほとんどないため、同じものと理解しましょう。
一方、励起スペクトルと蛍光スペクトルはまったくの別物です。両者の違いを理解しましょう。いずれにしても、蛍光分光法では励起光と蛍光で2つのスペクトルデータを得られると考えましょう。
長く弱く続く蛍光現象がりん光
なお蛍光を考えるとき、りん光についても同時に学ぶケースが多いです。蛍光とりん光は似ていますが、性質は違うものになります。
ブラックライトを当てたとしても、光を遮断すれば、蛍光は見られなくなります。蛍光というのは、励起光が当たっているからこそ観察されます。
一方で蛍光物質の中には、光の照射をやめたにも関わらず、一定時間について光を発し続けることがあります。これをりん光といいます。例えば以下の写真は、日中に太陽の光を受けて、りん光によって夜に輝く道です。

蛍光では、光がなくなった瞬間に光を発するのをやめます。一方でりん光では、光が当たらなくなったとしても継続して発光します。
りん光を生じる原理:項間交差と励起三重項状態
それでは、なぜりん光を生じるのでしょうか。励起光が当たったとき、電子遷移を起こして励起状態となります。その後、電子は基底状態(元の状態)に戻ります。このとき、蛍光を発します。
一方で分子によっては、励起光が当たった後に電子スピンの状態が変わることがあります。これを項間交差といいます。
通常、電子スピンは互いに反対の方向を向いています。これを励起一重項状態といいます。一方で項間交差が起こると、電子スピンが同じ方向を向くことになります。この状態を励起三重項状態といいます。
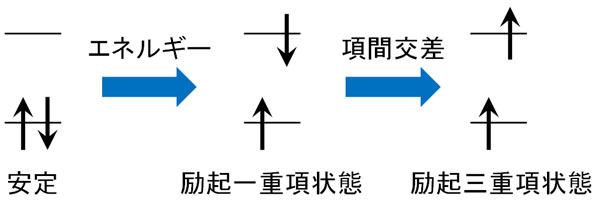
励起光が当たった後、前述の通り分子によっては項間交差を起こします。励起三重項状態になった後、電子はエネルギーの低い基底状態へと戻ろうとします。
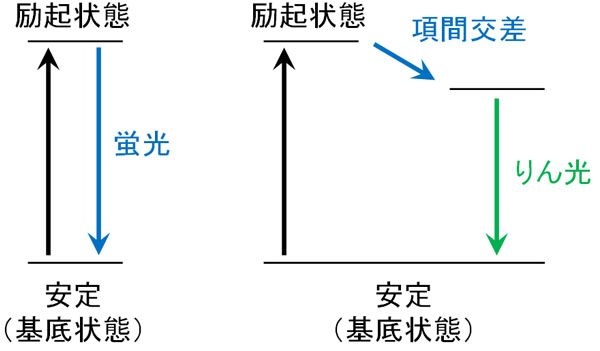
ただ注意点として、電子は同じ方向を向いたまま軌道に入ることはありません。それぞれ対となり、反対側の方向を向いていなければ軌道に入れません。これをパウリの排他原理といいます。
安定したエネルギー状態に戻りたくても、電子スピンが同じ方向を向いているため、簡単に戻ることができません。その結果、りん光として弱い光を長く発し続けるようになります。
光が当たらなくなった後、蛍光はすぐに光がなくなります。一方でりん光では、ずっと光が残り続けます。このような違いがあるのは、電子スピンの向きが異なるからです。
蛍光の度合いを測定すれば化合物濃度が分かる
それでは、こうした蛍光をどのように科学実験に活用するのでしょうか。これについて、濃度測定に利用されます。
光を蛍光物質へ当てた後、蛍光を観測することができます。このとき溶液に含まれている蛍光物質の濃度が高ければ、観測される蛍光の強度も強くなります。そこから、溶液中に含まれている濃度を測定できるのです。
励起スペクトルを見れば、「どの波長を当てれば蛍光物質を励起させることができるのか」が分かります。また蛍光スペクトルを見れば、「どの波長の光が強く放出されるのか」が分かります。これらを測定すれば、「励起させる光」「蛍光として観測する光」を決定できます。
例えば、反応が進むことで蛍光物質に色が付くのであれば、どれだけ蛍光物質が溶液中に存在するのかを確認することで、分子の様子を知れるようになります。
紫外可視吸収スペクトルなどのように、光の吸収を測定する技術では欠点がいくつかあります。その中でも最も大きな欠点としては、共役構造を有する有機化合物が非常に多く、ほとんどのケースで紫外線を吸収してしまうことがあげられます。
吸収スペクトルが観測されたとしても、ターゲット化合物による吸収スペクトルかどうかは不明です。
一方、蛍光は物質固有の光です。そのため複数の物質が混じっていたとしても、発せられる蛍光の強度を測定することで、調べたい物質が存在するかどうかをピンポイントで測定できます。蛍光を発する物質が少ないのは欠点ですが、蛍光を発する物質を利用することで科学実験の精度が高くなります。
溶媒効果や温度でスペクトルの波長・強度が変わる
なお、蛍光分光法を利用するときはその他の影響を考慮するようにしましょう。蛍光を発するのは、分子固有の能力だといえます。ただ、どの蛍光を発するのかは、周囲の環境によって変わります。
例えば溶かす溶媒が違えれば、蛍光スペクトルの波長や強度が変化します。つまり観察される蛍光波長の長さや、どれだけ強い蛍光が発光されるのかを含め、多くの要素が違ってきます。これを溶媒効果といいます。
溶媒効果のため、蛍光測定の科学実験をするときは同じ溶媒を利用し、条件を統一させなければいけません。
また考慮するべきは、溶媒効果だけではなく温度も関係してきます。蛍光強度は温度によって影響を受けます。温度が高くなるほど、蛍光強度は弱くなります。つまり温度が高いと、蛍光スペクトルのピークが弱くなり、結果として正しいデータを得られなくなります。
蛍光の測定では、周囲の環境による影響を受けることがあります。そこで、測定時はすべての条件を同じにしましょう。
溶媒のラマン散乱(ラマンスペクトル)など、ゴミピークを取り除く
また蛍光を測定するとき、ターゲット化合物だけの蛍光スペクトルを計測できればいいのですが、必ずしもそのようになるとは限りません。その他のゴミピークが観測されることもあります。
例えば、蛍光スペクトルを測定するときに観測されるものとして、ラマンスペクトルを得られることがあります。物質に光を当てたとき、散乱する光の一種にラマン散乱があります。ラマン散乱が観測されることで、ラマンスペクトルを得られます。
他には、溶媒による蛍光ピークを観測することもあります。
しかし蛍光分光法の場合、調べたいのはラマン散乱や溶媒による光ではありません。そこで溶媒だけで蛍光スペクトルを計測し、このとき観測されるスペクトルを差し引くことで、ターゲット化合物の蛍光スペクトルを得ることはよくあります。
これら不要なピークを省くと、以下のようなきれいなピークとなります。
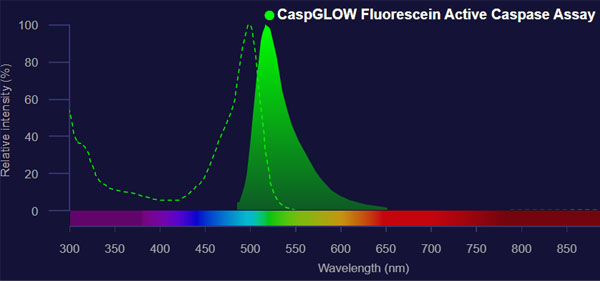
励起スペクトルと蛍光スペクトルの両方が掲載されているデータです。蛍光分光法では、必ず励起スペクトルと蛍光スペクトルの両方が存在します。
何も操作をしない場合、ラマンスペクトルや溶媒などその他のピークが混じることはよくあります。そこで、ブランクとして溶媒だけの測定をするのが一般的です。
蛍光団を有する化合物を実験に利用する
蛍光をもつ物質は科学実験で多用されます。ただターゲット化合物がたまたま、蛍光を有することはほとんどありません。蛍光を発する物質は限られており、化合物の数としては少ないです。
そこで蛍光を生化学などの実験で利用する場合、蛍光団を有する化合物を利用します。前述の通り、クロロフィルやクマリン、フルオレセイン、ローダミンなど、これらは蛍光を発する物質(蛍光団)として知られています。
例えば、抗体に蛍光団をくっつけます。抗体は特定の物質とのみ結合する性質があるため、抗体を細胞内に入れたとき、どこに抗体が集まっているのか可視化することができます。
以下のように、蛍光を利用した生化学の実験はたくさん行われています。
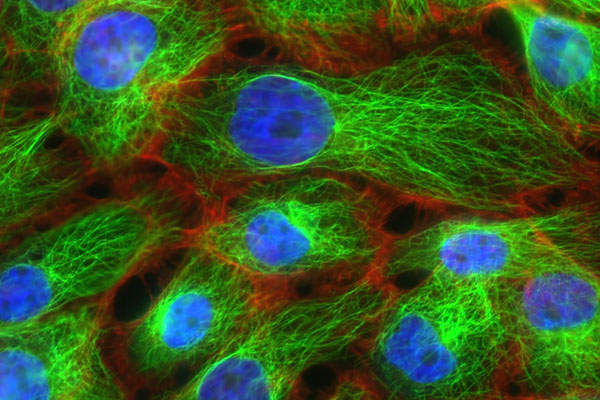
上の写真は、「蛍光分析法によって含まれている化合物の濃度を測る」という手法ではありません。ただ、蛍光物質を利用することで、分子の動きを把握できるようになります。
また試薬に蛍光団を結合させてもいいです。ターゲット化合物と試薬が反応することで蛍光を発するようにさせれば、蛍光の強さを測定することで、「どれだけターゲット化合物が含まれているのか」についての濃度を測定できます。
他には、鉱物の鑑定で蛍光分光法を利用することはよくあります。蛍光を利用することで、本物の宝石かどうかを見分けることができます。また蛍光の強さから、鉱物の等級を見極めることもできます。
蛍光分光法の光源としてはキセノンランプが一般的に利用されます。こうした光を当てることで、蛍光強度を測定します。
2008年のノーベル化学賞はGPF(緑色蛍光タンパク質)の研究
参考までに、2008年のノーベル化学賞の受賞者は蛍光に関する研究をしていました。GFPと呼ばれる緑色蛍光タンパク質の研究により、ノーベル賞を受賞したのです。
タンパク質としてGPFが存在し、GPFは蛍光を発します。そこで蛍光を利用することで、蛍光タンパク質が細胞のどこに存在するのかを確認することができます。分子イメージング(分子がどこに存在するのかを可視化する技術)で欠かせないのが蛍光タンパク質です。
また蛍光強度を測定することで、目的とする分子がどれだけ存在しているのかを確認することも可能です。
GFPは遺伝子組み換え技術や分子イメージング、分子移動の可視化など、あらゆる分野で活躍しています。
蛍光物質は科学技術の分野で欠かせない物質の一つです。分かりやすい例としてノーベル化学賞でのGFP(緑色蛍光タンパク質)を挙げましたが、生化学の分野で蛍光が非常に重要であることを理解しましょう。
化学で重要な蛍光スペクトルの原理と応用
生化学や有機化学を含め、化学を専攻する人であれば、非常に重要な学問の一つに蛍光があります。蛍光スペクトルを観測することで、分かることは非常に多いのです。
過去には、蛍光の研究によってノーベル化学賞を受賞した例があります。GFP(緑色蛍光タンパク質)がこれに該当し、分子イメージングでは欠かせない物質となっています。
蛍光分光法により、蛍光強度を測定するとなると、重要な内容ではないように思えてしまいます。ただ、蛍光を実験で利用する研究機関は多いです。蛍光を利用するからこそターゲット化合物がどこに存在するのか認識できます。また、蛍光強度を測定することで濃度がわかります。
分析手法の中では、紫外可視吸収スペクトルと同じように重要な分析手法の一つです。蛍光の原理や応用を含め、理解するようにしましょう。






