NMR(核磁気共鳴)は化合物の構造決定のときに重要です。プロトン(水素)の環境を調べることで、構造式を推測できるようになります。
ただNMRをあなたが実施するとき、特別な知識が必要になるものとしてベンゼン環があります。ベンゼン環について、どのようにカップリングするのか理解しておかないと、NMRのピークを見たときに構造式を推測することができません。
ベンゼン環で特に重要なのは、オルト位やメタ位の環境がどうなっているのかだといえます。これにより、化学シフトの様子が異なってきます。同時に、ベンゼン環に存在する置換基も重要だといえます。
NMRでは、ベンゼン環の化学シフトがどうなるのか理解するからこそ、構造決定できるといえます。そこで、どのようにベンゼン環での1H-NMRを理解すればいいのか解説していきます。
もくじ
オルト位とメタ位でピークのカップリングが異なる
アルキル鎖のカップリングであれば、隣の水素にだけ着目すればいいです。隣にある水素の影響を受けて、カップリングします。その結果、以下のようにピークが分裂します。
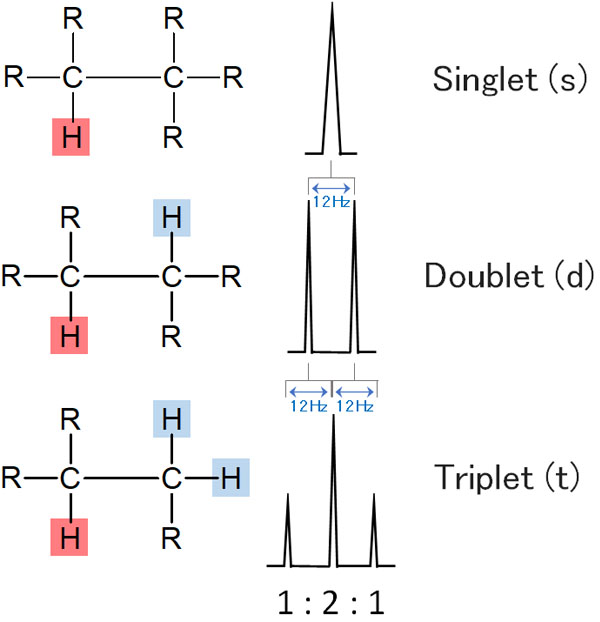
これと同じことはベンゼン環でも起こります。ただベンゼン環の場合、オルト位にある水素の影響を受けるのは当然として、メタ位にある水素の影響まで受けるようになります。そのため、少し複雑なピークが出現します。
ベンゼン環のパラ位にある水素については、カップリングの影響を受けません。そのため無視できますが、オルト位とメタ位については、プロトン(水素)がどのようなピークを示すのか理解しなければいけません。
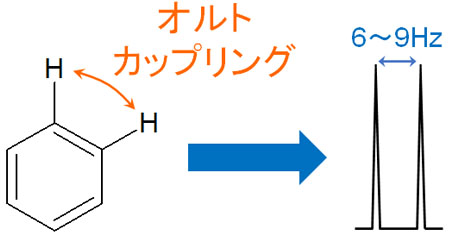
オルトカップリングはJ値が大きい
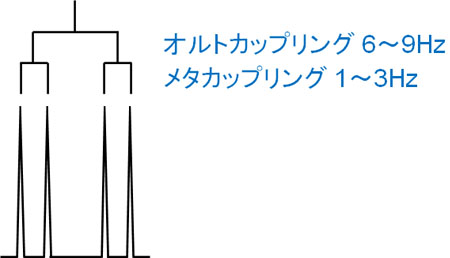
その他の水素との距離が近ければ、その分だけプロトンは大きく影響を受けるようになります。ベンゼン環のオルト位について、水素原子が存在する場合、J値は大きくなります。
これとオルトカップリングといいますが、6~9HzほどのJ値でカップリングします。
距離が近ければ相互作用が大きくなり、J値が大きくなるのは容易に予想できます。
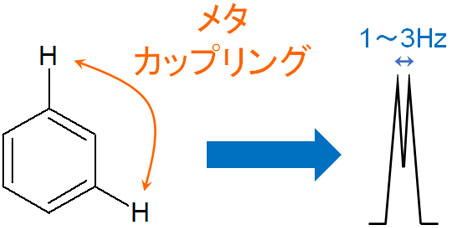
メタカップリングはJ値が小さい
一方でメタ位にある水素原子の影響を受けるのがベンゼン環です。隣の炭素原子に水素が結合しているのは当然として、別の水素原子も確認しなければいけません。そこで、ベンゼン環のNMR(核磁気共鳴)ではメタ位にも着目しましょう。
これをメタカップリングといいますが、ベンゼン環のメタ位に水素原子がある場合、J値は1~3Hzとなるのが一般的です。
オルト位に比べると距離が離れるため、その分だけJ値が低くなってしまうのがメタカップリングです。
ケースごとに確認するベンゼン環のカップリング
それでは、実際にベンゼン環を有する化合物のNMRを測定すると、どのようにピークが観察されるのでしょうか。実例をもとに考えなければ理解できないため、ここでは複数の事例を提示しながら確認していきます。
それぞれ以下のようになります。
オルトカップリングだけのベンゼン環
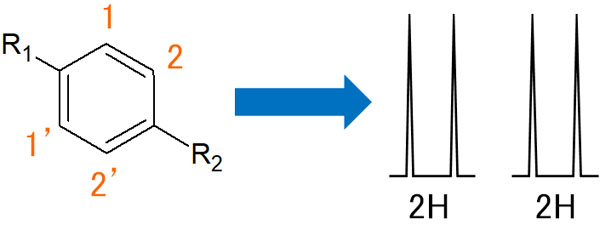
この化合物の場合、オルトカップリングだけすることになります。隣にある水素原子とのみ、相互作用してカップリングします。その結果、2つのダブレットが表れます。
人によっては、「1と1’がメタ位で相互作用し、カップリングするのではないか」と考えるかもしれません。ただ、1と1’の水素は完全に性質が同じです。自分に対して相互作用することはないため、結果としてメタカップリングは起こりません。
なお、NMRで観測されるベンゼン環のプロトンは2H(水素原子2つ分)となります。同じ性質の水素原子が2つあるため、プロトン2つ分の積分値が計測されると理解しましょう。
置換基が3つのベンゼン環でのカップリング
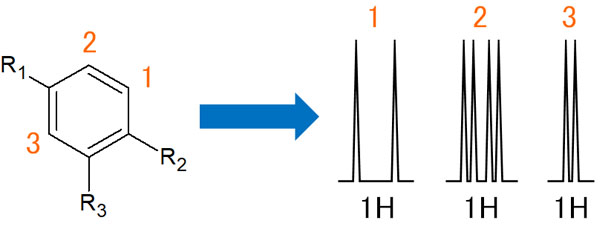
次に、上図のような配置で置換基が3つあるベンゼン環を考えていきます。
1の位置からは、相互作用するのは2のプロトンだけです。その結果、オルトカップリングによってダブレットになります。
一方で2の水素原子はどうでしょうか。一番目に、1のプロトンの影響を受けます。つまり、オルトカップリングします。さらに、3の位置にある水素原子の影響も受けてメタカップリングします。以下のようになります。
オルトカップリングとメタカップリングの両方を考慮すると、四重線としてスペクトルが出現するのです。
メタ位置換基でのプロトンのカップリング
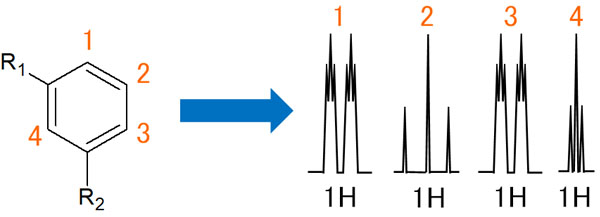
メタ位に置換基がある、上図のベンゼン環の事例を確認していきます。
1のプロトンからみると、2の水素原子でオルトカップリングします。そのため、ダブレットになります。また、3と4のプロトンとメタカップリングするため、それぞれのダブレットについて、小さいトリプレットが観測されます。
一方、2の水素原子と相互作用するのは1と3のプロトンだけです。オルトカップリングすることにより、トリプレットが表れます。
3の水素原子では、2のプロトンとオルトカップリングをしてダブレットになります。その後、1と4の水素とメタカップリングし、小さいトリプレットが表れます。
また4の水素原子だと、1と3の水素原子とメタカップリングします。その結果、非常に小さいトリプレットが出現します。
オルト位置換基でのカップリングの様子
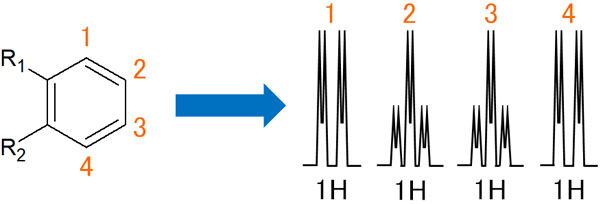
オルト位にそれぞれ置換基をもつベンゼン環があるとします。このとき、NMR(核磁気共鳴)でのピークスペクトルはどのようになるのでしょうか。
1の水素では、2のプロトンとオルトカップリングします。つまり、ダブレットになります。その後、3のプロトンとメタカップリングします。その結果、ダブレットはさらに2つに分裂します。同じ現象は4の水素原子でも起こります。
一方、2のプロトンはどうでしょうか。2のプロトンは1と3の水素原子とオルトカップリングしてトリプレットになります。その後、4の水素原子とメタカップリングし、それぞれのピークは2つに割れます。3の水素原子のスペクトルは、2の水素のピークと同じようになります。
・置換基が同じ場合、ピークは重なる
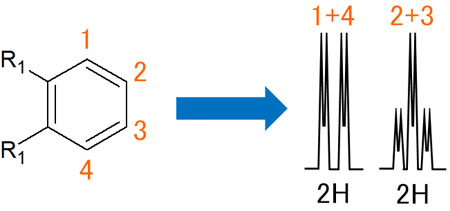
なおオルト位の置換基が同じ場合、1と4、2と3の水素原子は性質が同じです。つまり、完全に同じものとみなすことができます。その結果、観測されるスペクトルのピークは重なります。
置換基が同じかどうかによって、観測されるスペクトルは異なるようになります。
置換基が一つのベンゼン環のスペクトル
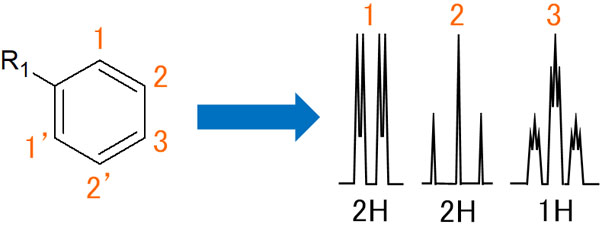
一方、置換基が一つだけのベンゼン環では、NMRのピークはどのように観測されるのでしょうか。
まず、1の水素原子に着目しましょう。このとき、2のプロトンとオルトカップリングしてダブレットになります。その後、3の水素原子と相互作用して、ピークはさらに2つに割れます。
注意点として、1と1’は同じ水素です。そのため、メタカップリングはしません。また同じ性質の水素のため、ピークは重なり、水素2つ分の積分比で観測されます。自分と同じ性質の水素原子とは相互作用しないと理解すればいいです。
一方、2の水素原子はどうでしょうか。2のプロトンは1と3の水素原子とオルトカップリングします。そのため、トリプレットが観測されます。2’は同じ性質の水素なので、メタカップリングすることはありません。
また3の水素原子だと、2と2’の水素原子とオルトカップリングします。そのため、トリプレットになります。その後、1と1’の水素原子とメタカップリングします。その結果、それぞれのピークは小さいトリプレットとなります。
低磁場・高磁場の化学シフトは置換基で推測する
このように考えて、ベンゼン環のNMRスペクトルを見ていきましょう。また次に考えるべきは、NMRの化学シフト(ピーク出現の位置)がどうなるかといえます。つまり、ピークが低磁場・高磁場のどこに観測されるのか理解しなければいけません。
同じベンゼン環であっても、置換基によって電子密度が異なります。そこで、置換基ごとの影響がどのようになるのか、前もって学んでおくようにしましょう。
このとき、以下のことを理解すればいいです。
- 電子供与基は高磁場シフトする:アミノ基、ヒドロキシ基など
- 電子吸引基は低磁場シフトする:ニトロ基など
考え方や原理は難しくないものの、NMRで出現したピークがどの水素原子なのか把握するため、化学シフトへの理解は必須です。
アミノ基、ヒドロキシ基など電子供与基は高磁場シフトする
電子密度が高いとき、より多くのエネルギーを与えないとピークは観測されません。ベンゼン環の置換基では、電子供与基としてアミノ基(-NH2)やヒドロキシ基(-OH)などが知られています。
アルキル鎖に窒素原子や酸素原子がある場合、電気陰性度の関係で電子は引っ張られ、結果として電子密度は低くなります。つまり、NMRの化学シフトでは低磁場シフトします。より低磁場にピークが観測されるのです。
一方でベンゼン環にアミノ基やヒドロキシ基が結合している場合、これらの置換基は電子供与基となります。つまり、ベンゼン環の電子密度が高くなります。その結果、電子供与基の影響を受ける水素原子だと、高磁場にピークが観測されます。
- -NH2
- -OH
- -NR2
- -OCH3
例えば、これらの置換基は代表的な電子供与基として知られています。もちろん、メチル基などアルキル鎖も電子供与基です。
ニトロ基など、電子吸引基は低磁場シフトする
一方で電子吸引基も存在します。ベンゼン環の電子を引き寄せることで、ベンゼン環の電子密度を低める置換基になります。これら電子吸引基には、以下が知られています。
- -COOH
- -C≡N
- -CHO
- -COOCH3
- -NO2
- -Cl
これらの影響をプロトンが受けると、NMRでの化学シフトは低磁場にピークが観測されます。例えば、以下の化合物があるとします。
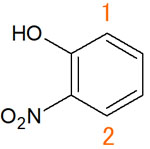
1の水素原子では、隣に電子供与基(-OH)が存在します。そのため、化学シフトは高磁場シフトすると考えられます。一方、2の水素原子は隣に電子吸引基(-NO2)があります。つまり、2のプロトンは低磁場にピークが表れます。
1と2の原子は、同じ形でピークが表れます。しかし、化学シフトの位置は異なります。ピークの出現位置が違うものの、どのピークがどの水素原子なのか置換基の位置から推測できます。
電子供与基や電子吸引基は覚えるしか方法がありません。そのため置換基の性質を理解した後、NMRの化学シフトがどこに表れるのか予測し、ピークごとに帰属できるようにしましょう。
1H-NMRのスペクトルの原理を理解し、帰属させる
NMRで最も頻繁に利用されるのが1H-NMRであり、最初の段階では1H-NMRのみ理解しておけば問題ありません。
アルキル鎖のカップリングについては、隣の炭素に結合する水素原子の影響を考えればいいです。しかしベンゼン環では、オルト位だけでなくメタ位の水素原子の影響も受けます。そこで、NMRのピークがどのように表れるのか理解しましょう。
また、置換基の影響による化学シフトも重要です。低磁場・高磁場とどこにピークが出現するのか推測しなければいけません。
こうしてピークの形や化学シフトの場所を予測できれば、それぞれのピークごとに帰属させることができます。また化合物の構造決定が可能になります。ベンゼン環のNMRは少し特殊なため、その特徴を理解するようにしましょう。






