化合物の分析手法はさまざまです。これら分析法の一つとして、赤外分光法が存在します。有機化合物を分析することで、化合物の中にどのような官能基(置換基)が含まれているのか判別するための分析手法です。
ただIRスペクトル(赤外吸収スペクトル)について、分析手法の中では利点は少なく、構造解析の点では欠点が多いです。そのため構造決定での利用頻度は少ないです。
一方で既知物質を測定したい場合であれば、IRスペクトルの解析は意味があります。既に知られているターゲット化合物が含まれているかどうかを知りたいとき、赤外分光法(赤外吸収分光法)が役に立ちます。
大学で化学を専攻する人は赤外分光法について学びます。これらの理論を学べば、なぜ既知物質の測定でなければ意味がないのか理解できるようになります。そこで赤外分光法の原理や特徴、利点・欠点について、どのようになっているのか解説していきます。
もくじ
理論や見方を理解する:構造分析では欠点が多い
有機化合物を合成したり、新たな未知物質を抽出したりしたとき、構造決定をしなければいけません。例えば新規化合物を合成したときしても、目的の合成化合物を得られたかどうか不明です。そこで化合物を分析します。
また物質を抽出して、複数の化合物を単一物質に分けることはよくあります。この場合、どの化合物がターゲット化合物なのか構造式を確認する必要があります。
多くの場合、構造式の決定ではNMR(核磁気共鳴)やMS(質量分析)などの分析手法を行います。これらは明確にピークを見分けることができ、構造決定で多くの化学者が利用します。
一方で前述の通り、赤外分光法は構造解析での利点が少なく、欠点が多いのでほとんど利用されません。この理由としては、IRスペクトル(赤外吸収スペクトル)が明確でないからです。例えば、以下のようにスペクトルのピークが観察されます。
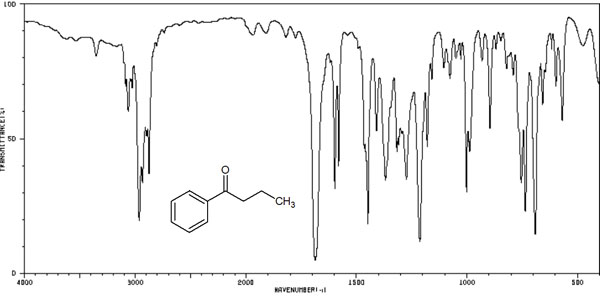
これらのピークを見ても、得られる情報はほとんどありません。
IRスペクトルでは、「官能基の有無が分かる」といわれています。ただ、対象の官能基が1つだけなのか、それとも複数あるのか赤外吸収スペクトルを見ても分かりません。NMRやMSであれば、これらを詳細に判別できます。しかし、赤外分光法では無理です。
IRスペクトル(赤外吸収スペクトル)のピークをみても、大まかにしか構造式が分かりません。少なくとも、赤外分光法だけで構造式を推測するのは不可能です。大まかなデータしか得られないという欠点から、分析手法での重要度は低いです。
分子は伸縮(伸縮振動)や折れ曲がり(変角振動)が可能
原子同士がつながることで、分子が形成されます。分子の結合は固くつながっているわけではありません。バネのように、伸び縮みできるようになっています。
分子は振動しています。例えば水分子であれば、以下のように結合の伸び縮みがあります。
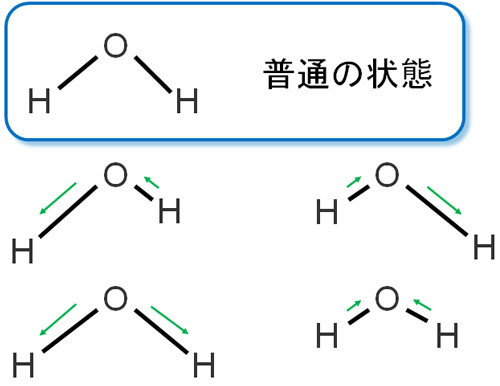
分子同士の結合はバネと同じように、伸びたり縮んだりすることを理解すればいいです。これを伸縮振動といいます。
またバネであるため、伸び縮みするだけではありません。結合角が曲がり、通常の角度とは異なる状態になることもあります。
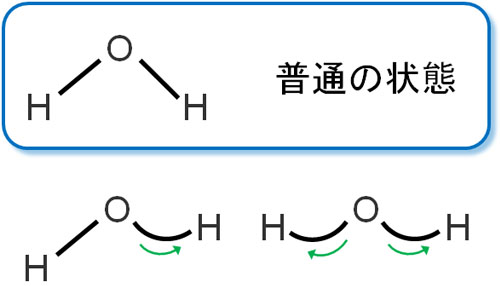
このように結合が振動することで、結合角が変わることを変角振動といいます。
同じ分子であったとしても、伸縮振動は変角振動では観測されるスペクトルが異なります。つまり、同じ分子から異なる2つのピークが観測されると理解しましょう。
バネの強さにより、振動スペクトルのピークが異なる
それでは、なぜこうした分子の振動が起こるのでしょうか。伸縮振動や変角振動によって観測されるピークを振動スペクトルといいます。振動スペクトルは、分子が赤外線を吸収することで発生します。
分子が伸縮したり回転したりするのは、赤外線によるエネルギーだからこそ起こるものだと考えましょう。赤外線を吸収した分子は結合角が伸縮・回転するため、このときのエネルギーをピークとして観測するのです。これが、IRスペクトル(赤外吸収スペクトル)の原理です。
また分子同士の結合はバネと同じであるため、赤外分光法によって観測されるピークは結合の種類によって異なります。
例えば、結合には二重結合や三重結合があります。二重結合のアルケン(-C=C-)と三重結合のアルキン(-C≡C-)を比べたとき、どちらのほうがエネルギーは強いでしょうか。
結合が増えているため、アルキン(三重結合)のほうがバネとしての結合は強いと予想できます。つまりアルキンのほうが振動数は多いです。
酸素や窒素など左右対称の分子は観測されず、水や二酸化炭素は吸収がある
ただ赤外分析法によって赤外線を照射しても、赤外線を吸収しない分子が存在します。まず、左右対称の分子は赤外線を吸収しません。赤外線を吸収して伸縮振動や変角振動をしないため、IRスペクトル(赤外吸収スペクトル)は観測されません。
左右対称の分子としては酸素(O2)や窒素(N2)などが知られています。これらの分子は左右対称のため、赤外分析法で観察するのは不可能です。
一方で水や二酸化炭素はどうなのでしょうか。分子の構造を見ると、左右対称のように考えてしまいます。しかし、水や二酸化炭素の伸縮では以下の2パターンが存在します。
・2つの結合が同時に伸び縮みする

・2つの結合が互いに伸び縮みする

2つの結合が同時に伸び縮みするケースについては、左右対称です。つまり、IRスペクトルは観察されません。
一方で、2つの結合が交互に伸び縮みするパターンは左右対称ではありません。赤外線照射をしたとき、スペクトルのピークが観察されます。水や二酸化炭素でIRスペクトル(赤外吸収スペクトル)が見られるのは、これらの分子が赤外線を吸収し、振動するからです。
二酸化炭素は温室効果ガスと呼ばれており、地球温暖化の原因物質といわれています。これは、二酸化炭素が赤外線を吸収するからです。
赤外線は温める作用があります。私たちの体に赤外線を当てると暖かくなるのは、赤外線のエネルギーが熱に変わるからです。また二酸化炭素が増えるほど地球温暖化が進行するのは、二酸化炭素が赤外線を吸収し、空気全体を温めるからだといえます。
酸素や窒素ではなく、なぜ二酸化炭素が温室効果ガスなのかについて、赤外線の性質や分子が振動する原理の会得によって理解できます。
赤外分光法で重要なのは官能基ごとのスペクトルピーク
それでは、赤外分光法を利用することで何が分かるのでしょうか。以前に述べた通り、IRスペクトルのピーク情報から私たちが読み取れるのは、官能基の有無です。
官能基(置換基)によって、スペクトルのピークが異なります。赤外分光法では400〜4000cm-1の間で測定し、数字が大きいほど高エネルギーであることを表します。
このとき、高波数の側から順に以下のようにピークが観測されます。
- 水素を含む単結合
- 三重結合
- 二重結合
- その他の単結合

厳密にいうと、この図は間違っています。伸縮振動や変角振動によって、観測されるピークの場所がまったく違うからです。
しかし、エネルギーの違いによってどの場所にピークが観察されるのか、頑張って覚える意味はありません。赤外分光法は構造決定で利用されない分析手法であるため、ピークの見方について概要さえ理解できればいいです。
「結合や官能基の種類によって、どのエネルギーでピークが観測されるのか」について、スペクトルの見方を大まかに理解するようにしましょう。
・水素を含む単結合のピーク
IRスペクトルでは、水素を含む単結合は2500cm-1以上に伸縮振動のピークが観察されます。以下の結合に関するピークがこのエリアで見られます。
- C-H
- O-H
- N-H
これら水素を含む結合の中でも、重要なのが3000cm-1以上にあるピークです。赤外吸収スペクトルでは、3000cm-1の付近に着目するといいです。
・三重結合のピーク
構造式の中に三重結合があると、2000~2500cm-1でピークが見られます。以下の構造式を有する化合物が該当します。
- C≡C
- C≡N
アルキン(C≡C)やニトリル(C≡N)は三重結合をもつため、この周辺にピークが観察されます。
・二重結合のピーク
化合物が二重結合を有していると、1500~2000cm-1でIRスペクトルが出てきます。以下のような官能基が該当します。
- C=C
- C=O
アルケン(C=C)やカルボニル基(C=O)などの構造を有する場合、この周辺にIRスペクトルのピークが存在します。
・その他の単結合のピーク
あらゆる分子で単結合を有します。前述の通り、酸素や窒素、水素など左右対称の分子は赤外線を吸収しません。つまり、赤外吸収スペクトルを観測できません。
しかし、それ以外の物質であれば多くが赤外線を吸収し、ピークを観測できます。これら単結合のピークは500~1500cm-1でピークが見られます。
- C-C
- C-O
- C-N
これらの結合があれば、ピークが観察されるようになります。ただどの化合物も単結合を有するため、このエリアでは必ずというほど多くのピークが存在します。
カルボニル基やヒドロキシ基などの有無を調べられる
それでは、どのようなときに赤外分光法を利用するのでしょうか。化合物の構造を知りたい場合、カルボニル基(C=O)やヒドロキシ基(-OH)が存在するかどうかを確認するときに利用されます。
・C=Oの吸収スペクトル
IRスペクトルを未知化合物に対して利用するとき、「カルボニル基(C=O)を有するかどうかを確認するために活用する」と認識しましょう。
赤外吸収スペクトルの中でも、1650~1800cm-1の間には、カルボニル基(C=O)のピークしか現れません。また、カルボニル基は鋭いピークとして出現します。以下のようになります。
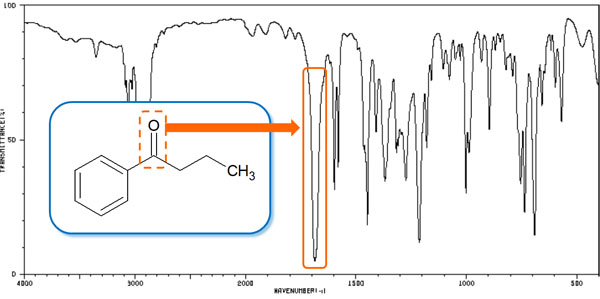
なおカルボニル基は1700cm-1でのピーク出現が基準です。しかし同じC=Oであっても、アミド(-CO-NH-)では、1650cm-1付近にスペクトルが表れます。またアミドの場合、ピークは1本ではなく2本です。
・O-HやN-Hの吸収スペクトル観察でも利用される
またカルボニル基以外では、ヒドロキシ基(OH)やアミノ基(NH2)などを調べるときにIRスペクトルを利用することもあります。
構造式の中に-OHがあると、3300cm-1の付近に強い吸収が出現するようになります。ただ同じ-OHの中でも、カルボン酸(COOH)も-OHを保有しています。構造式にカルボン酸がある場合、3300cm-1付近のピークはブロード(幅広いピーク)になります。
一方でアミノ基の-NHについても、3300cm-1の周辺にピークが表れます。ヒドロキシ基の-OHとアミノ基の-NHはどのように見極めるのでしょうか。-NHのほうがピークの形が鋭くなり、見分け方はこれだけです。
また-NH2のように、窒素に水素原子が2つある場合、3300cm-1の周辺に2本のピークが表れます。
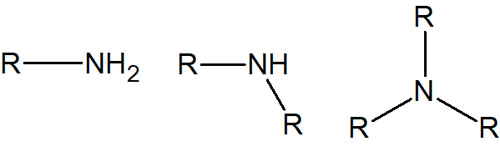
一方、R2-NHのような構造式だと、1本のピークが観察されます。それに対して、R3-Nはピークが出てきません。
650~1300cm-1は指紋領域と呼ばれる
しかし、実際には未知化合物の構造決定で赤外分光法を利用することはほぼありません。それでは、どのような場合に赤外吸収スペクトルは有効なのでしょうか。これについては、既知物質を観察するときに優れているといえます。
あらゆる物質で単結合をもちます。既に説明した通り、単結合は500~1500cm-1でピークが見られます。このエリアは単結合によるあらゆるピークが混ざり合い、かなり複雑なピークとなっています。また、わずかに構造式が違うだけでもピークの形が変わります。
そのためIRスペクトルでは、1300cm-1以下の部分を指紋領域といいます。
私たち人間は固有の指紋を有しています。人によって指紋の形が異なることから、犯人を捜すときに指紋を調べることがよくあります。指紋と同じように、化合物ごとに独自のピークの形があるのです。既知化合物については、指紋領域を確認することで同じ物質かどうかを判別できます。
例えば特定の薬物を調査するとき、赤外吸収スペクトルを取って指紋領域の形が既知化合物と一致すれば、同じ化合物だと推測できます。
すべての化合物にて、指紋領域の形は複雑です。高分子の測定ではさすがに無理ですが、小分子の化合物であればIRスペクトルは有効です。既知化合物と同じ物質かどうかを判断したい場合、赤外分光法が役に立ちます。
IRスペクトル(赤外吸収スペクトル)のポイントを整理する
調べたい化合物がどのような物質なのか、分析することは多いです。このときIRスペクトルを利用すれば、官能基を調べることができます。
ただ実際には、「構造式の中にカルボニル基が存在するかどうか」くらいしか調べることができません。官能基を帰属させようにも、読み取れる情報が少ないのです。これが赤外分析法の欠点であり、構造決定でほとんど利用されない理由です。
そうはいっても、既知物質と同じかどうかを調べたいときは有効です。指紋領域を比べたとき、形が同じなら、既知物質と同じ化合物だと推測できます。
これらの原理や性質を理解するようにしましょう。他の分析手法に比べると重要度は劣りますが、必要な場面があればIRスペクトルを活用するといいです。






