分子同士が互いに引き合ったり、反発したりすることがあります。これを相互作用といいます。化学での相互作用とは、分子同士が互いに影響しあうことを指します。また相互作用というのは、多くのケースで「分子同士が互いを引き合っている状態」を指します。
分子が結合して、共有結合を形成するのと相互作用は異なります。有機化学反応によって新たな結合を作れば、まったく新しい分子が作られます。このときの結合は共有結合です。ただそうではなく、分子同士の形はそのままだが、互いに引き合ってくっつこうとするのが相互作用です。
これを分子間相互作用(分子間力)といいます。分子同士が互いに相互作用を起こし、くっつこうとするのです。
分子間相互作用にはいくつか種類があります。双極子間相互作用や水素結合、ファンデルワールス力、疎水性相互作用(疎水効果)などが代表例です。このように分子間相互作用には種類がいろいろあるため、それぞれがどのような結合になっているのか解説していきます。
もくじ
電気陰性度の違いによって生じる分極
大まかに考えると、「非共有結合による結合」が分子間相互作用です。共有結合によって強固な結合を作っておらず、分子同士は互いに独立しているものの、その他の力によって互いにくっつくのです。そのため外部からエネルギーを加えると、くっついていた分子は剥がれます。
これら分子間相互作用を学ぶとき、分極について理解するのが第一ステップになります。高校化学でも分極を学ぶため、問題なく理解できると思います。電気陰性度の違いにより、電気密度の違いを生み出すのが分極です。
電気陰性度が強い原子としては、例えば酸素原子や窒素原子、ハロゲン原子が知られています。これらの原子が炭素に結合している場合、同じ分子であってもプラスとマイナスの電荷に分かれるようになります。
分極の例としては、水やアンモニア、塩化水素(HCl)などが知られています。
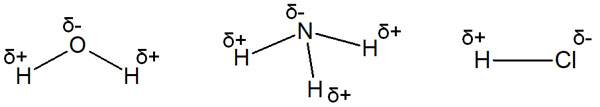
同じ分子であっても、プラスとマイナスの電荷に分かれる現象が分極です。電気陰性度の違いを生じた結果、プラスとマイナスの電荷を生じることを理解できればいいです。
分極で生じる双極子モーメント:極性分子と無極性分子
分極によって電荷の違いを生じるにしても、「分子が違えば、どれだけ電荷の偏りを生じているのか」が変わります。こうした極性の強さ(電荷の偏り度合いの大きさ)を双極子モーメントといいます。
電気陰性度の違いによって分極が大きくなるほど、極性は強くなります。その結果、双極子モーメントは大きくなります。
双極子モーメントでは、マイナスからプラスの電荷へとベクトルを記します。矢印を記すにしても、深く意味を考える必要はありません。要は、「分極がどれだけ大きいのか、または小さいのか」を記すのが双極子モーメントと理解しましょう。
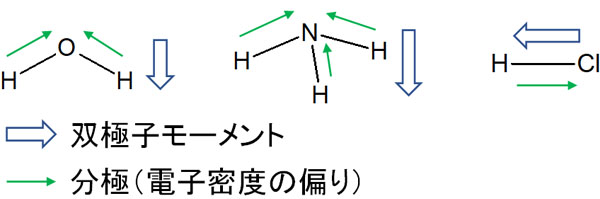
ちなみに有機化学では、電子の動きをとらえるのが重要です。マイナスの電荷を有する原子を起点として、他の分子を攻撃し、有機化学反応を起こします。
そのため有機化学では、双極子モーメントは利用されません。分極(電子密度の偏り)を表すとき、プラスからマイナスに矢印を書きます。双極子モーメントとは、矢印の向きが反対になります。マイナスの電荷を有する原子を起点に考えるのが一般的な有機化学です。
・極性分子(永久双極子)と無極性分子の概念
それでは、電気陰性度の強い原子が結合している場合、必ず極性をもつようになるのでしょうか。これについては、必ずしも極性があるとは限りません。分極していない分子はいくつもあります。左右対称の分子は分極がありません。
例えば、二酸化炭素(CO2)は左右対称です。そのため極性はありません。同じように、正四面体の形になっているメタンも分極していません。
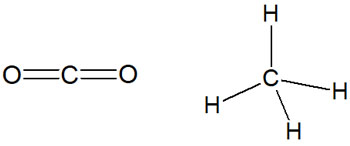
なお水やアンモニアのように、分極している分子を極性分子(永久双極子)といいます。一方で二酸化炭素やメタンのように、分極していない分子を非極性分子といいます。
双極子間相互作用によって分子同士が引き合う:Keesom相互作用
分極によって分子が極性をもつと、どのようになるのでしょうか。分子同士は互いに引き合うようになります。プラスとマイナスの電荷を有する部分では、相互作用することで引き合います。一方、プラスとプラス同士は反発します。マイナスとマイナスの電荷も同様です。
そうしたとき、これら分極によって互いに引き合うことを双極子間相互作用といいます。
双極子がイオンの電荷によって引き寄せられるケースでは、イオン-双極子相互作用といいます。溶液に溶けているとき、イオンとして存在する化合物では、双極子と引き合うようになります。
一方で双極子と双極子が引き合う場合、双極子-双極子相互作用(Keesom相互作用)といいます。イオンに比べると、双極子による電荷の違いは小さいです。そのためイオンと双極子による相互作用に比べると、双極子-双極子相互作用の力は弱くなります。
誘起双極子による相互作用:双極子-誘起双極子相互作用
それでは中性分子は相互作用しないのでしょうか。双極子でなければプラスやマイナスの電荷をもたないため、中性分子は相互作用しないように思ってしまいます。ただ、双極子をもつ分子と中性分子は相互作用し、互いに引き合います。
極性分子(分極している分子)を中性分子の近くに置くとどうなるでしょうか。双極子の影響により、中性分子は分子内で電荷の偏りを生じるようになります。つまり、双極子が生み出されます。

他の双極子(極性分子)の影響により、双極子が生み出されることを誘起双極子といいます。誘起双極子を生じると、双極子と相互作用することで互いに引っ張り合うことになります。これを双極子-誘起双極子相互作用(Debye相互作用)といいます。
分極している分子では、誘起双極子を引き起こすことで中性分子であっても互いに引き合うようになります。
ロンドン分散力による誘起双極子
それに対して、中性分子(無極性分子)はどうやっても相互作用することはないのでしょうか。実は、分極していない分子であっても相互作用し、互いに引き合うようになります。
無極性分子で相互作用をするのは変なように思ってしまいます。ただ同じ分子内であっても、電子は一ヵ所に留まっているわけではなく、分子内のいろんな場所に存在しています。
そこで、ある瞬間だけをとらえます。写真で一瞬を撮影するのと同じように、特定の瞬間だけをとらえれば、分子内で電子の偏りを発見することができます。瞬間的な電子の偏りを生じた結果、一瞬だけ分極し、中性分子であっても双極子をもつようになります。
これらの瞬間的な双極子が他の無極性分子に影響を与え、誘起双極子を引き起こします。その結果、中性分子だけ存在する空間であったとしても、互いに相互作用するようになります。これをロンドン分散力といいます。
中性物質は互いに引き合うことが知られており、これをファンデルワールス力といいます。無極性分子のファンデルワールス力については、ほぼロンドン分散力による相互作用だと理解しましょう。
水素結合は酸素、窒素、フッ素で生じる
これら分極や双極子モーメントについて学べば、水素結合について理解できるようになります。水素結合とは、文字通り水素と相互作用することで互いに引き合い、結合することをいいます。共有結合のような強固な結合ではないものの、水素結合では強めの力を生じます。
分極の度合いが大きく、双極子モーメントが大きいほど、互いに引き合う力は強くなります。極性の大きさで考えると、電気陰性度の高い原子に水素が結合している場合、分極が大きくなりやすいです。
具体的には酸素原子(O)や窒素原子(N)、フッ素原子(F)に水素原子が結合していると、分極が非常に大きくなります。その結果、分子に生じた双極子によって互いが強く引き合い、双極子-双極子相互作用によって強い結合が形成されます。
水素結合は双極子-双極子相互作用の一種です。ただ双極子-双極子相互作用の中でも、特に分極の度合いが大きく、強く引き合うのが水素結合です。水素原子は別の酸素原子や窒素原子、フッ素原子と引き合い、結果として水素結合を形成します。
水素結合には、他の分子と引き合うことがあれば、分子内で水素結合を作ることもあります。以下のようになります。
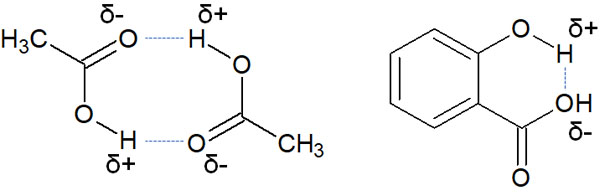
双極子同士の結合ではあるものの、水素原子と電気陰性度の強い原子が関与することで、強く引き合う相互作用が水素結合です。
タンパク質やDNAは水素結合している
それでは双極子間相互作用の中でも、なぜ水素結合だけ別に考えるのでしょうか。これは、水素結合による分子間相互作用(分子間力)が非常に重要だからです。
例えば私たちの体には多くのタンパク質が存在します。このとき、なぜタンパク質は特定の形をしているのでしょうか。これは水素結合が関与しているからです。アミノ酸がたくさん結合することで、タンパク質が形成されます。タンパク質はアミノ酸による一本の長い鎖といえます。
ただ、同じタンパク質(同じアミノ酸の配列)であると、タンパク質は折れ曲がることでどれも同じ構造をもちます。この理由としては、タンパク質の中で水素結合が相互作用し、互いに引き合っているからです。
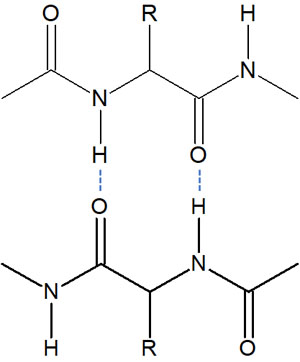
同じことはDNAにもいえます。DNAでは、2つの塩基対で形成されていることが知られています。これらは水素結合でつながっており、その結果としてDNAの二重らせん構造をもつようになっています。
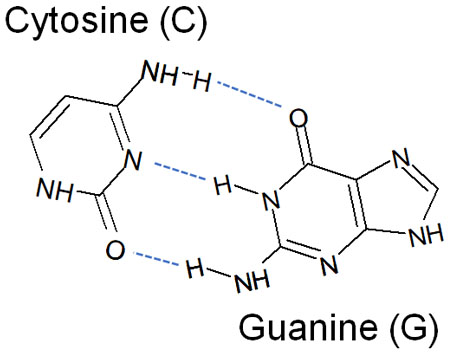
そのため、分子内の結合や有機化学反応だけでなく、生体内の様子を知るときであっても、水素結合を理解することは必須です。
分子同士が結合するファンデルワールス力
ここまで説明した双極子相互作用や水素結合に比べると、互いに引き合う力が弱くなるのがファンデルワールス力です。
分極が起こることで、双極子相互作用や水素結合を生じることを説明しました。ただ、中性分子であっても互いに引き寄せ合う力があります。これが前述のファンデルワールス力です。既に説明した通り、非極性分子が互いに引き合う力の大半はロンドン分散力です。
ロンドン分散力によって誘起双極子が引き起こされ、ファンデルワールス力として中性分子同士が引き合うと考えましょう。
ファンデルワールス力はほとんどの物質に存在します。つまり非極性分子であっても、あらゆる分子同士が互いに引き合うと理解するといいです。
レナード-ジョーンズポテンシャルによる反発
ファンデルワールス力で重要なのは、分子同士の距離だといえます。中性分子は引き合うものの、互いの距離が遠いと、引力は弱くなります。遠くにあるものを引き寄せるよりも、近くにあるものを引き寄せるほうが簡単です。
それでは、分子同士が近ければ近いほどファンデルワールス力による力は強くなるのでしょうか。実は、近づきすぎると今度は反発力が働くようになります。
分子には電子があります。電子は互いに反発するため、近づきすぎると電子同士が反発することで、エネルギーが高くなってしまうのです。
中性分子同士が遠いと、引力はなくエネルギー状態は高くなります(エネルギーがゼロに近づく)。一方で分子同士が近づきすぎても、反発が生まれることでエネルギーが高くなるのです。ファンデルワールス力では、遠すぎず近すぎずの状態を好みます。
このとき中性分子同士の距離をrとすると、ファンデルワールス力の引力はrの6乗に反比例します。距離が近くなるほど、rの6乗に反比例して引力が強くなると考えましょう。
一方、ファンデルワールス力の反発力はrの12乗に反比例します。分子の距離が近づくほど、rの12乗に反比例して反発力が強くなります。この法則については、そういうものだと理解するようにしましょう。
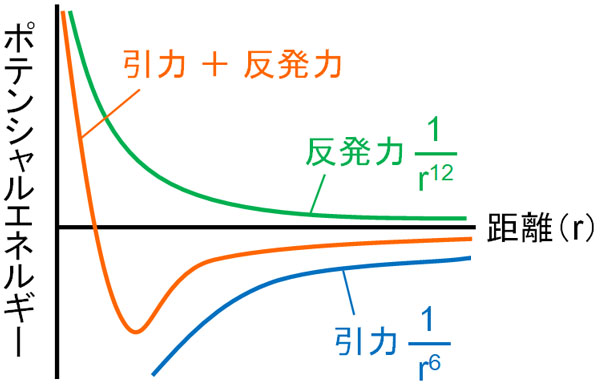
ファンデルワールス力の引力と反発力の両方を考慮したものがレナード-ジョーンズポテンシャルです。上図がレナード-ジョーンズポテンシャルです。
rの6乗に比べると、rの12乗のほうがカーブは急です。そのため分子同士が程よい距離にある場合、互いに引き合うことでエネルギーが低くなります。反発力に比べて、引力の方が強いため、ファンデルワールス力によって互いに引き合います。
一方で距離が近すぎると、反発力によるエネルギーが非常に高くなります。引力よりも反発力のほうが強くなるため、距離が近すぎると互いに反発します。
レナード-ジョーンズポテンシャルという言葉だけを考えると、非常に難しいです。そこで分子同士の引力と反発力をまとめたのがレナード-ジョーンズポテンシャルだと気づくと、その意味を理解できるようになります。
疎水性相互作用(疎水効果)によるエントロピーの増大
分子間相互作用(分子間力)としては、疎水性相互作用も分子同士が引き合う力として重要です。疎水性相互作用とは、脂溶性の分子同士が互いに引き合う力のことだと理解しましょう。
私たちの生活にとって最も身近な液体は水です。水と油は性質がまったく異なるため、互いに混じり合うことはありません。そうしたとき、水の中に油が浮かんでいるとどうでしょうか。2つの油がある場合、水を避けるためにこれらの油は互いにくっつきます。

このように、油同士がくっつこうとする力が疎水効果です。また、これら疎水性相互作用(疎水効果)にはエントロピー増大が関与しています。
放置していると、乱雑な状態へと進んでいくことをエントロピー増大といいます。庭を放置していると、雑草が生えてきて荒れてきます。整理整頓しないと、部屋は散らかっていきます。自然法則では、物事はすべて乱雑になるように動きます。
これは油も同じです。水の中に油があると、油の周囲に水が存在するようになります。ただ、油同士がくっつくとどうでしょうか。油(疎水性分子)の周囲にあった水に着目すると、自由に動き回れる水分子の数が多くなります。

いくつもの疎水性分子が水に浮かんでいるよりも、これらの油がひとつになって存在しているほうが、自由に動き回れる水分子の数が多くなるのです。たくさん水分子が動き回れるほど、水のエントロピー(乱雑さ)は増大します。これが、疎水性相互作用(疎水効果)が起こる理由の一つです。
ミセル形成は疎水性相互作用の応用例
化学を学ぶとき、ミセルを勉強することになります。親水性と疎水性の部位を同じ分子内にもつ化合物により、形成されるのがミセルです。いわゆる界面活性剤のことであり、身近な界面活性剤の例として洗剤が挙げられます。洗剤はミセルを作ります。
界面活性剤を水の中に入れると、親水性の部分は水とくっつくようになります。水素結合などにより、水と積極的に相互作用するのです。
一方で疎水基については、水とできるだけ接しないようにします。いわゆる疎水性相互作用であり、水との接触部分を少なくするのです。また、疎水性部分はファンデルワールス力によっても互いに引き合うようになります。
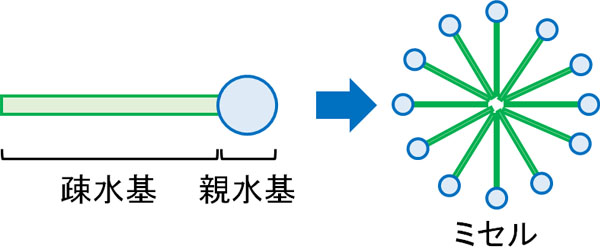
その結果、ミセルは水中で集合体を作るようになります。こうして、ミセルは水中で安定化します。
界面活性剤によって水中でミセルを作れば、油(皮脂などの汚れ)は疎水性部分に取り込まれます。その結果、洗剤として脂汚れを落とせるようになります。ミセルの応用例で最も分かりやすいのは洗剤ですが、医療や食品などあらゆる分野でミセルは応用されています。
分子間力により、分子同士が引き合う力を学ぶ
分子が結合するとき、共有結合やイオン結合(クーロン力)など、いくつかの種類があります。
これらの結合の中でも、分子同士が引き合う力によって互いにくっつこうとする力が分子間相互作用(分子間力)です。共有結合のように強い力ではないものの、分子同士が引き寄せ合うのです。これら分子間相互作用では、特に以下が重要です。
- 双極子相互作用
- 水素結合
- ファンデルワールス力
- 疎水性相互作用
分子の分極について理解すれば、双極子相互作用や水素結合、ファンデルワールス力がなぜ起こるのか理解できます。疎水性相互作用は少し考え方が違うものの、分子間相互作用を学ぶときは欠かせません。
これらの種類や違いについて学び、分子間相互作用による影響を理解するようにしましょう。






