化学物質の構造解析をすることで、溶液中にどのような化合物が含まれているのかを調べることは重要です。これらの化合物の構造解析をすることで存在する分子やタンパク質を調査することが可能です。
これら溶液中にどのような物質が含まれているのかについて、調べる方法としてHPLC(高速液体クロマトグラフィー)やMS(質量分析法)が頻繁に活用されています。ただ、これらを組み合わせた手法が広く活用されています。
LC/MS、MS/MS、LC/MS/MSなどが、これらの手法に該当します。違いは何かというと、これらの分析手法はHPLCとMSを組み合わせたものと理解しましょう。
それでは、どのような原理によって溶液中の物質を調べるのでしょうか。それぞれの分析手法の違いや原理について解説していきます。
もくじ
分析装置で頻繁に利用されるHPLCとMS(質量分析法)
非常に多くの研究室で利用される分析装置がHPLCとMSです。有機化学や生化学を含め、利用しない研究室を探すほうが難しいほど頻用される機器です。医療や食品、環境などほぼすべての分野で活用される機器です。
HPLCはクロマトグラフィーの一種になります。複数の物質が混ざっている場合、そのままの状態では分析が困難です。単一の化合物でない場合、分析しても他の化合物の影響によってデータにいくつものノイズが含まれ、正しくデータ解析できません。
そこで複数の物質が混じっている状態から、単一の化合物へ分離するための手法がクロマトグラフィーです。HPLCは最も利用されているクロマトグラフィーの手法になります。
またクロマトグラフィーによって物質を分離した後、どのような性質をもつ化合物なのか調べなければいけません。分子量を調べるのがMSであり、ターゲット化合物の重さを調査できます。これらHPLCとMSを組み合わせることで、LC/MSとなります。
高速液体クロマトグラフィー(HPLC)は最も一般的なクロマトグラフィー
HPLCでは、なぜ物質を分離できるのでしょうか。この理由として、化合物を吸着する物質を固定相として利用することが挙げられます。
高速液体クロマトグラフィーは逆相クロマトグラフィーとも呼ばれています。逆相クロマトグラフィーでは、固定相に疎水性の高い物質を利用します。これをODSカラムといいます。ODSカラムの中は、疎水性の高い物質が詰められていると考えましょう。
水と油は混じりません。しかし、同じ性質の物質は強く引き合います。例えば脂溶性の高い化合物では、同じく疎水性の高いODSカラムに強く吸着します。一方、極性の高い化合物はODSカラムに吸着されにくく、液体(移動相)と一緒に素早く通過していきます。
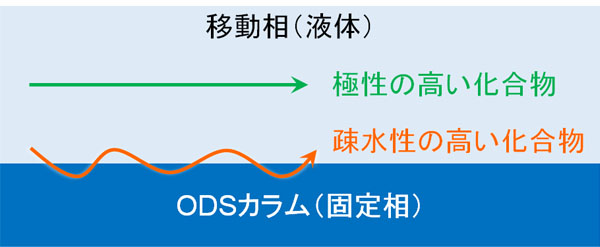
疎水性の高い化合物であるほど、ODSカラムに吸着されながら、少しずつ前に進むようになります。つまり、化合物によってODSカラム(固定相)の中を進むスピードが異なると理解しましょう。
HPLCでは有機溶媒(移動相)を流し続けます。化合物の移動速度が異なる結果、以下のように物質を分けることができます。
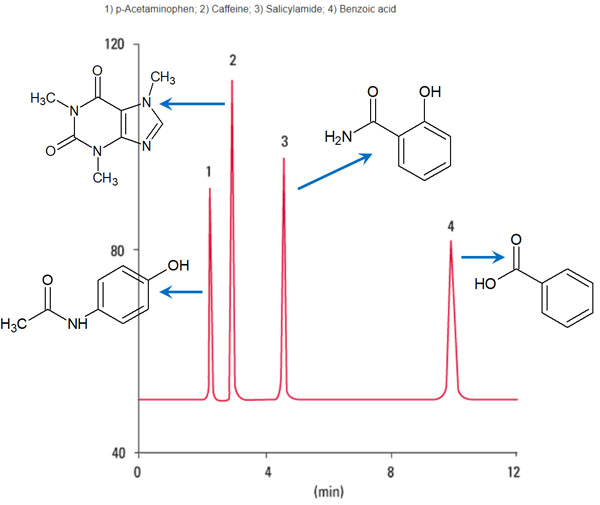
こうした特徴を有するのが高速液体クロマトグラフィーです。
質量分析法(MS)で化合物の分子量を測定する
HPLCとは、まったく別の分析方法が質量分析法です。MSでは、ターゲット化合物の分子量を測定すると考えましょう。分子をイオン化させた後、質量を分析する装置がMSです。
質量分析法ではプラスイオンを生じさせます。イオンにした物質に磁場をかけると曲がります。分子が保有する分子量が違うと、曲がる度合いは異なります。
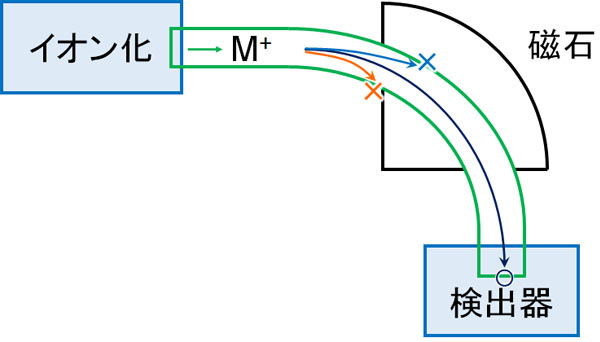
そこで磁場の強さを少しずつ変えていきます。磁場を一つずつ変えていき、検出器によって分子を計測できたらピークが表れるようになります。これをマススペクトルといいます。
例えば酢酸について質量分析法で計測すると、以下のようなマススペクトルを得られます。
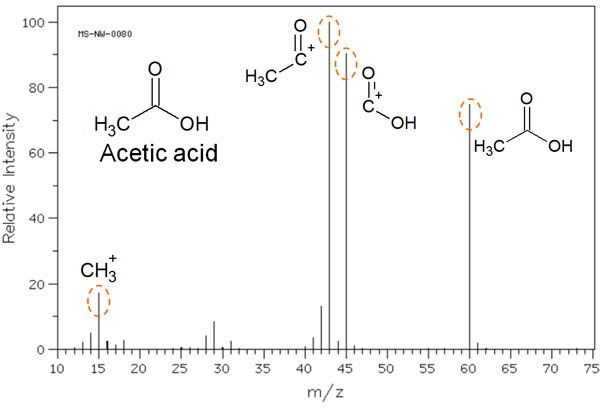
マススペクトルでは、酢酸の分子量の部分にピークが観察されます。ただMSでは高エネルギーのイオンをぶつけるため、ラジカルカチオンを生じます。
ラジカルカチオンは反応性が高く、分子の結合を開裂させることがあります。その結果、酢酸の分子量だけでなく、酢酸の構造が開裂した後の分子についてもマススペクトルで観察されます。こうした開裂した後の構造をフラグメントイオンといいます。
HPLCとMSと合わせたものがLC/MS
まったく性質の違うHPLCとMSですが、両方を組み合わせたものがLC/MS(液体クロマトグラフィー質量分析法)です。HPLCとMSを同時に行える分析機器だと理解しましょう。
MSによる解析をするとき、事前にHPLCなどのクロマトグラフィーをすることで、物質を分けなければいけません。複数の物質が混じっている状態で分子量を測定したとしても、出現したピークがターゲット化合物のピークかどうか不明です。
ただHPLCによって物質を分けた後、すべての物質について質量分析していると手間です。そこで時間短縮のため、HPLCによって化合物を分離した直後、MSによる分子量の測定までします。HPLCによる分離と分子量測定を同時に行えるため、研究者としては非常に便利です。
・LC/MSの質量分析は1分子のピークを観察する
先ほど、一般的な質量分析法を用いたマススペクトルについて記しました。質量分析法では電子イオン化法(EI)が頻繁に用いられます。高エネルギーの電子をぶつけることで、化合物をイオン化させます。これにより、フラグメントイオンを含めた複数の分子を計測します。
ただMSによる方法はいくつもあります。そうしたときLC/MSで用いられる質量分析装置については、フラグメントイオンを生じず、ターゲット化合物の分子量だけを観察すると考えましょう。
例えば酢酸であれば、分子量60のため、LC/MSで測定するときは60m/z(分子量60)にのみピークが表れます。ラジカルカチオンを生じさせることで分子結合が切れ、複数のフラグメントイオンが生じることはありません。
MSにはさまざまな方法があるものの、LC/MSで用いる質量分析法では、フラグメントイオンを生成しない方法にて分子量を測定します。
MS/MSは化合物の分子量とフラグメントイオンを測る
ただ分析機器では、LC/MS/MSも頻繁に利用されます。LC/MSは先ほど説明した通り、HPLCとMSを組み合わせたものです。それに対して、LC/MS/MSは何なのでしょうか。
LC/MS/MSの概念や特徴を理解するためには、先にMS/MSについて学ばなければいけません。
最も一般的な質量分析法では、マススペクトルに複数のピークが観察されます。ラジカルカチオンを生じることで、分子内の結合が開裂して複数のフラグメントイオンを生じるからです。ただ、どのピークが元々の化合物の分子量か分かりません。
先ほどのマススペクトルでは酢酸の事例を出しました。酢酸という既知化合物を測定しているため、既に分子量が分かっています。
ただ測定している物質が酢酸だと分かっていない状態でMSをする場合、どういう状況に陥るでしょうか。この場合、マススペクトルに表れたピークの中で、どれが元々の化合物の分子量であり、どれがフラグメントイオンのピークなのか区別できません。
そこで、MS/MSという手法を利用します。MS/MSとは、文字通り2つの質量分析装置をくっつけたものと考えましょう。
最初のMSでは、ターゲット化合物の分子量だけを測定します。単一化合物を測定する場合、ピークは一つだけ観察されます。
ただ分子量が分かっただけでは、未知化合物の構造解析をするのは無理です。そこで、高エネルギーを加えることでフラグメントイオンを作ります。分子内で開裂させることで、複数の分子を生成させるのです。
衝突室(コリジョンセル)にて、化合物を不活性ガスにぶつけます。その結果、衝突エネルギーによって分子はイオン解離します。2番目のMSでは、このとき生成するフラグメントイオンを観察します。

酸素や窒素など不対電子を有している物質では、衝突エネルギーによって結合が切れ、フラグメントイオンを生じやすいです。フラグメントイオンの分子量が分かれば、分子内の結合がどのようになっているのか推測できるようになります。
MS/MSは「元々の化合物の分子量を測定した後、2番目のMSによってどのようなフラグメントイオンを生じるのか」を観察する手法になります。
LC/MS/MSであらゆる分析を同時に行う
ここまでのことを理解すれば、LC/MS/MSがどのような機器なのかについて理解するのは簡単です。HPLCとMS/MSを組み合わせたのがLC/MS/MSです。
複数の化合物が混じっている状態では、分析機器は役に立ちません。そこで、HPLCによる液体クロマトグラフィーで化合物を分離します。
その後、HPLCの出口にある最初のMSで化合物を測定します。質量分析法により、どのような分子量をもつ化合物なのか測るのです。さらに分子の結合を開裂させ、2番目のMSによってフラグメントイオンを観察します。
これらをすべて同時に行えるのがLC/MS/MSです。化合物を分離し、分子量を測定し、フラグメントイオンの観察までを行えるのがLC/MS/MSです。
ペプチドを切り離し、タンパク質を同定可能
小分子の有機化合物についてLC/MC/MSをする場合、ここまでのことを理解すれば原理や概念については問題ないといえます。食品や環境物質の分析を含め、問題なく含まれる成分を調べることができます。
一方、特に生化学の研究ではさらに考えるべきことがあります。これらの科学実験では、タンパク質を利用することが頻繁にあるからです。
タンパク質をそのままの状態でHPLCに流したとしても測定できません。タンパク質は高分子であるため、カラムに目詰まりを起こします。
そこでタンパク質のLC/MC/MSでは、事前にタンパク質を細かく分解します。タンパク質を分解する酵素として、プロテアーゼが知られています。プロテアーゼとしては、通常だとトリプシンを利用します。トリプシンを加えることで、高分子のタンパク質を切断していくのです。
タンパク質が切断されると、ペプチドになります。いくつかのアミノ酸が連なったものがペプチドです。ペプチドであれば、HPLCのカラム内を通過できます。そこで、LC/MC/MSによってペプチドを解析します。
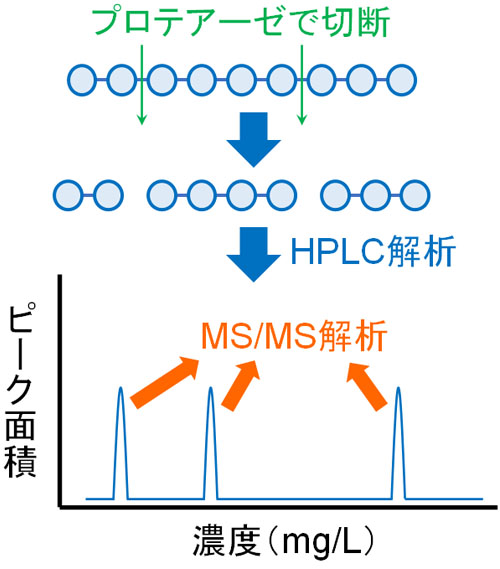
プロテアーゼ(トリプシン)によって切断したペプチドをLC/MC/MSで解析すれば、いくつものMS/MSのデータを得られます。その後、どのようなペプチドが検出されたのかMS/MSのデータを解析します。
タンパク質が違えば、プロテアーゼによって切断される場所が異なります。つまり、生成されるペプチドが違います。そこで観測されたデータと既知データ(タンパク質のデータベース)を比較することで、どのタンパク質が存在しているのか同定できるようになります。
いくつものタンパク質が混じっていたとしても問題ありません。HPLCによってそれぞれのペプチドごとに分けた後、MS/MSで解析することが含まれるタンパク質を特定できます。
ただ、溶液中に含まれるすべてのタンパク質を同定できるわけではありません。またデータベースに存在しない、マイナーな成分を調べることもできません。LC/MC/MSの利点は大きいですが、これらの欠点があることを理解しましょう。
タンパク質の構造解析を目的とした研究をプロテオミクス(プロテオーム解析)といいます。プロテオミクス(プロテオーム解析)では、LC/MC/MSの利用が欠かせません。
化学分析で重要なLC/MS/MSの技術
科学実験では、クロマトグラフィーをしたり質量分析をしたりすることがあります。ただ、それぞれの手法を一つずつ実施していると多くの時間がかかります。一回の実験によって複数のデータを得ることができれば効率的です。
そこでHPLCとMSを組み合わせたものがLC/MSです。それだけでなく、フラグメントイオンを観察できるLC/MS/MSも活用されています。LC/MSに比べると、LC/MS/MSのほうが高機能です。
多くの場合、複数の物質が混じっている状態のため、そのままでは化学分析できません。そこでHPLCによって化合物を分離し、MS/MSによって含まれている化合物の詳細を確認します。
これらの手法によって未知化合物を検出できます。プロテオミクスとして、タンパク質の同定をすることもできます。利用場面の多い分析機器がLC/MSやLC/MS/MSになります。






