弱酸や弱塩基を水に溶かす場合、一部は電離するものの、多くの化合物は電離せずに水溶液に溶けます。その結果、弱酸や弱塩基の性質を示すようになります。
このとき、電離に着目した化学平衡に電離平衡があります。電離平衡では、電離定数を利用することによって、どれだけ化合物が電離しているのか計算できます。つまり電離度を利用することによって電離平衡の値を求めることができます。
また電離度やモル濃度を利用することによって、電離定数の式を得ることもできます。覚える必要はないですが、式を導き出せるようにしましょう。これにより、電離定数を利用して電離度αを計算したり、pHを得たりできるようになります。
化学平衡は計算が複雑です。また、電離平衡に特有の計算方法もあります。そこで電離定数の使い方や計算問題の解き方を解説していきます。
もくじ
電離平衡と電離定数の関係:弱酸での平衡状態
強酸や強塩基の場合、溶液中ですべて電離することになります。一方で弱酸や弱塩基の場合、一部が電離します。
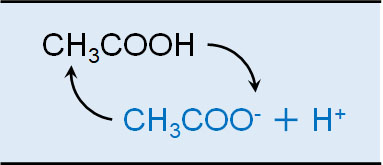
これはつまり、平衡状態になっていることを意味しています。例えば酢酸であれば、一部の酢酸がイオンになります。また、酢酸イオンは酢酸に戻ることができます。これらの反応が一定のスピードで発生することにより、溶液中に一部の酢酸イオンが存在することになります。
具体的には、酢酸が水に溶けるとき、以下の平衡状態となっています。
- CH3COOH ⇆ CH3COO– + H+
このときの平衡定数を電離定数Kaといいます。電離定数の表し方は平衡定数と同じです。そのため化学反応式の左側を分母、右側を分子にしましょう。酢酸の電離定数Kaは以下のように表すことができます。
\(K_a=\displaystyle\frac{[CH_3COO^-][H^+]}{[CH_3COOH]}\)
※Kaの「a」はacid(酸)を表し、後で説明するKbの「b」はbase(塩基)を表します。
温度が一定の場合、酢酸の濃度に関係なく電離定数Kaは一定です。電離定数については、化学平衡と内容が同じなので問題なく理解できるはずです。
弱塩基の電離定数Kb:水を無視することができる
次に弱塩基の電離定数を確認しましょう。弱塩基の電離平衡でひんぱんに利用される例にアンモニアがあります。アンモニアを水に溶かすと、以下のように電離します。
- NH3 + H2O ⇆ NH4+ + OH–
このとき、電離定数Kは以下のようになります。
- \(K=\displaystyle\frac{[NH_4^+][OH^-]}{[NH_3][H_2O]}\)
ただ水溶液には大量のH2Oが存在します。そのため反応の前後でH2Oの量はほとんど変化しておらず、平衡に関与していない値(定数)と考えることができます。そこで両辺に[H2O]をかけ、以下のように式を変形しましょう。
- \(K[H_2O]=\displaystyle\frac{[NH_4^+][OH^-]}{[NH_3]}\)
そこで、\(K[H_2O]=K_b\)とすることで新たな定数を設定します。つまり、弱塩基の電離定数Kbは以下のように表すことができます。
- \(K_b=\displaystyle\frac{[NH_4^+][OH^-]}{[NH_3]}\)
電離定数を利用するとき、H2Oは反応の前後で物質量の変化がほとんどないため、平衡に関与しておらず、無視できることを理解しましょう。化学反応式の中でH2Oを無視するのが電離定数の特徴です。
電離度αとモル濃度cを利用し、電離定数の式を得る
それでは、実際に電離定数を計算してみましょう。このとき、どれだけ電離しているのかを表すのが電離度αです。強酸や強塩基の場合、電離度は1です。一方、弱酸や弱塩基では電離度は1未満になります。
例として、酢酸の電離定数Kaを計算しましょう。電離定数を求めるとき、必要になるのが電離度αです。そこで酢酸のモル濃度をc(mol/L)とするとき、電離定数Kaを数式で表してみましょう。
弱酸が水に溶けるとき、cα(mol/L)のイオンが生成されます。例えば電離度が0.1の場合、プラスとマイナスのイオンがそれぞれ0.1c(mol/L)ずつ生成されます。
一方、電離した分だけ弱酸のモル濃度は減少します。このとき、水溶液中に存在する弱酸の濃度はc(1-α)(mol/L)です。例えば電離度が0.1の場合、\(c(1-0.1)=0.9c\)(mol/L)の弱酸が水に溶けていることになります。
つまり、酢酸を水に溶かすと以下のように濃度が変化します。
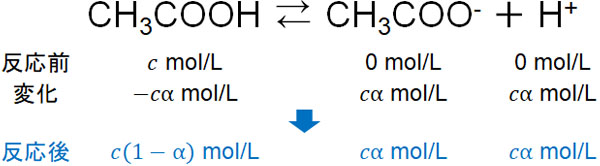
数式を見ても、意味を理解することはできません。そこで電離度を仮に0.1と設定するとき、水に溶かした後にどのようにモル濃度が変化するのか確認しましょう。その後、電離度をαに置き換えるといいです。
それでは、酢酸を水に溶かすときのモル濃度を得ることができたため、電離定数Kaを得る公式に代入しましょう。
\(K_a=\displaystyle\frac{[CH_3COO^-][H^+]}{[CH_3COOH]}\)
\(K_a=\displaystyle\frac{cα×cα}{c(1-α)}\)
\(K_a=\displaystyle\frac{cα^2}{(1-α)}\)
なお弱酸や弱塩基の電離度は非常に低いことで知られています。つまり酢酸やアンモニアを含め、弱酸や弱塩基ではほぼ電離していません。弱酸や弱塩基では、電離度は0.01(1%)などのようになります。そのため、\((1-α)≒1\)とみなすことができます。
電離定数の計算をするとき、\((1-α)\)を1へ変換できることが重要になります。そこで、以下のように式を変形しましょう。
\(K_a=\displaystyle\frac{cα^2}{(1-α)}\)
\(K_a≒cα^2\)
電離平衡の計算をするとき、\(K_a=cα^2\)を覚える必要はありません。その代わり、電離定数Kaについて先ほどの式を導き出せるようにしましょう。
電離度やH+のモル濃度を求め、pHを計算する
次に、\(K_a=cα^2\)を変形しましょう。電離定数とモル濃度がわかっている場合、この式を利用することによって電離度を求めることができます。以下のように式を変換しましょう。
\(K_a=cα^2\)
\(α^2=\displaystyle\frac{K_a}{c}\)
\(α=\sqrt{\displaystyle\frac{K_a}{c}}\)
難しい式の変換ではないため、問題なく理解できると思います。重要なのは、電離定数を利用して電離度を計算できることです。
・電離度がわかればpH(H+のモル濃度)がわかる
また電離度を得ることができれば、pHの計算が可能です。pHを得るためには[H+](H+のモル濃度)を利用して、以下の公式に代入します。
- \(pH=-log_{10}[H^+]\)
[H+]を知ることができれば、pHを計算できます。
電離度αがわかれば、酢酸の濃度から[H+]を計算できます。先に説明した通り、[H+]はcαです。酢酸のモル濃度cに電離度αをかけると、当然ながら[H+]を得ることができます。こうして[H+]を得た後、pHを計算しましょう。
電離定数から電離度とpHを得る例題
それでは、電離定数を利用することによって電離度とpHを計算してみましょう。以下の問題の答えは何でしょうか。
- 0.28mol/Lの酢酸溶液の電離度とpHを有効数字2ケタで求めましょう。なお酢酸の電離定数Kaを2.8×10-5mol/L、log102.8を0.45とします。
先ほど、\(K_a=cα^2\)と計算しました。そこで、値を代入しましょう。
\(2.8×10^{-5}=0.28α^2\)
\(α^2=1.0×10^{-4}\)
\(α=1.0×10^{-2}\) \((α>0)\)
こうして、電離度は1.0×10-2(0.010)とわかりました。
また電離度がわかれば、どれだけのH+が水溶液中に存在しているのかもわかります。電離度は0.01であるため、H+のモル濃度は2.8×10-3mol/Lです。
\(0.28×0.01=2.8×10^{-3}\)
H+のモル濃度がわかれば、pHを計算する公式に代入することによって計算しましょう。
\(pH=-log_{10}(2.8×10^{-3})\)
\(=3-0.45\)
\(=2.55(≒2.6)\)
こうして、酢酸溶液のpHは2.6になると計算することができました。
弱酸と弱塩基のpHは電離定数を利用して計算する
化合物によっては、水溶液中で電離して平衡状態になることがあります。この状態が電離平衡であり、電離定数を利用することで表すことができます。
電離定数を利用するとき、重要な考え方として「電離度は非常に低いため、イオンの生成を無視できる」ことがあげられます。電離度αとモル濃度cを用いて電離定数を得る式を作るとき、この考え方を利用することで\(K_a=cα^2\)の式を得ることができます。
また電離定数を利用すれば、電離度αやpHの計算が可能になります。\(K_a=cα^2\)を利用したり、pHを得る公式を利用したりして計算しましょう。なお、計算方法はKbも同様です。
電離平衡では、「弱酸や弱塩基ではイオンになる数が非常に少ない」という事実を利用して計算することがよくあります。そこで、どのように電離定数や電離度、pHを計算すればいいのか理解しましょう。