化学を学ぶとき、基本的な学習内容の一つに同位体(アイソトープ)があります。同じ元素ではあるものの、質量が異なるのが同位体です。つまり性質は同じであるもの、同位体では異なる原子となるのです。
同位体には種類があり、同位体が存在する元素は既に決まっています。また、自然界での存在割合も決まっています。同位体の存在割合が高い元素があれば、ほとんど同位体が存在しない元素もあります。
なお、同位体を学ぶときに多くの人が混乱するのは同素体との違いです。同位体と同素体は何が違うのでしょうか。
基本的な内容ではあるものの、同位体を理解することは重要です。そこで、同位体の性質や質量数が異なる理由を解説していきます。
もくじ
同じ元素だが質量数(中性子の数)が異なる同位体
同位体で重要なのが質量数です。すべての原子は原子核をもち、原子核は陽子と中性子で構成されています。このとき、質量数(原子の重さ)は陽子と中性子の数で決まります。
- 原子の質量数=陽子の数+中性子の数
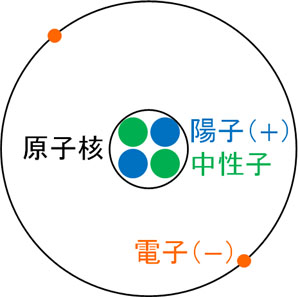
陽子や中性子に比べて、電子は非常に軽いです。そこで電子の重さを無視して、陽子と中性子の数のみで原子の質量数を決めましょう。
このとき、同位体でひんぱんに利用される例が水素(H)です。通常、水素は1つの陽子のみをもちます。ただ場合によっては、水素が1つの陽子と1つの中性子をもつ場合があります。質量数が2の水素原子を重水素といいます。
また水素原子が陽子を1つ、中性子を2つもつケースも存在します。質量数が3の水素原子をトリチウムといいます。通常の水素や重水素、トリチウムは以下のように表記されます。

陽子の数や電子の数は原子の性質を表します。そのため、原子番号は同じです。ただ保有する中性子の数が変わります。その結果、質量数が異なるのです。
これが同位体です。同じ水素原子ではあるものの、質量数が異なることによって異なる性質をもつようになるのです。
元素と原子の違いは重要
そこで、元素と原子の違いを把握しましょう。元素というのは、原子番号が同じかどうかで判断します。水素(H)の場合は原子番号が1であり、保有する陽子と電子の数はそれぞれ1つです。存在する陽子の数が1の場合、その原子は必ず水素原子です。
一方、水素原子ではあるものの、性質が同じとは限りません。つまり元素が同じ(原子番号が同じ)ではあっても、原子は異なるケースがあるのです。
水素原子の場合、前述の通り3種類の同位体があります。一般的な水素原子と重水素、トリチウムを比べると性質は大きく異なります。そこで、これらを見極めなければいけません。
- 元素:陽子の数(電子の数)での分類。言い換えると、原子番号での分類。
- 原子:陽子・中性子・電子で構成される物質。中性子の数が違う場合、異なる原子。
元素と原子は意味が異なるため、この違いを認識しましょう。
同位体の種類と原子量、存在比
先ほど、同位体の例として水素(H)を利用しました。ただ同位体には他にも種類があります。また、同位体は自然界での存在比率が既に決まっています。
主な同位体の種類と存在比は以下のようになっています。
| 元素 | 同位体 | 存在比 |
| 水素 | 1H | 99.985% |
| 2H | 0.015% | |
| 3H | 微量 | |
| 炭素 | 12C | 98.892% |
| 13C | 1.108% | |
| 酸素 | 16O | 99.759% |
| 17O | 0.037% | |
| 18O | 0.204% | |
| 塩素 | 35Cl | 75.53% |
| 37Cl | 24.47% |
同位体の存在比率を覚える必要はありません。ただ、このように同位体の種類があることを理解しましょう。
・存在比を考慮して原子量を決定する
化学の教科書を開くと、必ず元素周期表が掲載されています。元素周期表には原子量(元素の重さ)が記されています。例えば、塩素(Cl)の原子量は35.5です。
なぜ、原子量で小数点を利用するのでしょうか。陽子と中性子の数で質量数が決まるのであれば、小数点を利用する必要はないように思ってしまいます。
原子量で小数点を利用する理由の一つに同位体が挙げられます。元素は同じであっても、原子によって質量数が異なります。そのため、自然界に存在する原子の重さを平均すると、原子量では小数点を利用しなければいけないのです。
例えば塩素(Cl)の場合、先に記した通り質量数と自然界での存在比率は以下になります。
- 35Cl:存在比75.53%
- 37Cl:存在比24.47%
そこで元素の平均的な重さ(原子量)を以下のように計算しましょう。
- \(35×0.7553+37×0.2447≒35.5\)
こうして、塩素(Cl)の原子量35.5と同じ値を得ることができました。同位体というのは、原子量に大きな影響を与える要素なのです。
なぜ同位体の区別が重要なのか
それでは、なぜ同位体の区別をしなければいけないのでしょうか。この理由として、同位体は多くの研究で利用されているからです。
例えば医療の分野であれば、同位体はひんぱんに利用されます。有名な例の一つとして、ピロリ菌の検査があります。
ピロリ菌の存在は胃がんの原因になることで広く知られています。ピロリ菌が胃の中に存在するかどうかの確認をするとき、診断薬が開発される前は胃カメラを飲む必要があるなど、体への負担が大きかったです。そこで、ドリンク形式のピロリ菌診断薬が開発されました。
具体的には、13Cを含む化合物(13C-尿素)を服用します。もしピロリ菌が存在すれば、ピロリ菌が13C-尿素を分解し、13Cを含む二酸化炭素を排出します。
通常、自然界に存在する二酸化炭素は12Cを含みます。そのため、診断薬を服用した後に13Cを含む二酸化炭素の量が明らかに多くなっている場合、胃の中にピロリ菌が存在すると判断できます。
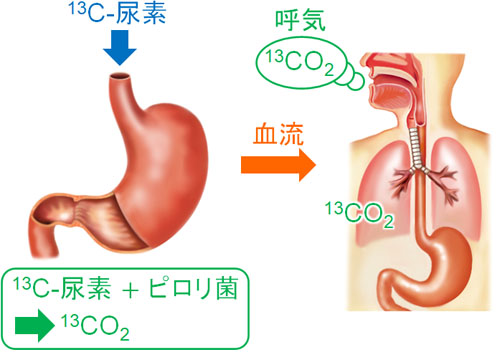
このように同位体を利用し、12Cと13Cの量を比べることによって、液体の診断薬を飲むだけで検査できるように開発されました。一つの例ですが、同位体は多くの分野で応用されているのです。
同位体と同素体は何が違うのか
なお、同位体を学ぶとき「同素体と何が違うのか?」と混乱する人がいます。同位体と同素体はまったく異なる概念なので、両者を区別しましょう。
同位体の場合、元素は同じであるものの、質量数が異なります。また原子の質量数が異なるため、検査機器によって明確に区別できます。そのため、多くの分野で応用されています。
一方、同素体の場合は同じ原子ではあるものの、性質が異なるケースを指します。つまり原子番号や質量数は同一であるため、完全に同じ原子です。ただ同じ原子であるにも関わらず、化学的性質が大きく異なるケースがあるのです。これが同素体です。以下は有名な同素体の一覧です。
| 硫黄S | 斜方硫黄S8、単斜硫黄S8、ゴム状硫黄S |
| 炭素C | 黒鉛C 、ダイヤモンドC、フラーレンC60 |
| 酸素O | 酸素O2、オゾンO3 |
| リンP | 黄リンP4、赤リンP |
同素体の覚え方は元素記号の頭文字を集めたSCOP(スコップ)です。同素体について、例えば黒鉛とダイヤモンドは同じ炭素原子(C)で構成されています。

同じ炭素原子ではあっても、黒鉛では炭素は層状になっており、はがれやすく黒色です。一方、ダイヤモンドでは、炭素原子は正四面体構造によって結合しており、非常に硬く光の屈折率が高いです。完全同一の原子ではあるものの、同素体ではこのように性質が異なるのです。
- 同位体:同じ元素であるものの、質量数が異なる。同位体は違う原子。
- 同素体:同じ原子であるものの、化学的性質が異なる。
同位体と同素体にはこのような違いがあります。
同位体の性質を理解する
化学で最も基本的な内容の一つが同位体(アイソトープ)です。同じ元素ではあるものの、質量数が異なるため、違う性質をもつのです。
自然界に存在する同位体は存在比率が決まっています。そのため、元素周期表に記載されている原子量は整数ではありません。存在比を考慮したうえで、元素ごとに原子量が決定されます。
なお、同位体は多くの場面で利用されています。なぜ同位体の区別が重要かというと、研究で同位体がひんぱんに用いられているからなのです。このとき同位体と同素体は概念がまったく違うため、両者を区別しましょう。
同位体を学ぶことによって、原子の性質がわかります。そこで同位体の存在や性質、存在比を理解するようにしましょう。






