高校化学など、有機化学の基礎で重要な内容がエステル結合です。私たちの日常生活でも、多くの場面でエステル結合を有する化合物が利用されます。
カルボン酸とアルコールを利用することによって合成できる化合物がエステルです。酸性を示さず、水に溶けにくく、独自の特徴をもつのがエステルです。そのため、エステル結合の性質を覚えるようにしましょう。
また、エステル化と同時に学ぶべき合成反応がアセチル化です。酢酸(または無水酢酸)を用いるエステル化をアセチル化といいます。つまりアセチル化というのは、エステル化でもあるのです。
それでは、エステル結合の性質や応用例には何があるのでしょうか。また、エステル化とアセチル化にはどのような違いがあるのでしょうか。エステル結合の基本的な内容を解説していきます。
もくじ
カルボン酸とアルコールによる縮合でエステル化が可能
カルボン酸と似た構造を有するのがエステル結合です。カルボン酸とエステル結合を比べると以下のようになります。

※Rはアルキル鎖を表します。
エステルの合成ではカルボン酸とアルコールを利用します。触媒として濃硫酸を利用し、加熱します。そうすると、濃硫酸による脱水作用によってH2Oがなくなり、縮合反応によってエステルを得ることができます。
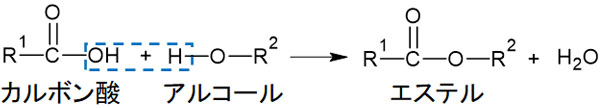
分子の脱離(エステル結合の合成の場合はH2Oの脱離)を伴いながら、複数の分子が反応して新たな化合物が生成される場合、縮合反応といいます。また、先ほどの縮合反応をエステル化といいます。
エステルの名称ではカルボン酸と官能基を確認する
なおエステル化合物に名称をつけるとき、カルボン酸とエステルに結合している官能基を確認しましょう。例えば酢酸とメタノールを反応させる場合、酢酸メチルを得られます。
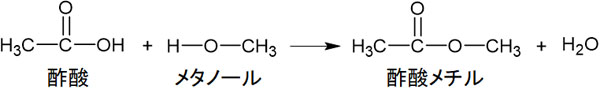
酢酸(カルボン酸)を反応させるため、エステル化合物の名前では「酢酸」を利用します。またエステル結合によって結合しているのはメチル基です。そのため、エステルの名前は酢酸メチルになります。
他にはギ酸とメタノールを反応させる場合、得られる化合物はギ酸メチルです。また酢酸とエタノールを反応させる場合、得られる化合物は酢酸エチルです。
エステルの加水分解:酸性条件での加水分解
エステルの特徴として、加水分解することがあげられます。つまりH2Oと少量の酸を加えることによって、エステル結合が切れてカルボン酸とアルコールへと変化します。
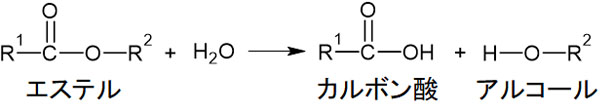
H2Oがない環境で濃硫酸と反応させると、前述の通り濃硫酸による脱水作用でエステルを得られます。一方、H2Oが存在する酸性条件では加水分解が進行し、エステルがカルボン酸とアルコールへ変化するのです。
酸性条件で反応させるとき、加える試薬や溶液中に存在するH2Oの量に応じて起こる反応が異なります。
塩基性条件ではけん化による不可逆反応が起こる
酸性条件では、前述の通りエステル化と加水分解の両方が起こる可能性があります。一方、塩基性条件下で反応させる加水分解をけん化といいます。例えばエステルに水酸化ナトリウムを加えると、カルボン酸の塩とアルコールを生じます。

けん化が加水分解である理由として、水酸化ナトリウムを水溶液で加えるからです。水酸化ナトリウム水溶液には多くのH2Oが存在しており、エステルとH2Oが反応することでカルボン酸とアルコールに分解されます。
またカルボン酸は酸性であり、水酸化ナトリウムは塩基性であるため、カルボン酸の塩を作ります。そこで2つの反応(水による加水分解と水酸化ナトリウムによる中和反応)を組み合わせると以下になります。
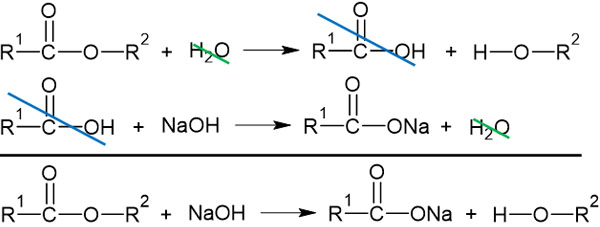
水酸化ナトリウムは強塩基であるため、水溶液中ではほぼ100%がR-COO–とNa+で存在しています。そのためR-COO–はアルコールと反応してエステルになることができません。つまり酸性条件とは異なり、塩基性条件での反応(けん化)は不可逆反応です。
酸性を示さず、水に溶けにくい化合物がエステル
このようにカルボン酸とエステルは親せきの関係です。ただ、カルボン酸とエステルは性質が大きく異なります。カルボン酸は酸性を示すものの、エステル化合物は中性です。
また、エステルは水に溶けにくいです。酸素原子を含む官能基では、水に溶けやすいのが一般的です。アルコールやエーテル、アルデヒド、ケトン、カルボン酸は親水性です。しかし、これらの官能基とは異なり、エステルは親水性ではありません。
エステルは酸素原子を2つもちます。ただエステルは疎水基(炭素鎖)も2つもつことになります。そのため、水に溶けないのです。またエステルの場合、アルコールやカルボン酸のように官能基にHは存在せず、水素結合を作ることで水に馴染む作用はありません。つまり、酸素を有するほかの官能基に比べてエステルは疎水性が高いのです。
なおアルコールは水素結合が可能であるものの、炭素鎖が長い場合は水に溶けません。つまり酸素原子があったり水素結合が可能だったりしても、炭素鎖が長いなど、疎水基が多いと水に溶けないのです。
酢酸や無水酢酸を利用する場合、アセチル化が可能になる
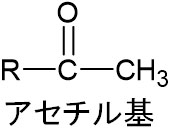
なおエステルを学ぶとき、同時にアセチル化も覚えましょう。官能基の一つにアセチル基があります。以下がアセチル基です。
有名な医薬品(鎮痛剤)としてアセチルサリチル酸が知られています。以下のようにアセチル基を有しているため、アセチルサリチル酸と呼ばれます。
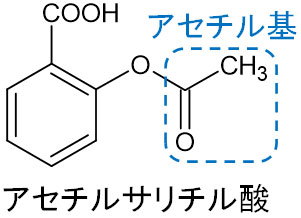
アセチルサリチル酸に存在するアセチル基に着目すると、エステル結合を有するとわかります。つまり、アセチルサリチル酸にあるエステル結合はアセチル基でもあります。より具体的にいうと、酢酸を用いて縮合反応させると必ずアセチル基を作ることができます。
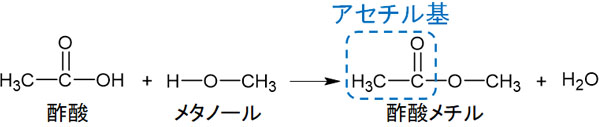
エステル化をするとき、カルボン酸の種類は何を利用してもいいです。一方でアセチル基を作るためには酢酸を利用することになります。いずれにしても、酢酸を用いたエステル化というのは、アセチル化とも呼ばれています。
・無水酢酸を用いてアセチル化する
なおアセチル化(エステル化)をするとき、無水酢酸を利用するケースが多いです。2つの酢酸について、縮合反応によってH2Oを除去した化合物が無水酢酸です。

無水酢酸は反応性が高く、素早くアセチル化が進行します。また反応後、H2Oは生成されません。例えば無水酢酸とメタノールを反応させる場合、酢酸メチルと酢酸を得られます。
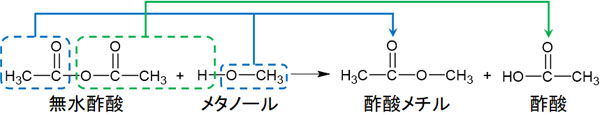
無水酢酸は左右対称であり、アルコールと反応させることで、アルコールにアセチル基を加えた化合物を得ることができます。
なお酢酸を利用してエステル化を進める場合、H2Oが生成されるため、エステル化だけでなく加水分解も進行します。一方で無水酢酸を利用する場合、反応後にH2Oが生成されないため、効率的に合成反応を進めることができます。
酢酸を用いるエステル化やアミド化はアセチル化
アセチル化を学ぶと、エステル化と何が違うのか混乱する人が多いです。酢酸を用いるエステル化はアセチル化でもあります。そのため「エステル化の中でも、酢酸(または無水酢酸)を用いる場合はアセチル化とも呼ぶ」と理解しましょう。
なお、-COCH3の構造がアセチル基です。そのため酢酸を用いる合成反応では、エステル化だけでなく、アミド化もアセチル化です。-CONHの構造をアミド結合といいます。例えばアルコールの代わりとして、酢酸とアミン(窒素を含む化合物)を反応させるとアミド結合を作れます。
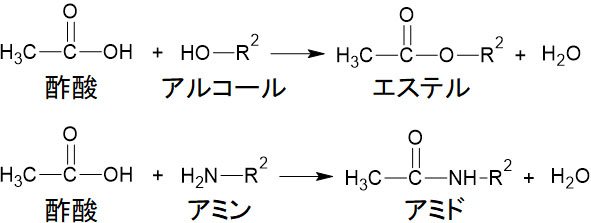
共通しているのは、両方ともアセチル基を有することです。そのため酢酸(または無水酢酸)を利用してエステル化をする場合も、アミド化をする場合も、両方ともアセチル化です。
エステル化とアセチル化の違いを学ぶ
エステル結合を有している化合物は多く、どのようにエステル化すればいいのか学びましょう。カルボン酸とアルコールによるエステルの合成だけでなく、エステルの加水分解も重要になります。
エステルを加水分解する場合、酸性条件では可逆反応です。一方で塩基性条件では、反応はけん化と呼ばれ、不可逆反応になります。けん化により、エステルがカルボン酸とアルコールに分かれる反応も加水分解なのです。
なおエステル化の中でも、酢酸を用いる場合はアセチル化と呼ばれます。アセチル化では、無水酢酸を利用して反応させるケースも多いです。
カルボン酸とエステルは性質が大きく異なります。そこでエステルの性質や加水分解、けん化、アセチル化の詳細を理解しましょう。