可逆反応では、条件が変わることによって平衡状態が変化します。これをルシャトリエの原理といいます。
化学平衡を習うとき、すべての人が最初に濃度の変化を学びます。それでは、圧力や温度が変化する場合はどのように考えればいいのでしょうか。また、希ガスを加える場合の平衡状態はどのように変化するのでしょうか。
環境が異なると平衡状態が変化します。化学反応を効率的に進めるためには、ルシャトリエの原理を理解しなければいけません。
ルシャトリエの原理を学べば、どのような条件で反応が進行しやすくなるのかわかります。そこで濃度や圧力、温度が変化したり、希ガスを加えたりするときについて、平衡状態の変化を解説していきます。
もくじ
平衡状態が変化するルシャトリエの原理
条件を変えることによって、平衡状態が変化する法則をルシャトリエの原理といいます。濃度や圧力、温度を変化させるとき、これらの影響を打ち消すように可逆反応が進行する法則がルシャトリエの原理です。
例えば濃度を上げると、化合物の濃度が減るように可逆反応が進行します。圧力を減らすと、圧力を上げるように可逆反応が進行します。温度を上げると、温度が低下するように可逆反応が進行します。
不可逆反応の場合、逆反応は起こりません。一方で可逆反応の場合、逆反応が起こります。ルシャトリエの原理で起こる反応というのは、正反応または逆反応により、変化による影響を弱めるように働くのです。
濃度変化により、平衡状態が変わる
ルシャトリエの原理で最もわかりやすいのは濃度変化です。化学平衡を学んでいるのであれば、可逆反応だと濃度変化が起こることを既に理解していると思います。
例として、水素H2とヨウ素I2が反応し、ヨウ化水素HIが生じる反応を考えましょう。
- H2 + I2 ⇆ 2HI
水素H2を増やすとどうなるでしょうか。温度が一定の場合、平衡定数は同じです。このとき、平衡定数Kは以下の計算式によって得ることができます。
- \(\displaystyle\frac{[HI]^2}{[H_2][I_2]}=K\)
水素H2を増やすというのは、分母が増えることを意味します。前述の通り平衡定数Kは同じ値であるため、分母の値が増えたのであれば、分子の値も増えなければいけません。つまり、HIのモル濃度が増加します。その結果、化学反応式は以下のようになります。
- H2 + I2 → 2HI
一方、水素H2を減らす場合はどうでしょうか。この場合、分母の値が減るので分子の値も減ります。つまり、逆反応が進むことでHIはH2とI2へ変化します。
- H2 + I2 ← 2HI
H2の濃度を増やすと、H2の濃度を減らすように可逆反応が進行します。またH2の濃度を減らすと、H2の濃度を増やすように可逆反応が進行します。ルシャトリエの原理では、このように変化を抑えるように反応が進行するのです。
条件を変えることによる平衡状態の変化
ルシャトリエの原理を理解するとき、濃度の変化は最も理解しやすいです。次に、ほかの条件について確認しましょう。濃度以外では、ルシャトリエの原理では以下が重要になります。
- 圧力の変化
- 温度の変化
- 希ガス(アルゴン)を加えるときの変化:体積が増える場合と体積が同じ場合
- 触媒を加えるときの変化
それぞれを解説していきます。
圧力の変化と逆の方向に反応が進む
前述の通り、ルシャトリエの原理では変化をやわらげるように反応が進みます。圧力が増加すれば、圧力を少なくするように反応が進みます。圧力を下げれば、圧力が増加するように反応が進みます。
例として、二酸化窒素(NO2)と四酸化窒素(N2O4)の化学反応を確認しましょう。化学反応式は以下のようになります。
- 2NO2 ⇆ N2O4
NO2は赤褐色の気体であり、N2O4は無色の気体です。平衡状態の気体について、ピストンを押して圧力を高めると、濃度が濃くなるので、NO2由来の赤褐色の色が濃くなります。ただ時間が経過すると、赤褐色が薄くなります。この理由として、NO2がN2O4に変化するからです。
NO2がN2O4に変化すると、その分だけ物質量が少なくなります。例えば1molのN2O4に変化するためには、2molのNO2を消費する必要があります。そのため、以下の反応が進んだのです。
- 2NO2 → N2O4
一方、ピストンを引いて圧力を低くすると、先ほどとは逆の反応が起こります。圧力が低くなると、圧力を高める方法に反応が進みます。全体の物質量を増やし、圧力を高めるためには、N2O4がNO2に変化すればいいです。そのため、以下の反応が起こります。
- 2NO2 ← N2O4
ルシャトリエの原理では、「変化をやわらげる方向に反応が進む」と理解するのが最も重要です。これを理解すれば、圧力を上げる(または下げる)ときに反応の進む向きがわかります。
物質量が同じ場合や固体が反応に関与するケースでの圧力変化
なお、反応の前後で物質量が変化しないケースがあります。例えば、以下の反応が該当します。
- H2 + I2 ⇆ 2HI
例えば1molのH2と1molのI2が反応すると、生成するHIは2molです。左辺は合計で2molであり、右辺も合計で2molです。左辺へ右辺で合計の係数が同じ場合、圧力を変化させても平衡状態は変化しません。
・固体は圧力に関与しない
ただ注意点として、固体は圧力に関与しません。そのため化学反応式に固体がある場合、固体を省いて気体の圧力変化を考える必要があります。例えば炭素(C)と二酸化炭素(CO2)が反応し、一酸化炭素(CO)が生成する場面を考えてみましょう。
- C + CO2 ⇆ 2CO
反応の前後で合計の物質量は変化していません。ただ炭素(C)は固体であり、圧力に関与していません。そのため気体だけに着目し、固体(炭素)を省くと、左側の係数は1であり、右側の係数は2です。
そのためこの反応では圧力を上げると平衡は左側に傾き、一酸化炭素から二酸化炭素が作られます。
温度の変化では発熱反応と吸熱反応を見分ける
次に、温度の変化でどのように反応の向きが変わるのか学びましょう。温度の変化については、発熱反応なのか、それとも吸熱反応なのかを確認しましょう。
温度を上げる場合、ルシャトリエの原理では吸熱反応が進行します。吸熱反応によって熱を下げることにより、温度の上昇を抑えようとするのです。一方で温度を下げる場合、発熱反応が進行します。熱を放出することによって、温度を上げようとするのです。
以下の例で確認しましょう。
- N2 + 3H2 = 2NH3 + 92kJ
正反応だと、この反応は発熱反応です。それでは、温度を上げるとどちらに反応が進むでしょうか。アンモニア(NH3)が生成されると、熱が放出されてより温度が上昇します。そのため、逆向きの反応が起こります。つまり平衡は左側に傾き、逆反応(吸熱反応)が起こります。
一方、温度を下げる場合は発熱するように平衡が傾きます。温度下落によって平衡は右側に傾き、正反応(発熱反応)が進行します。
平衡がどちらに傾くのかを判断するとき、発熱反応なのか、それとも吸熱反応なのかを見極めましょう。
希ガス(アルゴン)を加えるときの変化:体積が増える場合と同じ場合
体積の変化についてもルシャトリエの原理で重要です。具体的には、希ガスを加えるときの変化を考えましょう。
先ほど、「圧力が増えると、圧力が減るように可逆反応が進行する」と解説しました。ただ、この説明は実は間違いです。正確には、反応に関わる物質の分圧が増えると、全体の分圧が減るように反応が進行します。先ほどと同様に、以下の化学反応を考えましょう。
- 2NO2 ⇆ N2O4
ピストンを押す場合、NO2とN2O4の分圧は上昇します。そのため、合計の分圧が減るように可逆反応が進行します。ルシャトリエの原理で分圧が重要であることを理解していないと、希ガスを加えるときの反応を理解できません。
・体積と温度が一定の場合
温度が一定であり、体積が変化しない容器に気体を入れる場面を考えましょう。この場合、容器にアルゴン(Ar)を入れたとしてもNO2とN2O4の分圧は同じです。アルゴンが入るので全体の圧力(全圧)は上がるものの、反応に関係するNO2とN2O4の分圧は変わらないことに着目しましょう。
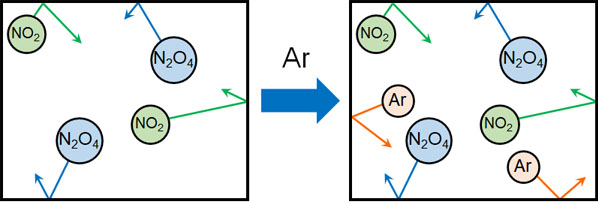
前述の通り、ルシャトリエの原理では分圧が重要になります。反応に関わるNO2とN2O4の分圧は変化していないため、体積変化がない場合、平衡状態も変化がありません。
・体積が変化する場合(温度と圧力が一定)
一方、体積が変化する容器に入れる場合はどうでしょうか。体積が変化するというのは、言い換えると、温度と圧力(全圧)が一定の場面を考えます。
希ガスとしてアルゴンを入れる場合、一時的に全体の圧力が上昇します。ただ容器は体積を変えることができるため、容器の体積が上昇し、内圧(容器内の全圧)は外圧(大気圧)と同じになります。アルゴンを入れる前と後で全圧の変化がないのです。
この場合について、反応に関わるNO2とN2O4の分圧を確認しましょう。
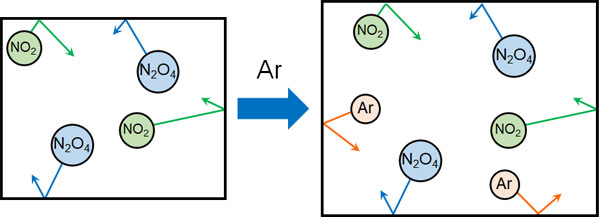
容器の中に存在するNO2とN2O4の物質量は同じです。それにも関わらず体積が増えているため、NO2とN2O4の分圧は低下します。
分圧が下がるため、ルシャトリエの原理ではNO2とN2O4の分圧の合計を上げるように可逆反応が進行します。つまり、N2O4がNO2へと変化することで容器内の物質量が増える方向に反応が進行します。
希ガスを加える場合、反応に関わる物質の分圧に着目しましょう。分圧が下がる場合、分圧を上げる(物質量が増える)ように化学反応が進行します。
触媒はルシャトリエの原理に関与しない
なお触媒は平衡状態に関与しません。これは、触媒を加えてもルシャトリエの原理に影響を与えないことを意味しています。
触媒は活性化エネルギーを下げる働きがあります。触媒があるため、反応がスムーズに進行するのです。
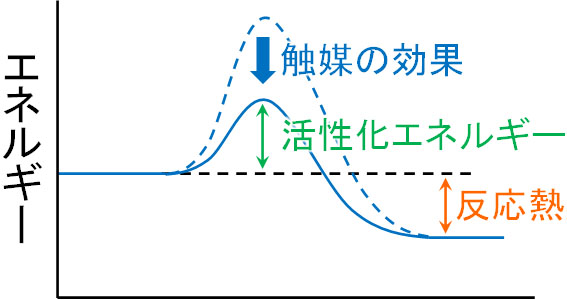
ただ触媒によって可逆反応がスムーズに進行するというのは、正反応と逆反応の両方とも反応速度が速くなることを意味しています。正反応だけ、または逆反応だけ反応速度が速くなることはありません。
触媒を加えるとき、反応速度が上昇する割合は一定です。これが、触媒を加えても平衡状態に関与しない理由です。
濃度、圧力、温度、体積の変化で平衡状態が変わる
平衡状態は環境によって変化します。濃度や圧力、温度、体積が変わると、平衡状態が変化することで化学反応が進行するのです。
ルシャトリエの原理は考え方が共通しています。変化があったとき、変化を和らげるように可逆反応が進みます。この共通点を理解していれば、濃度や圧力、温度が変化したとき、反応の方向がわかります。
なお希ガス(アルゴン)を容器に入れるとき、平衡状態が変化するかどうかは、体積の変化があるかどうかで判断しましょう。体積が変化しない場合、平衡状態も変化しません。一方、体積が増える場合は分圧が低くなるため、反応に関わる物質の合計分圧が高くなるように変化します。
反応が進行する条件には複数の要素が関わっています。そこでルシャトリエの原理を理解し、どのような条件であれば平衡状態が変化するのか判断できるようになりましょう。