物質を完全に分離させる方法がクロマトグラフィーです。クロマトグラフィーにはいくつか種類があり、その中でも有機化合物を取り扱う研究室で頻繁に活用されるクロマトグラフィーがカラムクロマトグラフィーです。
吸着クロマトグラフィーの一種がカラムクロマトグラフィーです。シリカゲルという吸着剤を利用し、いくつも混じっている有機化合物を分離させるのです。
有機合成や化合物の構造決定が必要な研究室など、有機化合物を取り扱う研究室では毎日のように行う実験操作がカラムクロマトグラフィーです。
それでは、カラムクロマトグラフィーで有機化合物を分離する原理はどのようになっているのでしょうか。また、カラムクロマトグラフィーのやり方・操作手順はどのようになっているのでしょうか。これらを分かりやすく解説していきます。
もくじ
有機化合物を完全に分離する順相クロマトグラフィー
物質を吸着させる性質を利用して、化学物質を分離させる手法が吸着クロマトグラフィーです。吸着クロマトグラフィーにはいくつか種類があり、その一つがカラムクロマトグラフィーです。カラムクロマトグラフィーは順相クロマトグラフィーとも呼ばれています。
厳密には違いますが、一般的に吸着クロマトグラフィーと順相クロマトグラフィーは同じものだと考えていいです。以下のような装置がカラムクロマトグラフィーです。
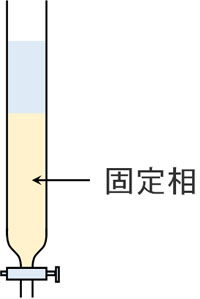
カラムクロマトグラフィーでは固定相として、カラム(小さい筒)に物質を敷き詰めます。このとき敷き詰める固定相に吸着されながら、徐々に化合物は前に進んでいくようになります。
固定相(シリカゲル)を移動する速度は物質によって異なる
このとき、カラムクロマトグラフィーの固定相にはシリカゲルを用います。カラムクロマトグラフィーではアルミナを利用することもありますが、アルミナではなくシリカゲルが主流です。アルミナの利用を考える必要はありません。
シリカゲルは固体であり、カラムクロマトグラフィーでは固定相として利用します。シリカゲルは以下のような構造式です。
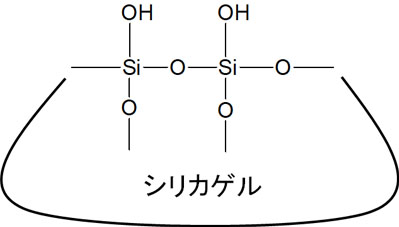
この構造式から分かる通り、シリカゲルは極性が非常に高いです。ケイ素の周辺には、電気陰性度の高い酸素原子が多く存在します。
こうした性質を有するのがシリカゲルです。そのため、シリカゲルが敷き詰められているカラムを化合物が通過するとき、移動速度に違いが生まれます。こうした移動速度の違いに着目して、化合物を分離するのです。
HPLC(高速液体クロマトグラフィー)は逆相クロマトグラフィー
なお、同じく有名なクロマトグラフィーの中でも、HPLC(高速液体クロマトグラフィー)とカラムクロマトグラフィーは異なります。
カラムクロマトグラフィーはシリカゲルやアルミナなど、極性の高い物質を固定相に利用します。このように、極性の高い物質を固定相に利用するカラムクロマトグラフィーが順相クロマトグラフィーです。
一方、固定相に極性の低い物質(疎水性の高い物質)を用いるのが逆相クロマトグラフィーです。固定相(カラム)に敷き詰める物質の性質が異なるのです。
- 順相クロマトグラフィー:極性の高い物質を固定相に使う
- 逆相クロマトグラフィー:疎水性の高い物質を固定相に使う
HPLC(高速液体クロマトグラフィー)では、逆相クロマトグラフィーがメインです。カラムクロマトグラフィーとは、性質が異なると考えましょう。
極性の高い化合物は吸着剤である固定相と相互作用する
それではカラムクロマトグラフィーを利用するとき、なぜ化合物によってシリカゲルの中を移動する速度が異なるのでしょうか。これは、シリカゲルと相互作用するからです。つまり、化合物がシリカゲルに吸着されます。
水と油は混じりません。水は極性が高く、油は脂溶性が高いからです。このとき、同じく極性が高い物質では水に溶けます。一方で脂溶性が高く、水に溶けない化合物であっても、油には溶けます。同じ性質の物質は親和性が高いです。
このように考えると、極性の高い物質では、同じく極性の高いシリカゲルと相互作用しやすいです。つまり、シリカゲルに吸着します。溶媒を流すにしても、化合物はシリカゲルに吸着されながら、移動相の有機溶媒に溶出しつつ、徐々に前に進んでいきます。
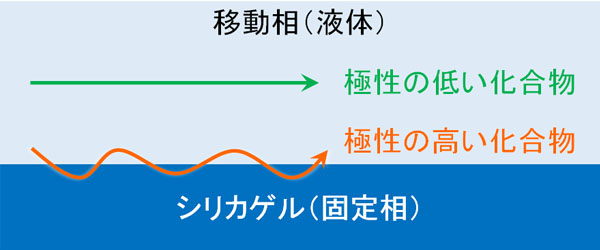
それに対して、極性の低い化合物(疎水性の高い化合物)はどうでしょうか。極性の高いシリカゲルと相互作用せず、シリカゲルに吸着されることはありません。その結果、溶媒を流したときに素早く前に進みます。
シリカゲルが敷き詰められた筒に有機溶媒を流すと、有機化合物の進行スピードに違いが生まれるのは、こうした理由があります。
移動相の有機溶媒の極性によって移動速度(溶出度合い)が違う
また、カラムクロマトグラフィーでは移動相を決めなければいけません。固定相はシリカゲルの一択です。ただ、どの種類の溶媒を流すのかはあなたが決めなければいけません。
カラムクロマトグラフィーで利用する有機溶媒として、最も一般的なのが酢酸エチルとヘキサンです。
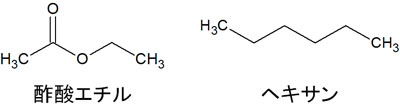
構造式を見れば分かる通り、酢酸エチルは極性が高いです。一方、ヘキサンは極性が低いです。カラムクロマトグラフィーでは、酢酸エチルとヘキサンを混ぜて利用するのが一般的です。このとき利用するカラムクロマトグラフィーの移動相(有機溶媒)を展開溶媒といいます。
酢酸エチルの極性が高いことから、展開溶媒で酢酸エチルの割合を大きくすると、物質は素早くシリカゲルの中を通過するようになります。シリカゲルに化合物が吸着されるとはいっても、極性の高い酢酸エチルへも溶出しやすくなり、カラムクロマトグラフィーの中を素早く進むのです。
一方、ヘキサンの割合を高くすればどうでしょうか。ヘキサンは疎水性が高いため、化合物はヘキサン割合の高い有機溶媒に溶け出すことが難しいです。その結果、ヘキサンの割合を高くするほど、物質はカラムの中をゆっくり進むようになります。
展開溶媒を作成するとき、酢酸エチルとヘキサンの性質や特徴を理解したうえで、その割合を決定する必要があります。
薄層クロマトグラフィーのRf値から移動相(展開溶媒)を決定
それでは、どのようにして展開溶媒を決めればいいのでしょうか。カラムクロマトグラフィーを行う前、必ずやるべき実験があります。それが薄層クロマトグラフィー(TLC)です。薄層クロマトグラフィーを行わずに、カラムクロマトグラフィーをやることは化学実験では100%ありません。
薄いガラス板にシリカゲルを乗せたものがTLCです。薄層クロマトグラフィーを行うとき、測定したい溶液をスポットします。その後に展開溶媒を作成し、TLCを展開溶媒に浸すことで、化合物が分かれるようになります。
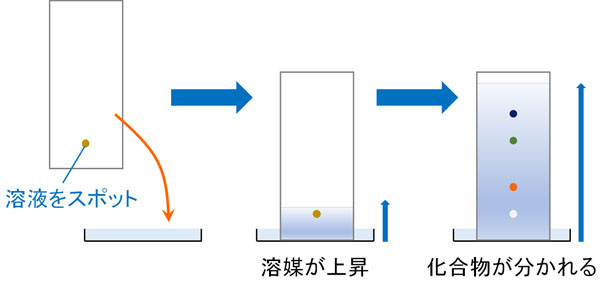
このとき、化合物ごとにRf値を測定できます。「シリカゲルの中を化合物が進む速度」をRf値といいます。以下のようになります。
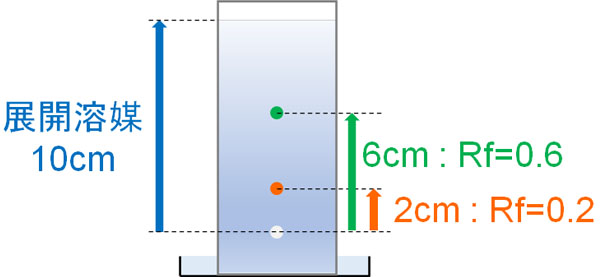
展開溶媒によってRf値は異なります。そこで酢酸エチルとヘキサンの割合を調節して、ターゲット化合物のRf値が0.3ほどになるようにします。Rf値が0.3であれば、早すぎず遅すぎないスピードにて、シリカゲルの中を移動してくれます。
Rf値が高いと、化合物のシリカゲルの移動速度が速いため、溶液中に含まれるその他の不純物と一緒に化合物が分離されるリスクがあります。一方、Rf値が低すぎると「長時間、展開溶媒を流しているにも関わらず、ターゲット化合物がカラムから出てこない」という状況に陥ります。
そこでTLCを行い、Rf値が0.3ほどになる展開溶媒を探します。その後、展開溶媒をカラムに流します。
・展開溶媒はジクロロメタン・メタノールでもいい
なお、カラムクロマトグラフィーでは酢酸エチルとヘキサンを混ぜた有機溶媒を利用するのが最も一般的です。ただ場合によっては、その他の展開溶媒を利用することもあります。
酢酸エチルとヘキサン以外では、ジクロロメタンとメタノールを混ぜた展開溶媒を利用することもあります。極性が非常に高い化合物を分けるとき、ジクロロメタン・メタノールの組み合わせのほうがいいこともあります。
やり方はシリカゲルを詰め、展開溶媒を流すだけ
カラムクロマトグラフィーの原理や特徴を解説してきました。それでは、実際にカラムクロマトグラフィーを行うとき、やり方はどうなるのでしょうか。
最初、カラムにシリカゲルを敷き詰めなければいけません。その後、化合物をシリカゲルの上に乗せます。ここまで準備が完了したら、展開溶媒を流すだけです。移動相が流れていけば、化合物も徐々に前に進むようになります。
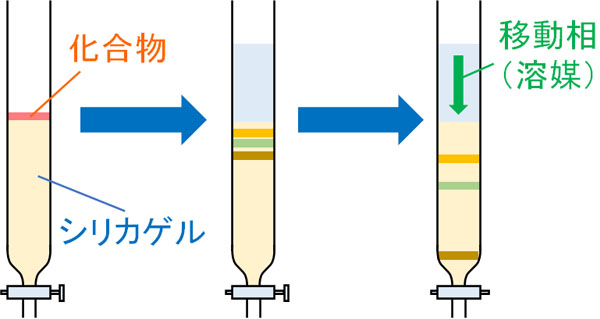
当然、カラムの先からは移動相である有機溶媒が出てきます。有機溶媒は試験管で集めますが、ターゲット化合物が含まれている溶液を回収すれば、化合物の分離が完了します。
それでは、例としてエストリオール、エストラジオール、エストロンの化合物を考えてみましょう。
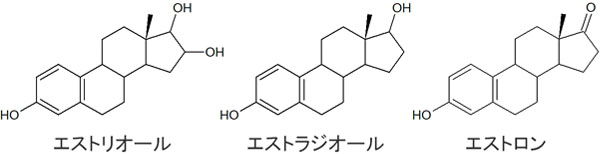
これらの化合物が混じっている溶液があるとします。この溶液をカラムクロマトグラフィーで分離するとき、どのようなスピードの違いを考察できるでしょうか。
極性の高さは「エストリオール > エストラジオール > エストロン」の順です。ヒドロキシ基(-OH)に着目すれば、物質の性質は容易に予想できます。
カラムクロマトグラフィーでは、脂溶性の高い化合物であるほどシリカゲルの影響を受けません。つまり、以下の順で物質が流れ出てくると予想できます。
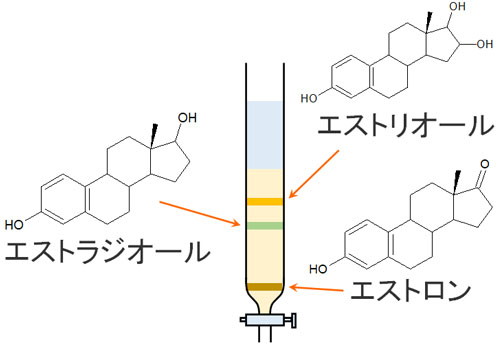
物質の極性に着目し、有機化合物を分離する実験操作がカラムクロマトグラフィーです。原理さえ理解すれば、どのようなスピードの違いによって、化合物が流れるのか考察できるようになります。
化合物が分かれない場合、カラムの長さを変える
ただ、実際の化学実験では化合物が分かれないことがあります。化合物を分離できるのは長所ですが、場合によっては実験操作を考えなければいけないのがカラムクロマトグラフィーの欠点です。
よくある事例としては、以下のように化合物同士のRf値が近く、分離しにくいことが挙げられます。

この場合、最も分かりやすいのは、カラムに詰めるシリカゲルの量を多くすることです。固定相(シリカゲル)が長くなるほど、物質は分離しやすくなります。
例えば100m走であれば、1秒の違いは大きな違いだといえます。一方、フルマラソンで42kmを走る場合、10分以上のタイム差があるのは一般的です。距離が長くなれば、その分だけ大きな違いが生まれるようになります。
Rf値を低くすれば失敗を防げる
または、Rf値を低くしてもいいです。同じカラムの長さであったとしても、Rf値が低いほど化合物を分離しやすくなります。
例えば100mを走るにしても、何も障害物がない場合、タイムの違いはわずかです。一方、100mの間に池や大きなブロック、迷路があればどうでしょうか。合計タイムは人それぞれ、まったく違ってきます。
この原理と同じように、Rf値が低いと化合物の分離能力は高くなります。もちろん化合物の移動速度は非常に遅くなるため、展開溶媒を流してもなかなか化合物が表れないという欠点はあります。ただ、より確実に化合物を分離できるようになります。
カラムクロマトグラフィーで化合物を分けられない場合、「固定相を長くする」「Rf値を低くする」の両方を採用するといいです。そうしないと化合物を分けることができずに失敗するからです。
原理を理解し、実験方法や注意点を学ぶ
カラムクロマトグラフィーは化合物を分離できるため、有機化合物を取り扱う研究室では多用される実験手法になります。そこで原理や特徴、長所・欠点を理解したうえで実験するようにしましょう。
固定相としてはシリカゲルを利用し、シリカゲルは極性が高いことを理解しましょう。そうすれば、化合物の極性が高くなるほどシリカゲルに吸着し、移動速度が遅くなると分かります。
また同時に移動相を決めなければいけません。有機溶媒を利用して展開溶媒を作成します。このときは酢酸エチルとヘキサンを混ぜる割合を決めます。酢酸エチルの割合が大きくなるほど、化合物は溶媒に溶出しやすくなって移動速度は速くなります。つまり、Rf値が大きくなります。
これらを学んだうえで展開溶媒を決め、Rf値を測定し、カラムクロマトグラフィーをします。これらの実験手順を理解すれば、いくつもの化合物が混じった状態であっても、目的化合物だけを分離できるようになります。






