沸点や凝固点を測定するとき、最もわかりやすいのは溶媒だけが存在している場面です。例えば、水の沸点は100℃であり、凝固点は0℃です。
ただほかの溶質が溶けている場合、沸点は上昇しますし、凝固点は低下します。例えば濃い塩水というのは、凝固点が-20℃以下になります。溶媒に化合物が溶けていると、その分だけ水は蒸発しにくくなるし、氷になりにくくなります。
それでは、なぜ沸点の上昇や凝固点の降下が起こるのでしょうか。また、どれだけの温度が上昇(または下降)するのか、計算するにはどうすればいいのでしょうか。
沸点上昇や凝固点降下が起こる事実を知っていても意味がありません。なぜ、これらの現象が起こるのか理解しましょう。そこで、沸点上昇や凝固点降下の原理や計算方法を解説していきます。
もくじ
化合物が溶けると蒸気圧が低下する
溶媒に溶質が溶けていることはよくあります。このとき、溶媒に化合物が溶けていると蒸気圧が低下します。これを蒸気圧降下といいます。
蒸気圧というのは、液体と気体が平衡状態になっているときの気体の圧力を指します。例えば水の場合、100℃になると飽和蒸気圧が大気圧と同じ1.013×105Paになります。その結果、100℃のときに沸騰することで液体の水は勢いよく気体になります。
このとき重要なのは、水の中に化合物が溶けていると蒸気圧が低下することです。蒸気圧が低下するというのは、空気中に存在する気体状態の水の圧力が低くなることを意味します。言い換えると、水に化合物が溶けると水は蒸発しにくくなります。
塩化ナトリウムや砂糖(グルコース)、尿素を含め、溶媒に化合物を溶かすと必ず蒸気圧が低下すると考えましょう。
ほかの化合物が存在すると蒸発しにくくなる
それでは、なぜ溶媒にほかの化合物が溶けていると蒸発しにくくなるのでしょうか。これを理解するため、分子を可視化しましょう。分子の動きを捉えることによって、蒸気圧降下が起こる理由がわかります。
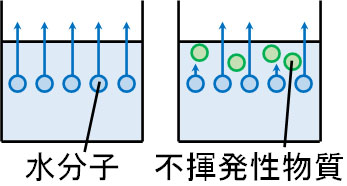
水が液体から気体になるとき、水の表面から水分子が飛び出します。水のみが存在する場合、気体になるときに邪魔をするほかの分子は存在しません。
一方、水に不揮発性物質が溶けているとどうでしょうか。水の表面には不揮発性物質が存在するため、不揮発性物質が水の通行を妨害し、水は水蒸気として外に飛び出しにくくなります。これが、蒸気圧降下が起こる理由です。
あなたについても、ほかの人がいない道を歩くときは目的地へ素早く到着できます。一方、以下のようにほかの人がたくさんいる道を歩いているときはどうでしょうか。

この状態では、素早く目的地に到着することができません。障害物(ほかの人)がたくさんあるからです。水溶液でも同様の現象が起こり、ほかの分子が溶媒の表面に存在することによって、水は液体から気体になりにくくなるのです。
蒸気圧降下によって沸点上昇が起こる
なお蒸気圧降下が起こるということは、沸点上昇が起こるのと意味が同じです。前述の通り、不揮発性物質(塩化ナトリウムやグルコースなど)が溶けていると、水の蒸発を邪魔するため、蒸気になりにくいです。そのため、より多くのエネルギー(熱)を加えないと飽和蒸気圧は大気圧と同じになりません。
飽和蒸気圧が大気圧と同じになることで、ようやく水は沸騰します。圧力(大気圧)が同じ場合、蒸気圧が下がることによって、以下のように沸点の温度は高くなります。
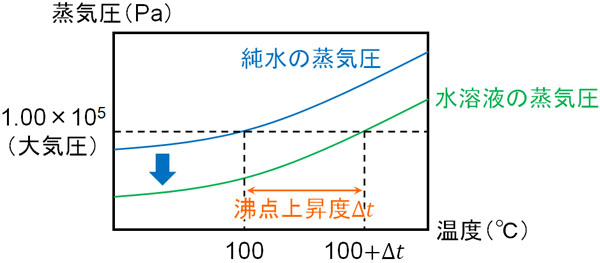
蒸気圧が低下したことにより、大気圧と同じ蒸気圧になるためには、100℃に対して沸点上昇度\(Δt\)だけ温度が高くなければいけません。100に\(Δt\)を加えることにより、新たな沸点となるのです。
水の沸点が100℃というのは、純水の場合に限られます。一方、溶媒に化合物が溶けている場合だと沸点は100℃になりません。
化合物が溶けることで凝固点降下が起こる
ここまで、沸点に着目して解説してきました。それでは、凝固点はどうなるのでしょうか。溶媒に溶質が溶けていると、前述の通り沸点は上昇します。一方、溶媒に化合物が溶けると凝固点は下がります。これを凝固点降下といいます。
水に食塩を加えると、-20℃であっても氷にならないのは凝固点降下が起こっているからです。もちろん食塩(塩化ナトリウム)だけでなく、砂糖(グルコース)を加える場合であっても凝固点降下が起こります。
凝固点降下が起こる原理についても、不揮発性物質の存在が関わっています。水が氷になるためには、H2Oのみが寄せ集まる必要があります。純水であれば、0℃では「水が氷になる速度(凝固する速度)」と「氷が水になる速度(融解する速度)」が同じです。
一方、不揮発性物質が水に溶けている場合はどうでしょうか。氷はH2Oだけで構成されており、氷から液体の水に変化するのは容易です。
それに対して、水が氷になるためには、多くの不純物(不揮発性物質)が存在している中から、H2Oだけを寄せ集めなければいけません。そのため水が氷になるとき、障害物(不揮発性物質)による影響が非常に大きくなります。
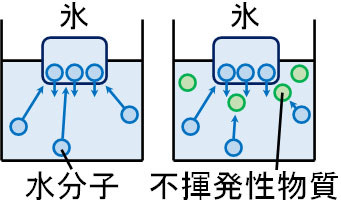
水に不揮発性物質が溶けていると、氷から水になるのは比較的容易であるものの、水から氷になる速度は遅くなります。そのためより低い温度にしなければ、液体の水を氷にすることができません。こうして、凝固点降下が起こります。
冷却曲線の読み方と過冷却
それでは、液体から固体になるときはどのような温度の推移になるのでしょうか。このとき、温度と冷却時間の関係を表す図に冷却曲線があります。
液体が固体になるとき、必ず「液体と固体が混ざっている部分」が存在します。つまり、冷却曲線は以下の3つの部分に分けることができます。
- 液体のみ
- 液体と固体
- 固体のみ
このとき、純水の冷却曲線は以下のようになります。
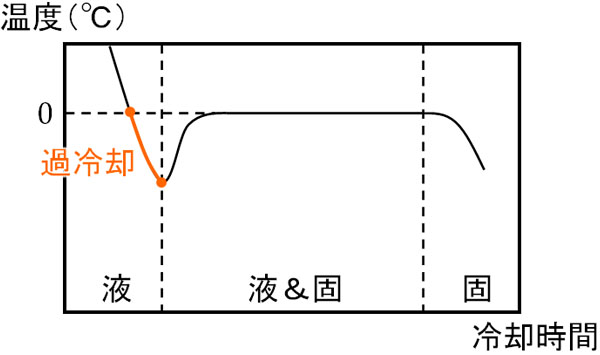
純水の場合、0℃で氷になります。また液体と固体の両方が存在している状態についても、0℃で徐々に液体が固体になります。このとき、液体から固体へ変化するときへこんでいる部分があります。この部分を過冷却といいます。
水を冷やすと一時的に0℃よりも低くなります。その後、液体から固体になるために凝固熱を発します。これによって液体と固体の両方が存在する状態となり、温度は0℃で一定となります。
なお、凝固する温度では過冷却を無視します。つまり、「液体と固体の両方が混ざっているときの温度」を基準にして凝固点を決めます。液体と固体が混ざっているときは0℃であるため、水の凝固点は0℃です。
・化合物が溶けているときの冷却曲線
一方、化合物が溶けているときの冷却曲線はどのようになるのでしょうか。溶媒に溶質が溶けている場合、以下のような冷却曲線になります。
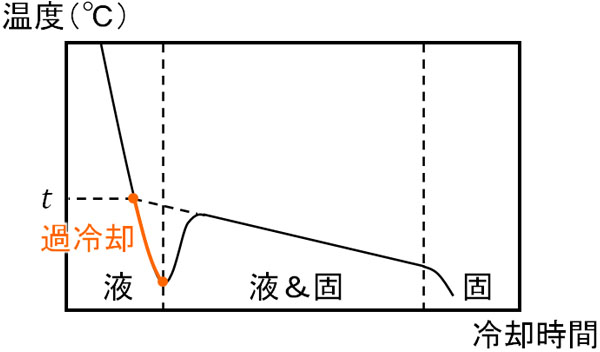
液体と固体が混ざっている状態では、時間経過と共に温度が下がっていきます。この理由としては、液体の水が氷になるとき、濃度が凝縮されていくからです。
水が氷になるためには、H2Oのみを集める必要があります。そのため液体に溶けている溶質の濃度が徐々に濃くなり、結果として時間経過と共に凝固点が下がっていくのです。
また凝固点については、液体と固体が混ざっているときの温度を伸ばし、過冷却の線と交わるときの温度が凝固点\(t\)になります。このとき、純水と水溶液のグラフを合体させると、凝固点降下度\(Δt\)を得ることができます。
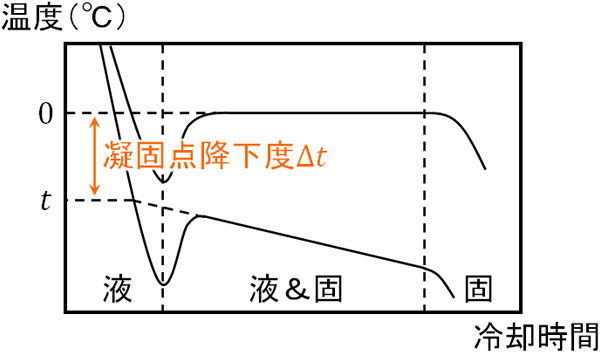
化合物が溶媒に溶けている場合、冷却曲線の形が変わります。また過冷却という現象が起こるため、どこが凝固点なのか把握しましょう。そうすれば、凝固点降下度がわかります。
質量モル濃度と公式を利用して沸点上昇度・凝固点降下度を計算する
それでは、どのように沸点上昇度や凝固点降下度を計算すればいいのでしょうか。これらを計算するとき、質量モル濃度(mol/kg)を利用しましょう。溶媒1kgに溶けている物質量を表すのが質量モル濃度です。
注意点として、モル濃度(mol/L)と質量モル濃度(mol/kg)は異なります。モル濃度は多くの場面で利用され、1Lに含まれている化合物の物質量を知ることができます。一方で質量モル濃度は沸点上昇度や凝固点降下度の計算のみに利用されます。
つまり質量モル濃度というのは、沸点上昇や凝固点降下の計算でしか利用価値がありません。そこで、モル濃度と質量モル濃度を明確に区別する必要があります。
沸点上昇度や凝固点降下度を計算する公式は非常に単純です。温度変化を\(Δt\)、質量モル濃度をmとすると、それぞれの公式は以下のようになります。
- 沸点上昇度:\(Δt=K_b×m\)
- 凝固点降下度:\(Δt=K_f×m\)
Kbは比例定数であり、モル沸点上昇(K·kg/mol)と呼ばれます。Kfも比例定数であり、モル凝固点降下(K·kg/mol)と呼ばれます。
化学の問題で沸点上昇度や凝固点降下度を計算するとき、必ずKbやKfが与えられます。そこで比例定数に対して質量モル濃度をかければ、沸点上昇度や凝固点降下度を得ることができます。公式は単純であるため、計算は簡単です。
例えば、以下の問題の答えは何でしょうか。
- 18gのグルコース(C6H12O6)を水500gに溶かすとき、水溶液の沸点は何度でしょうか。なお、水のモル沸点上昇Kbは0.52K·kg/molとします。また、C6H12O6の分子量は180です。
まず、質量モル濃度を計算しましょう。18gのグルコースは\(\displaystyle\frac{18}{180}=0.10\)molです。0.10molを500g(0.5kg)に溶かすため、質量モル濃度は0.20mol/kgです。そのため、以下のように沸点上昇度を計算できます。
\(Δt=0.2×0.52\)
\(Δt=0.104\)
沸点上昇度は0.104Kであるため、水溶液の沸点は100.104℃です。
溶質が電離する場合、溶液中の粒子数が多くなる
なお沸点上昇度や凝固点降下度を計算するとき、溶質の性質に着目しましょう。先ほど、グルコースを溶かす場面を考えました。グルコースが水に溶けるとき、電離することはありません。そのため、グルコースの物質量を利用して質量モル濃度を計算すればいいです。
一方、電離する溶質を溶かす場合は注意が必要です。質量モル濃度というのは、より正確にいうと「溶媒に溶けている粒子の物質量」を指します。つまり溶けている粒子の数を基準にしなければいけません。
例えば塩化ナトリウム(NaCl)を水に溶かすと、電離することでNa+とCl–に分かれます。これはつまり、電離することによって粒子の物質量が2倍に増えていることを意味しています。そのため沸点上昇度や凝固点降下度を計算するとき、塩化ナトリウムの物質量に対して2倍しなければいけません。
同じことは他の物質にも当てはまります。例えば塩化カルシウム(CaCl2)を水に溶かすとき、1つのCa2+と2つのCl–が生成されます。水に溶けることで粒子の数が3倍に増えるため、塩化カルシウムの物質量に対して3倍することで沸点上昇度や凝固点降下度を計算しましょう。
例えば、以下の問題の答えは何でしょうか。
- 塩化ナトリウム(NaCl)を水1kgに溶かすとき、沸点上昇度を0.104Kにするためには、何グラムの塩化ナトリウムを加えればいいでしょうか。なお、水のモル沸点上昇Kbは0.52K·kg/molとします。またNaClはすべて電離し、NaClの式量は58.5です。
塩化ナトリウムの質量モル濃度を計算しましょう。溶かす塩化ナトリウムを\(x\)gとすると、塩化ナトリウムの物質量は\(\displaystyle\frac{x}{58.5}\)です。ただ塩化ナトリウムは電離することで粒子の数が2倍になるため、物質量を2倍しましょう。つまり、塩化ナトリウムを水に溶かすときの物質量は\(\displaystyle\frac{2x}{58.5}\)です。また水1kgに溶かすため、\(\displaystyle\frac{2x}{58.5}\)は質量モル濃度でもあります。
水のモル沸点上昇Kbが0.52K·kg/molであり、沸点上昇度を0.104Kにすればいいため、以下の計算式を作れます。
\(0.104=0.52×\displaystyle\frac{2x}{58.5}\)
\(x=5.85\)
こうして、塩化ナトリウムを5.85g加えれば沸点上昇度が0.104Kあがることになります(沸点は100.104℃)。溶媒に溶かすことで電離する場合、粒子の数に注意しましょう。
弱電解質の場合、電離度を利用して計算する
なお場合によっては、弱電解質の溶質を溶かすこともあります。弱酸や弱塩基の物質というのは、水溶液中で完全に電離しているわけではありません。一部が電離することにより、弱酸性または弱塩基性となります。
この場合、電離度に着目しましょう。酢酸や炭酸水素ナトリウムなど、弱電解質では電離度を利用することにより、水溶液中に存在する粒子の数を計算できます。
例えば1molの化合物が存在するとしましょう。塩化ナトリウムのような強電解質の場合、電離度は1です。そのためNa+とCl–に分かれ、粒子数が2倍(2mol)になります。
それでは、電離度が0.1の弱電解質を1mol溶かす場合だと粒子数は何倍になるでしょうか(塩化ナトリウムと同じように、電離した後は1つの陽イオンと1つの陰イオンに分かれるケースを想定します)。
電離度は0.1であるため、1molのうち、0.1molが電離してイオンとして存在することになります。そのため、イオンとして存在する粒子の数は0.2molです。また、電離していない化合物は0.9molです。そのため、この化合物を1mol溶かすと粒子の数は1.1mol(1.1倍)に増えます。
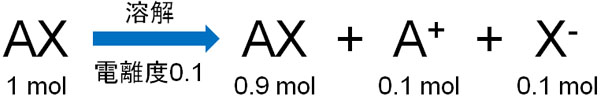
このように、電離している化合物(イオン)と電離していない化合物の物質量がどのように変化しているのかについて、電離度を用いて計算しましょう。そうすれば、化合物を溶かすことによって物質量がどれだけ増えるのかわかります。
その後の計算はここまで解説した方法と同じです。質量モル濃度と比例定数を利用して、沸点上昇度や凝固点降下度を計算しましょう。
質量モル濃度を利用し、沸点上昇度や凝固点降下度を計算する
沸点や凝固点を確認するとき、多くのケースで一つの溶媒に着目します。ただ場合によっては、溶媒に化合物が溶けているケースがあります。この場合、溶液の沸点や凝固点は変化します。沸点は上昇し、凝固点は低くなるのです。
そこでなぜ沸点が上昇し、凝固点が下がるのか理解しましょう。分子を可視化して、実際に分子が動く場面を想定すると理由を理解できます。
なお沸点上昇度や凝固点降下度を計算するとき、質量モル濃度と比例定数を利用します。質量モル濃度とモル濃度は異なるので区別しましょう。また、質量モル濃度では溶けている粒子に着目するため、電離する化合物では物質量が変化することに注意しましょう。
溶媒に溶質を溶かすと、沸点と凝固点が変化します。また、どれだけの物質量を溶かすのかによって変化する温度が変わります。そこで、沸点上昇(蒸気圧降下)と凝固点降下の原理や計算方法を理解しましょう。






