多くの場合、化学物質は混合物として存在しています。例えば食塩水は水と塩(塩化ナトリウム)の混合物です。そこで科学研究をする場合、これらの化合物を分けることを考えなければいけません。このとき重要な方法がろ過、蒸留、分留、再結晶、昇華です。
混合物の分離では、化合物の状態変化を利用して物質を分ける場合が多いです。例えば蒸留や分留、昇華は化合物の状態変化を利用して分けます。
化学物質は状態変化します。物質が状態変化することについては、私たちは全員が知っています。例えば水であれば、氷(固体)や水(液体)、蒸気(気体)と状態変化することが可能です。当然、水以外の化学物質も状態変化します。
そこで、化合物を分ける方法を理解しましょう。このとき化合物の状態変化を学べば、混合物の分離について内容をより把握できるようになります。ここでは、混合物の分離と状態変化について解説していきます。
もくじ
混合物の分離:ろ過、蒸留、分留、再結晶、昇華
混合物を分離する方法はいくつか存在します。その中から最適な方法を選び、化合物を分けるようにしましょう。
なお大学などの研究室では、化合物を分けるときに最も利用される方法はクロマトグラフィーです。ただクロマトグラフィーは大学課程の化学で学ぶ内容なので、ここでは詳細を省きます。その代わり、高校化学の基礎では以下の方法を学びましょう。
- ろ過
- 蒸留
- 分留
- 再結晶
- 昇華
こうした方法についても多くの場面で利用されています。例えばウイスキーなどの蒸留酒は分留を利用して作られます(蒸留酒という名前であるものの、化学での正しい操作の名称は分留です)。私たちの身の回りで混合物の分離が行われているケースは多いのです。
それでは、それぞれの分離方法を確認していきましょう。
ろ過:固体と液体を分ける
ろ紙を用いることによって、液体と固体を分ける操作をろ過といいます。固体はろ紙を通過しません。一方、液体はろ紙を通過します。そのため液体と固体の混合物の場合、ろ紙を利用することで物質を分けることができます。
例えばコーヒーが好きな人の場合、毎朝コーヒーフィルター(ろ紙)によってコーヒーをろ過しています。コーヒーは液体なのでろ紙を通過するものの、コーヒー豆は固体なのでろ紙を通過しません。

ろ過という作業は、私たちが多くの場面で日常的に利用しています。そのためろ過については、特に問題なく理解できると思います。
蒸留:固体(液体に溶けている物質)と液体を分離する
コーヒー豆の場合、固体なのでろ過できます。ただ固体の中には、液体に溶ける物質がたくさん存在します。例えば塩(塩化ナトリウム)が該当します。
食塩水について、ろ紙を使っても塩と水に分けることはできません。塩は水に溶けているため、ろ紙を通過してしまいます。この場合、蒸留をしましょう。
水は液体であるため蒸発します。一方、塩が気体になることはありません。塩のように、気体にならない化合物を不揮発性物質といいます。そこで水を沸騰させれば、水は気化して塩が残ります。こうして、塩と水を分けることができます。
ただ水を沸騰させた後、何も処理をしない場合、水は空気中に消えていきます。そこで水を気体にした後、冷やすことによって再び液体に戻します。これにより、液体と固体を分けることができます。以下は蒸留をするときの装置です。
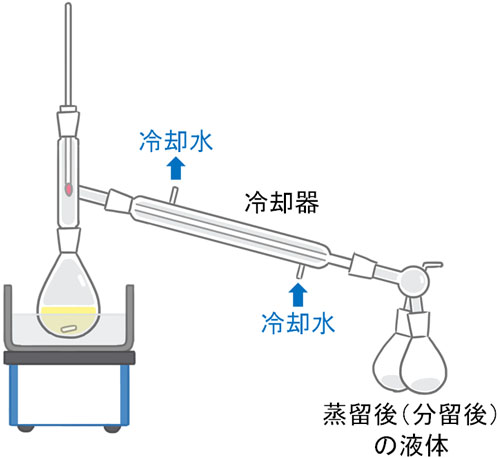
なお液体を蒸発させるとき、蒸気を冷やすために冷却器を通します。このとき、常に冷却器を冷やすため、冷却水を管の外側に流します。このとき、冷却水は必ず下から上に流すようにしましょう。冷却水を上から下に流す場合、重力によって水がすぐに下から流れ出てくるため、冷却器を効率的に冷やせないからです。
分留:沸点の違いを利用し、液体と液体を分ける
それでは、2種類の液体が混ざっている場合はどのように分離させればいいのでしょうか。この場合、蒸留と同じ装置を利用することによって化合物を分けましょう。このように液体と液体を分ける場合、分留といいます。
化合物によって沸騰する温度(沸点)が異なります。例えば水の沸点は100℃であるものの、エタノールの沸点は78℃です。
そこで、温度を78℃に設定します。そうするとエタノール(アルコール)は積極的に気体になるものの、水はほとんど気体になりません。また冷却器を通れば、エタノールは再び液体に戻ります。こうして作られるのがウイスキーなどの蒸留酒です。
沸点の差を利用することによって分離するのが分留です。沸点の低い液体を蒸発させた後、冷却することによって再び液体に戻して分離します。
再結晶:溶解度の差を利用して結晶を析出させる
純度の低い物質について、純度の高い結晶として析出させ、分離する手法に再結晶があります。溶媒(水や有機化合物など)に溶けることのできる化合物の量はそれぞれ決まっています。再結晶ではこの性質を利用します。
例えば塩(塩化ナトリウム:NaCl)と硝酸カリウム(KNO3)を比べると、高温では硝酸カリウム(NaNO3)が溶けやすいです。一方、低温では硝酸カリウムはほとんど溶けません。
そのため熱い温度によって硝酸カリウムをたくさん溶かした後、水の温度を低くします。そうすれば、水に溶けることができる硝酸カリウムは限界値を超え、硝酸カリウムは結晶(固体)として析出します。
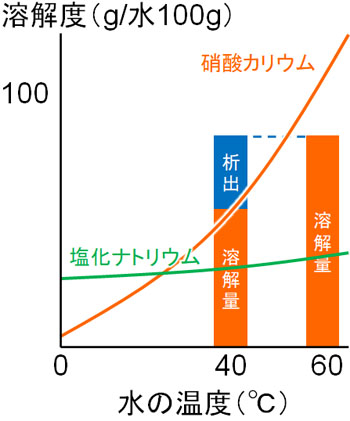
一方で塩(塩化ナトリウム:NaCl)の場合、温度が高くなっても水に溶ける量はほとんど変わりません。そのため水の温度を高温から冷ます場合、硝酸カリウムの結晶のみ取り出すことができます。
なお教科書によっては、再結晶を「固体Aと固体Bの溶解度の違いを利用して分離する方法」と説明していることがあります。ただ、これは明らかに間違いです。実際の化学実験では、2つの固体が溶けているとき、再結晶を利用して分離することはほとんどしません。
先ほど述べた通り、再結晶は純度の低い物質について、純度を高める方法です。つまりメインの化合物は一つであるものの、ほかの不純物が少し存在するとき、より純度を高めるために再結晶を利用します。
単一の化合物を水や有機化合物に溶かす場合、化合物に比べて不純物の濃度は非常に低く、結晶として析出することはありません。そこで再結晶を行い、純度の高い固体として析出させることで不純物と分離するのです。
昇華:固体を気体に変え、分離する
化合物の中には、液体を経由せず、固体から気体になる物質があります。代表例はヨウ素(I)です。そこで固体Aと昇華性のある固体B(ヨウ素など)が混ざっているとき、加熱することによって固体を気体へ変え、分離する方法があります。これを昇華といいます。
気体にした後、蒸留や分留と同じように、冷やすことによって気体を固体に変えます。蒸留の場合、冷やすことによって気体は液体になります。一方、昇華では液体にならない物質を利用するため、冷やすことによって固体を得られます。
不純物が混じっているヨウ素について、分離したい場合は昇華を利用します。なお実際の化学実験では、昇華を利用する場面はほとんどありません。ただ、知識としてもっておくことは重要です。
物質の状態変化
ここまで解説した混合物の分離について、多くのケースで物質の状態変化を利用していることがわかります。つまり液体を気体にしたり、その反対に気体を液体にしたりして混合物の分離を行うのです。
化合物によって融点(固体から液体になる温度)や沸点(液体から気体になる温度)が異なります。この性質を利用することによって混合物を分離できます。
物質の状態変化ではエネルギーが関係しています。温度が低い状態では、物質がもつエネルギーも低いです。そのため水は密集し、氷の状態となります。そこで熱エネルギーを加えると、水は密集している状態をやめ、自由に動き始めます。これが液体の状態です。
ここへさらに熱エネルギーを与えると、水は気体になります。気体の場合、空気中を自由に動き回ります。つまりエネルギーが大きいほど、物質の動きは活発になります。
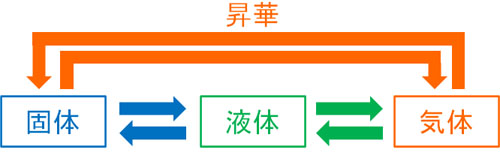
なおこのとき、ヨウ素のように物質によっては液体を経由せず、固体から気体になることがあります。この場合が昇華です。
状態変化が起こっているとき、温度は一定
なお状態変化が起こっているとき、温度は一定です。例えば水の場合、融点は0℃です。そのため氷が溶けて水になるとき、または水が氷になるとき、温度は0℃で一定です。どれだけ熱を加えても、どれだけ冷やしても、固体と液体が混ざっている状態では温度は一定です。
一方、すべて水の状態の場合は温度が変化します。水の温度は0~100℃まであります。このとき、水を沸騰させるときは温度が100℃で一定です。液体と気体が混ざるとき、沸点の温度(100℃)で一定になるのです。
ただすべて気体になったあと、温度を100℃よりも高くすることが可能です。
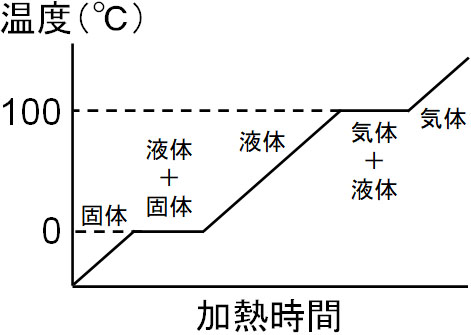
固体と液体、液体と気体のように、2つの異なる状態で存在しているとき、熱エネルギーは状態変化に利用されます。一方で固体のみ、液体のみ、気体のみの状態で存在している場合、熱エネルギーは温度上昇に利用されます。
物質の状態変化を利用することによって蒸留や分留、昇華が可能です。どのように物質が状態変化するのか知ることで、混合物を分けるようにしましょう。
化学で重要な操作の一つが混合物の分離
化学実験を行うとき、複数の物質が混ざっている状態は好ましくありません。そこで、混合物を分けることを考えましょう。もちろん化学実験に限らず、コーヒーやお酒を造るときなど、混合物を分ける操作は多くの場面で利用されています。
混合物を分けるとき、複数の方法があります。その中でも代表的な方法がろ過や蒸留、分留、再結晶、昇華です。これらはすべて重要な操作です。
なお混合物を分離するとき、多くの場面で化合物の状態変化を伴います。物質ごとに融点や沸点が異なるため、状態変化させることによって分離するのです。
高校化学で最も基本的な内容の一つが混合物の分離と物質の状態変化です。どのように状態変化が起こり、混合物を分離すればいいのか理解しましょう。






