分子が結合を作るとき、法則に従う必要があります。自由に原子同士が結合を作れるわけではないのです。そうしたとき分子が結合を作るときの法則として、オクテット則があります。
高校化学でも大学化学でも、オクテット則を満たすように分子の電子を考えなければいけません。オクテット則に従えば、実際には起こらない「不可能な有機化学反応の予測」を避けられるようになります。また、分子の安定性を理解できるようになります。
オクテット則を説明するとき、ルイス構造が頻繁に用いられます。分子同士の結合について、電子の数を記したものがルイス構造式です。
ルイス構造式を最初に学び、その後にオクテット則を理解すれば、「どのように分子が結合を作っているのか」を分かるようになります。ここでは、ルイス構造式の書き方やオクテット則の考え方について、分かりやすく解説していきます。
もくじ
電子が2つあることで結合を作る
どのようにして、分子は結合を作るのでしょうか。これについて、電子が2つあることで共有結合を作るのが大原則となる考え方です。
原子は、それぞれ電子を保有しています。以下のようになります。
- 炭素原子:電子6個(価電子4つ)
- 窒素原子:電子7個(価電子5つ)
- 酸素原子:電子8個(価電子6つ)
- フッ素原子:電子9個(価電子7つ)
これらの原子が互いに結合するとき、電子を一つずつ出し合うようになります。図にすると、以下のようになります。
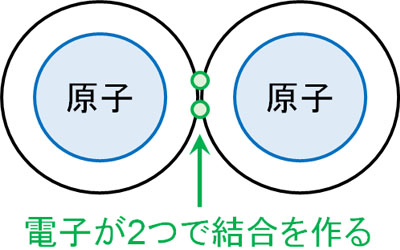
電子を一つずつ出すと、電子の数は2つになります。つまり分子として共有結合があるとき、そこには必ず2つの電子が存在していることを意味しています。また一つの結合について2つの電子であるため、二重結合では4つの電子があります。三重結合では、6つの電子です。
いずれにしても、一つの結合につき2つの電子が存在すると考えましょう。
ルイス構造式の書き方:ケクレ構造と合わせて利用する
それでは、分子が結合している状態はどのように記されるのでしょうか。有機化学では多くの場合、ケクレ構造で記します。高校化学でも大学化学でも、以下のような構造式が頻繁に出てきます。
この構造式がケクレ構造です。分子の構造を表すとき、非常に簡単に表せるようになります。ケクレ構造では、電子による共有結合を単線や二重線、三重線などによって表します。
一方でルイス構造という書き方もあります。ルイス構造式では、線を利用して構造式を表すのではなく、点(ドット)によって記します。ケクレ構造とルイス構造の違いについては、以下のようになります。
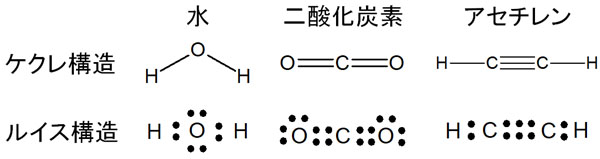
一つの結合に対して、2つの電子対に対応していると考えましょう。二重結合や三重結合だと、結合の数が増えるに従って電子が2つずつ増えていきます。
なおケクレ構造では、非共有電子対(孤立電子対)を記すことはありません。一方でルイス構造式では、非共有電子対を含めて電子を記します。そのため水でも二酸化炭素でも、ルイス構造では非共有電子対をすべて記します。
なお実際の有機化学反応では、ケクレ構造をメインとしつつ、ルイス構造式を併用します。ケクレ構造に加えて電子のドットを書き、どのように化学反応が起こっているのか記すのです。そのため、ケクレ構造とルイス構造の両方とも多用されると考えましょう。
有機化学でも無機化学でも、ルイス構造が頻繁に用いられます。書き方は難しくないですが、必ず内容を理解しなければいけません。
最外殻電子(価電子)が8個になるのがオクテット則
このとき、自由にルイス構造式を記してもいいわけではありません。原子には電子があり、法則に基づいてルイス構造を記す必要があります。そうしたとき非常に重要となる原則がオクテット則です。
オクテット則によるルール自体は非常に簡単です。以下のようになります。
- 第二周期の原子が安定な状態になるためには、価電子が8個になる必要がある
第二周期の原子としては、代表例として炭素原子や窒素原子、酸素原子、フッ素原子があります。これらの原子が安定な状態で存在するためには、最外殻電子(価電子)が8個でなければいけないのです。事実、炭素や窒素、酸素、フッ素は例外なくオクテット則を満たします。
また第二周期の原子でなかったとしても、基本的にはオクテット則を満たします。塩素原子や臭素原子などのハロゲンが結合して分子を作るとき、電子が8個ある状態になるのが一般的です。
もちろん水素については、電子が8個入ることはありません。水素原子は電子を一つだけ共有することで、ヘリウムと同じ電子数になります。つまり、最外殻電子が2個になることで安定な状態となります。
希ガス(貴ガス)と同じ電子配置を取ることで安定となる
それでは、なぜオクテット則では最外殻電子が8個になるように電子を描くのでしょうか。これは、希ガス(貴ガス)と同じ電子配置を取ることができるからです。
希ガスは非常に安定した状態であることが知られています。希ガスとしては、ヘリウム(He)やネオン(Ne)などが知られています。これら希ガスは安定であるため、分子ではなく原子単体で存在しています。

酸素原子や窒素原子など、そのままの状態では最外殻電子が8個ではなく、非常に不安定な状態だといえます。そこで電子を出し合うことで、原子同士で電子を共有します。その結果、最外殻電子を8個(水素の場合は2個)にしようとするのです。
なぜオクテット則を満たす必要があるのかというと、その理由としてはオクテット則を満たすことで分子は安定状態となるからです。
イオンやカルボカチオンで考える安定・不安定
オクテット則は8電子則とも呼ばれています。価電子が8個あるように記すことから、8電子則という言葉になっています。
こうしたオクテット則を考えるとき、イオンにしてもいいです。例えば水やアンモニアがイオンになると、以下のようになります。
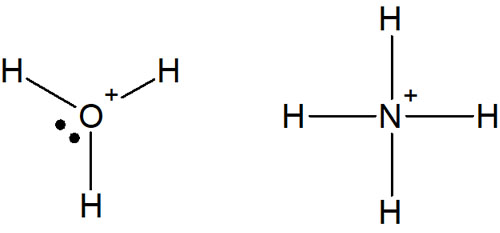
酸性の水ではH3O+が生成されます。またアンモニアが水に溶けてイオンになっていると、NH4+となります。イオンの状態であっても、分子はオクテット則を満たします。
通常、酸素原子は価電子が6つであるため、2本の結合を作り、非共有電子対は2つです。しかしヒドロニウム(H3O+)のようにイオン(酸)として水が存在する場合、酸素原子は3本の結合を作り、非共有電子対(孤立電子対)は1つになります。
また窒素原子は価電子が5つです。そのため3本の結合を作り、非共有電子対は1つです。ただイオンでは4本の結合を作るようになり、非共有電子対はありません。ただ、どの構造も最外殻電子が8個となっており、オクテット則を満たすことが分かります。
・カルボカチオンが不安定なのはオクテット則を満たさないから
一方でオクテット則を満たさなければどうなるのでしょうか。この場合、非常に不安定な物質となります。このとき、カルボカチオンが事例として頻繁に利用されます。
炭素上に正電荷をもつ物質がカルボカチオンです。ケクレ構造とルイス構造式でカルボカチオンを書くと、以下のようになります。
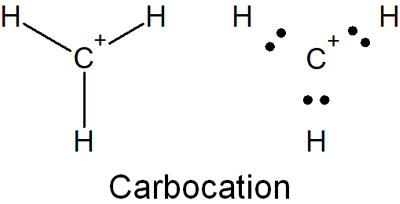
このように、最外殻の電子が8個となっていません。オクテット則を満たしていないことから、カルボカチオンは非常に不安定な分子だといえます。
そのため仮にカルボカチオンを生じたとしても、エネルギーが非常に高い分子であるため、すぐに化学反応を起こして他の分子と結合するようになります。オクテット則を満たすように分子が化学反応することで、安定した状態になろうとするのです。
不可能な有機化学反応をオクテット則で避ける
それでは、なぜこれらオクテット則を考えなければいけないのでしょうか。有機化学反応が起こるとき、オクテット則を満たすように考えておかなければいけません。そうすれば、不可能な有機化学反応の予測を避けられるようになります。
例えばアンモニウムイオン(NH4+)は先ほど述べた通り、オクテット則を満たしているため、これ以上の結合を作ることはできません。そのため、以下のような反応は起こりません。
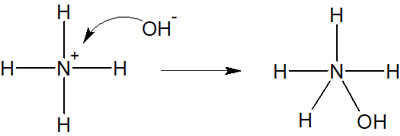
この場合、生成物には窒素原子に5本の結合があります。窒素に着目すると、電子を10個もつことになります。オクテット則を満たしていないため、こうした反応を予測してはいけません。
そうではなく、正しくは以下のようになります。
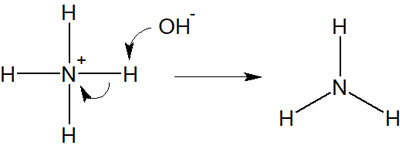
この場合、反応前も反応後も窒素原子はオクテット則を満たしています。窒素原子は非共有電子対(孤立電子対)が1つあるため、アンモニア(NH3)はオクテット則を満たしているといえます。
オクテット則を満たさない例外がホウ素やリン、硫黄
それでは、オクテット則を満たさない例外はあるのでしょうか。前述の通り炭素原子や窒素原子、酸素原子、フッ素原子はオクテット則を必ず満たします。カルボカチオンなどのように、仮にオクテット則を満たさない場合、エネルギーが高く不安定なのですぐに反応して他の分子となります。
ただ場合によっては、オクテット則を満たしていないにも関わらず、安定な分子として存在することがあります。
非常に分かりやすい例としては水素があります。水素原子は電子を共有することでヘリウムと同じ電子をもつことになり、電子を2つ保有します。オクテット則を満たすことで、最外殻電子8個を有することはありません。
ただ第二周期の原子であったとしても、オクテット則を満たさないケースがあります。その代表例がホウ素原子(B)です。ホウ素は価電子が3つです。ホウ素原子は3つしか電子を共有することができないため、3の結合を作ります。例えば、ボラン(BH3)は以下のようになります。
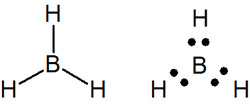
水素原子やカルボカチオンがオクテット則を満たさないことについては、既に説明したので理解していると思います。ただホウ素原子についても、例外的にオクテット則を満たさないことが知られています。
なお元素周期表の前半にある以下の原子はオクテット則に従わないことが知られています。
- ベリリウム(Be)
- ホウ素(B)
- アルミニウム(Al)
そのためベリリウム(Be)、ホウ素(B)、アルミニウム(Al)はオクテット則を満たさない例外と理解しましょう。
オクテット則を満たさなくてもいい事例を理解する
また第3周期元素を含め、第2周期の元素以外だと、オクテット則に従わないことがよくあります。こうした原子としてはリン(P)や硫黄(S)が知られています。リン酸や硫酸など、これらの分子はリン(P)や硫黄(S)が含まれており、オクテット則に従いません。
オクテット則には多くの例外があります。特に元素周期の前半だったり、第3周期元素以降の原子だったりする場合、必ずしもオクテット則を満たしている必要はありません。
オクテット則というのは、あくまでも経験則にすぎません。そのため数多くの例外があります。前述の通り、炭素原子や窒素原子、酸素原子、フッ素原子はオクテット則に従います。しかし、これ以外の原子ではオクテット則を満たさない例外が非常に多いと理解しましょう。
有機化学でも無機化学でも、炭素原子や窒素原子、酸素原子が頻繁に用いられます。そのため、オクテット則を理解することは非常に重要です。ただ、これらの原子以外についてはオクテット則の例外がたくさん出てくるようになります。
ルイス構造を学び、オクテット則を理解する
化学で非常に重要な要素が電子です。どのように電子が動くのかによって、分子の結合がどのようになっているのかを予測できます。
原子は電子を1つずつ出し合うことで結合を作ります。どのように電子を出し合い、結合を作ったり非共有電子対が存在したりしているのかを表すものがルイス構造式です。多くはケクレ構造を利用しますが、ルイス構造を併用することは非常に多いです。有機化学でも無機化学でもルイス構造は活躍します。
なおルイス構造の書き方としては、オクテット則を満たすようにしましょう。化学で重要な原子は炭素や窒素、酸素、ハロゲンであり、これらの原子はオクテット則を満たすように結合を作ります。
ただ水素やカルボカチオンに限らず、ホウ素(B)やベリリウム(Be)、アルミニウム(Al)、リン(P)、硫黄(S)と多くの例外があるのがオクテット則です。適用されるのは第二周期の後半にある原子であることを理解して、オクテット則を利用するようにしましょう。






