新たな炭素鎖を作る合成反応として、エノール・エノラートを用いた合成があります。カルボニル基のα炭素(カルボニル炭素の隣にある炭素)が重要な役割を果たしており、酸性度が高いために塩基によってプロトン(H+)が引き抜かれる性質があります。
そのためカルボニル基の隣にある炭素が起点となり、エノール・エノラートが生成します。その後、反応させたい化合物を加えることでアルキル化され、新たな炭素鎖を作れるのです。
有機化学で重要なエノラートの合成反応について、利用する試薬や位置選択性を事前に理解しなければいけません。もちろん、反応機構を学ぶ必要もあります。
エノール・エノラートの分野にはクライゼン縮合やアルドール反応、マイケル付加など、有機化学で非常に重要な反応がいくつも存在します。これらの合成反応を学ぶためにはカルボニル基のα炭素の性質を理解する必要があるため、どのような性質になっているのか解説していきます。
もくじ
カルボニル基のα炭素は酸性度が高い
カルボニル基を有する化合物は多様な合成反応が可能です。カルボニル基の場合、炭素原子と酸素原子が二重結合でつながっているため、電子が酸素原子に移動できます。
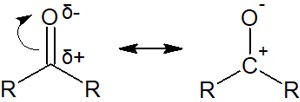
そのため求核剤が存在する場合、カルボニル炭素が攻撃されます。これを求核付加反応といいます。
ただカルボニル化合物では、隣にある炭素原子の水素原子が引き抜かれることがあります。塩基によってプロトンが抜き取られることで、以下のような化合物が生成されます。
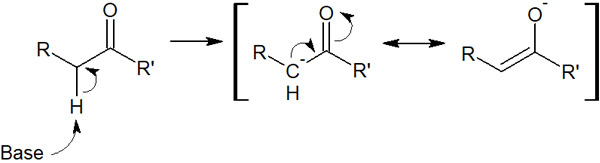
重要なのは、カルボアニオンを生じていることです。カルボアニオンが存在するので不安定な物質ですが、共鳴構造を書けるため、強塩基によってプロトンが引き抜かれるとこのような分子を得られます。この分子をエノラートといいます。
エノラートはこのように共鳴できるため、カルボニル基の隣にある水素原子は酸性度が高く、塩基によってプロトン(H+)が引き抜かれやすくなっています。
なお、カルボニル基の隣の炭素をα炭素といいます。以下のように、カルボニル基を起点にα位やβ位、γ位と識別します。
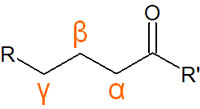
エノラートではカルボニル化合物のα炭素が重要な要素になります。エノラートイオンが中間体として作られることで、さまざまな化学反応が起こります。
ケト・エノール互変異性とエノール・エノラート
カルボニル化合物では、通常の状態をケト型といいます。ただ、強塩基が存在するとエノラートが作られます。これをケト・エノール互変異性といいます。反応機構は先ほど示した通りです。
C=Oの構造を有している化合物がケト型です。一方でアルケンに-OHが結合している場合、エノール型といいます。ケト・エノール互変異性によって、ケト型とエノール型はそれぞれ形を変えることができます。
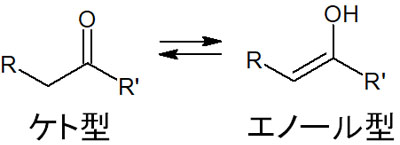
なおエノール型のとき、-OHの構造を有している場合はエノールといいます。それに対して、酸素原子がマイナスの電荷を有している場合はエノラートといいます。以下の通りです。
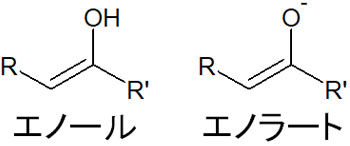
エノールとエノラートでは、より重要なのはエノラートです。強塩基によってプロトンが引き抜かれた結果、エノラートが生成されます。
求核性があり、SN2反応で炭素結合を作るエノラート
なぜ、有機化学でエノラートが重要なのでしょうか。それは、エノラートのα炭素がマイナスの電荷を帯びており、カルボアニオン(カルバニオン)として求核性をもつからです。
前述の通り、強塩基を利用することでエノラートが生成されます。その後、エノラートは求核剤としてSN2反応を起こします。以下のような求核置換反応により、新たな炭素鎖を作ることができます。
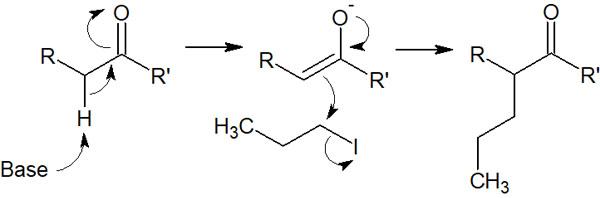
最初、塩基を試薬として加えることでエノラートを合成します。その後、ハロゲン化アルキルを加えることでSN2反応が進行します。
塩基を加えることでエノラートが生成した後でなければ、ハロゲン化アルキルを加えてはいけません。エノラートを合成した後に次の反応を進める必要があります。また、加える塩基は1当量です。塩基が溶液中に残っていると、ハロゲン化アルキルと反応する可能性が高いからです。
立体障害が大きく、かさ高い塩基のLDAはエノラート生成に重要
ただ、カルボニル基は反応性が高いことで知られています。塩基を加えることで、カルボニル炭素に求核剤が攻撃し、以下のような求核付加反応が起こります。
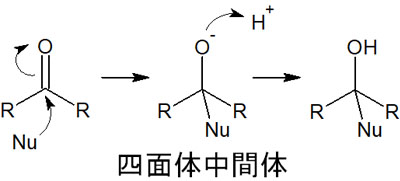
どのようなときに、求核剤がカルボニル炭素を攻撃するのではなく、エノラートの生成が起こるのでしょうか。それは、かさ高い塩基を利用したときだといえます。
エノラートの生成では、多くの場合でかさ高い塩基が利用されます。こうした強塩基としては、例えばLDA(リチウムジイソプロピルアミド:Lithium diisopropylamide)が知られています。以下の構造をもつ化合物がLDAです。
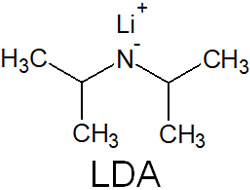
このようにかさ高い塩基だと、立体障害が大きいです。そのため、カルボニル炭素に対して求核攻撃することはできません。
その代わり、カルボニル基のα炭素に結合している水素原子を引き抜くことは可能です。プロトンの引き抜きであれば、立体障害による影響が少ないからです。
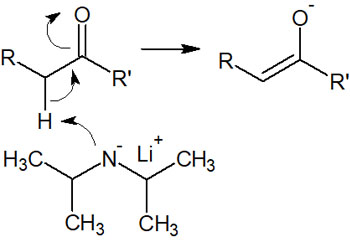
またかさ高い塩基であれば、ハロゲン化アルキルを溶液に加えたとき、立体障害によって反応しにくいという利点もあります。強塩基ではあるものの、求核攻撃できない試薬を利用することがエノラート生成で重要なポイントです。
・NaH(水素化ナトリウム)も強塩基で利用される
または、NaH(水素化ナトリウム)もエノラートを生成させる強塩基として利用されることがあります。NaHは強塩基であるものの、求核性がないからです。
NaHはかさ高い塩基ではありません。むしろ、非常に小さい分子です。ただ軌道が小さく、求核性がないことから、エノラート合成での重要性は高いです。
シアノ基やニトロ基など、電子吸引基でアルキル化が可能
なお、このように強塩基によってアニオンが生成されるのは、ケトンやアルデヒドだけではありません。カルボニル基に限らず、その他の電子吸引基についてもエノラート等価体として、アニオン性をもつ化合物を強塩基によって合成できます。
電子吸引基としては、例えば以下があります。
- シアノ基(-CN)
- ニトロ基(-NO2)
- エステル(-COO)
- アミド(=CO-NR2)
これらは電子吸引性があるため、カルボニル基のα炭素と同じように、α炭素は酸性度が高くなっています。そのため強塩基を加えることによって、カルボアニオン(カルバニオン)をもつエノラート等価体を合成できます。例えば、以下のようになります。
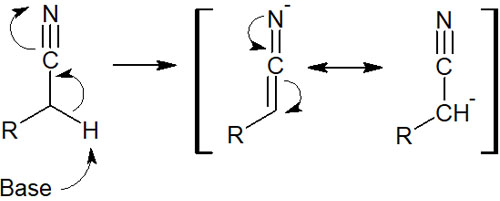
電子吸引基が分子内に存在する場合、ケトンやアルデヒドに限らずα炭素のプロトンが引き抜かれます。
ケトンのアルキル化で重要な位置選択性
なおケトンを含め、電子吸引基が存在する化合物では、エノラートが生成されるときに一つの問題点があります。それは位置選択性です。どの部分のα水素が引き抜かれ、アニオン性を帯びるのかは非常に重要な要素です。
例えば、ケトンでは以下のようにプロトンが引き抜かれる場所が2つ存在します。
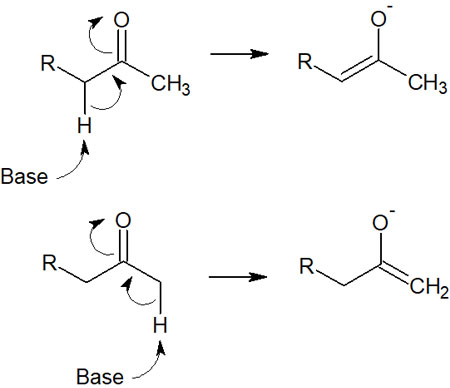
エノラートを利用したアルキル化で位置選択性が重要になるのは、2つの化合物が生成される可能性があるからです。そのため、どのようにエノラートが合成されるのか理解しなければいけません。
熱力学的支配:酸性度やアルケンの安定性で反応位置性が決まる
エノラートの位置選択性では、2つの考え方があります。その中の一つが熱力学的支配による位置選択性です。要は、化合物を反応させるときに必要な活性化エネルギーが低いほど、優先的に反応が起こりやすくなります。
熱力学的支配による位置選択性で分かりやすいのは酸性度の違いです。カルボニル基のα炭素について、酸性度が異なる場合は一方だけアルキル化されます。例えば、α炭素の両隣にカルボニル基が存在する以下の化合物では、強塩基を加えることで一つのエノラートのみ生成されます。
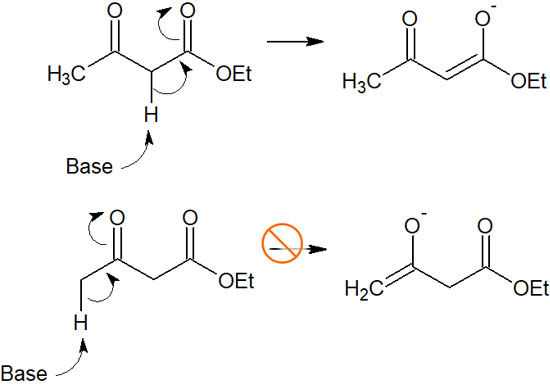
カルボニル基がα炭素の隣に2つある場合、より酸性度が高くなることは容易に予想できます。そのため熱力学的支配での位置選択性により、一つの化合物だけ得られます。
・置換基の多い化合物は安定になりやすい
ただ、カルボニル基がα炭素の両隣に存在する化合物は稀です。その場合、どのように化合物生成を予測すればいいのでしょうか。
化合物が二重結合を作るとき、多置換アルケンが生成するように化合物が合成されます。これをザイツェフ則(Saytzeff則:セイチェフ則)といいます。以下のように、アルケンの安定性には順番があります。
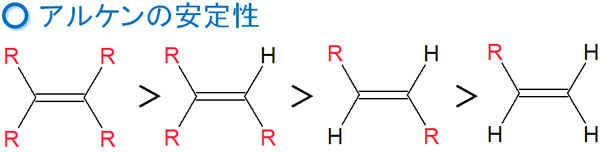
二重結合にはπ結合が存在します。π結合は結合に対して垂直に伸びています。その結果、隣にあるC-H結合とπ軌道が平行になり、弱いながらも電子を共有することで分子構造が安定化します。これを超共役といいます。
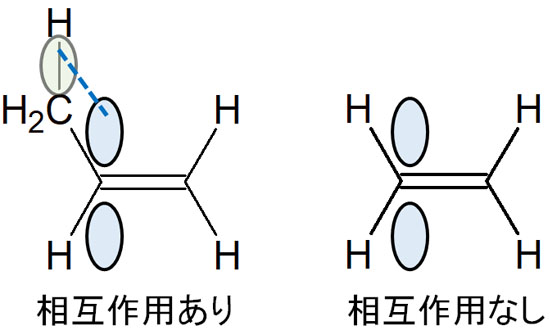
そのためアルケンに多くの置換基があるほど、アルケンの構造は安定化します。
これはエノラート生成でも同様です。エノラートが合成されるとき、安定な構造をもつ中間体が優先的に生成されます。その結果、二重結合に多くのアルキル鎖が結合するようにエノラートが合成されます。
例えばNaH(水素化ナトリウム)を加えるとき、生成するエノラートは以下のようになります。
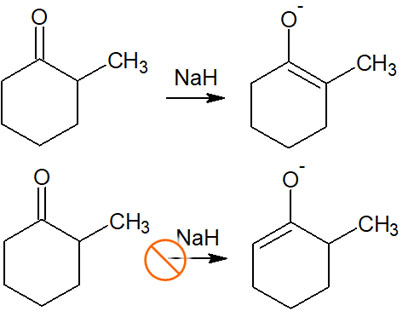
熱力学的支配での位置選択性を考えるとき、ザイツェフ則によってエノラートの位置選択性を予測できるようになります。
速度論支配:かさ高い塩基の利用で少ない置換基を合成
それでは、置換基が少ないアルケンとなるようにエノラート合成することはできないのでしょうか。この問題について、かさ高い塩基を利用することで少ない置換基になるように化合物を合成できます。
NaHのように立体障害がない強塩基では、先ほど解説した熱力学的支配による位置選択性により、多置換のエノラートが生成されます。一方でLDAのようにかさ高い強塩基を利用する場合、立体障害によって置換基の少ないプロトンが引き抜かれやすくなります。
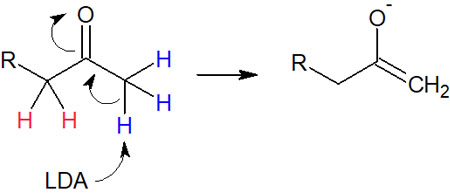
多置換アルケンの安定性を考慮したとき、前述の通り活性化エネルギーという点では、置換基が多いエノラートのほうが生成しやすいです。ただ立体障害があるため、かさ高い塩基を利用する場合、最初に引き抜かれるプロトンは置換基が少ない部分となります。
これが速度論支配での反応条件です。使用する強塩基の立体障害が大きいほど、置換基の少ないエノラートが合成されます。例えば、以下の合成は速度論支配によって反応が進行します。
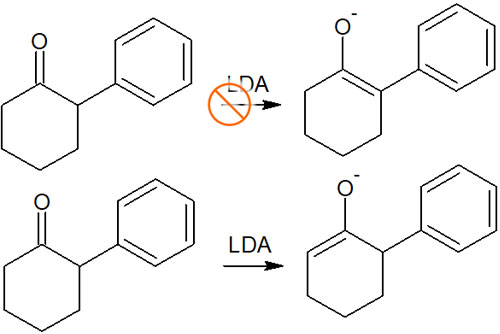
このように、エノラートの位置選択性は使用する試薬によって変わります。NaHのように小さい強塩基を利用する場合、熱力学的支配で反応が進みます。一方でLDAのようにかさ高い強塩基を利用する場合、立体障害が原因で速度論支配にて反応が進行します。
ケトンなど、電子吸引基のエノラート合成
カルボニル基のα炭素は酸性度が高いことで知られています。そのため強塩基を利用することで、エノラートを合成できます。ハロゲン化アルキルを加えることでSN2反応によって新たなアルキル鎖を合成できるため、エノラートを用いた有機合成は非常に利便性が高いです。
これらの化合物を用いて合成反応を進めるためには、エノールとエノラートの違いを理解しなければいけません。また、どのような強塩基であれば求核付加反応が起こらず、エノラートを合成できるのか学ぶ必要があります。
それだけでなく、エノラートの合成で常に問題になるのが位置選択性です。NaHなど小さい塩基では置換基の多いエノラートが合成され、LDAなどかさ高い塩基では少ない置換基のエノラートが生成されます。
エノール・エノラートの合成反応はクライゼン縮合やアルドール反応など、重要な有機化学の合成反応に広く関与しています。これらの反応を理解するための基礎を解説してきたため、必ず事前に理解するようにしましょう。






