有機化学で必須となる知識が共鳴です。二重結合や三重結合がある場合、分子は共鳴構造を書くことができます。電子は一つの場所に留まっているわけではなく、いろんな場所を移動しています。その結果、一つの分子であってもいろんな構造式を書くことができます。
なお共鳴について学ぶと、電子が絶え間なく次々と移動しているイメージをもつ人がいるかもしれません。ただ、共鳴はそういう概念ではありません。
すべての人が最初に学ぶ有機化学の概念の一つが共鳴です。しかし共鳴の考え方や書き方について理解できず、結果として大学の有機化学を嫌いになる人が多いです。
共鳴構造式をどう考慮するのかを学べば、分子の安定化や酸性度の概念を理解できるようになります。ここでは、共鳴の原理を解説していきます。
もくじ
オゾンやベンゼンはルイス構造で説明できない
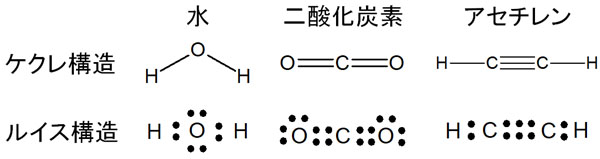
分子の構造を表すとき、ケクレ構造やルイス構造が頻繁に用いられます。分子の結合を線で表すのがケクレ構造です。一方、分子の結合を点(ドット)で表すのがルイス構造です。
以下がケクレ構造とルイス構造です。
実際の有機化学では、これらケクレ構造とルイス構造を組み合わせて利用します。
そうしたとき、ルイス構造式で記したときにつじつまが合わない事態に陥ることがあります。頻繁に利用される事例としては、オゾン(O3)やベンゼン、硝酸イオン(NO3–)などがあります。それぞれの構造式は以下のようになります。
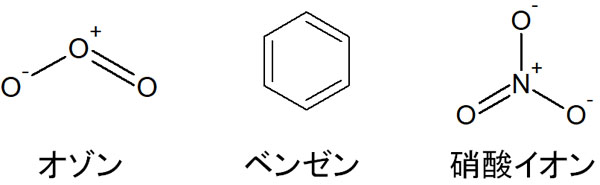
例えばオゾンに着目しましょう。オゾンでは分子の中に単結合と二重結合があります。この構造が正しい場合、二重結合の部分では結合力が強くなっているはずです。しかし実際には、オゾンで単結合と二重結合の部分は結合の強さが同じです。
同じことはベンゼンや硝酸イオン(NO3–)にもいえます。なぜ、そのようになっているのでしょうか。これは、オゾンやベンゼン、硝酸イオンでは以下の構造が混じっているからです。
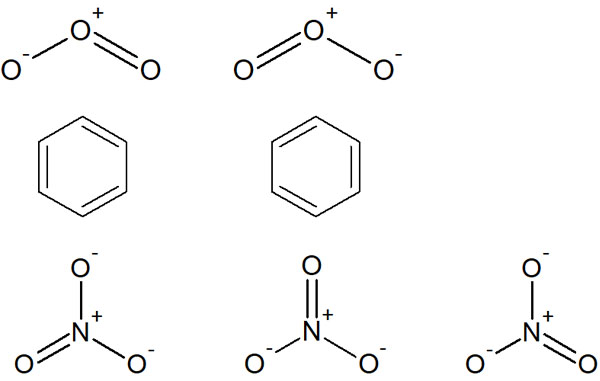
例えばオゾンでは、2つの構造がごちゃ混ぜになって存在しています。硝酸イオンでも、3つの構造があります。複数の構造式が存在するにも関わらず、一つの構造式で書くために矛盾を生じるようになります。
非局在性により、電子は分子全体に広がっている
この矛盾を解消するため、共鳴構造式を利用します。電子が移動する式を書くことで、複数の構造式が存在することを記すのです。例えば、オゾンでは以下のようになります。

非共有電子対(孤立電子)が動く様子を記すことで、共鳴構造式を書くことができます。これにより、いくつもの構造式が混ざって存在していることを理解できます。
・電子が次々と移動するのが共鳴ではない
注意点として、共鳴では電子が分子内を次々と移動しているわけではありません。共鳴構造式の書き方では、矢印を活用して電子が動くように記します。そのため、絶え間なく電子が分子内を移動し、構造式が変化しているように考えてしまう人がいます。
ただ、これは間違いです。あくまでも、複数の構造式が混じっている状態が共鳴だと理解しましょう。もちろん電子が動くことで構造式を変化させることはあります。ただ、いくつもの構造が混じった状態が共鳴なのです。
そのためオゾンでは、以下が正しい構造式です。
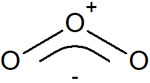
オゾンでは、2つの構造式が1:1の割合で存在しています。同じように、ベンゼンや硝酸イオンでも複数の構造式が一定の割合が混じっています。
・共鳴により、電子は非局在化する
このように共鳴構造式を書くことができれば、電子の存在はどのようになるのでしょうか。電子は一ヵ所だけに留まっているわけではなく、いろんな場所に存在していることになります。共鳴構造式を書ける分だけ、電子はあらゆる場所が存在する確率が高くなります。
これを、電子の非局在化といいます。一つの場所に留まる必要はなく、電子は分子内のあらゆる場所に存在するのです。
共鳴構造を書けるほど電子は安定化する
それでは、こうした共鳴構造を書くことにはどのような意味があるのでしょうか。共鳴構造を書ける場合、電子は安定化します。
電子が小さい箱に中に入るほど、エネルギーは高くなることが知られています。電子は波であり、量子力学では波動関数で表します。要は、「電子は波である」と理解すればいいです。
電子が波とはいっても、いろんな幅(振動数)の波があります。これらの波を狭いエリアに閉じ込めるとします。そうすると、さまざまな振動数をもつ波(さまざまな運動力をもつ波)を狭いエリアで取り入れる必要があり、結果としてエネルギーが高くなります。
一方で共鳴構造式によって多くの構造式を書けると、その分だけ電子が存在できる範囲が広くなります。非局在化によって、狭いエリアだけに留まる必要はなく、電子は分子の中を自由に動けるようになります。
こうして電子が存在できるエリアが広がった結果、電子は安定化します。これが、共鳴構造を書けるほど電子が安定化する理由です。
「共鳴構造を書ける=電子の安定化」と教えられますが、その理由を考える機会は少ないです。本来は難しい数式を利用しながら電子安定化の理由を説明することになりますが、そうすると内容が非常に難しくなります。そこで数式を解きながらの理由解明については、量子力学に興味のある物理学生のみ挑戦してみてください。
二重結合(π結合)があると共鳴が起こる
それでは、どのようなときに共鳴が起こるのでしょうか。これについては、大まかに「二重結合があるとき、共鳴構造式を書ける」と考えましょう。
分子の結合では、s軌道やp軌道が結合に関与します。このとき、単結合(σ結合)だけの場合、共鳴構造を書けることはありません。二重結合や三重結合として、π結合があるからこそ共鳴構造をとることができます。
先ほどのオゾンやベンゼン、硝酸はすべて共通点があります。それは、分子の中に二重結合を有する点です。あらゆる分子にて、二重結合や三重結合があれば共鳴構造を描けると考えましょう。
オクテット則は安定構造に寄与する
それではπ結合があれば、どのような分子であっても共鳴するのでしょうか。もちろん、そういうわけではありません。共鳴構造式を書けるにしても、安定した構造式でなければ意味がありません。より正確にいうと、オクテット則を満たしたうえで共鳴構造を書く必要があります。
一つの原子が8個の電子を有する状態で安定になることをオクテット則といいます。特に炭素原子や窒素原子、酸素原子、フッ素原子はオクテット則を満たさなければいけません。
例えば電子が自由に動けるのであれば、以下のような共鳴構造式を書くことができます。
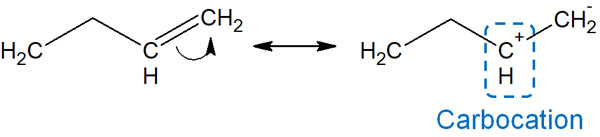
しかし実際には、このような共鳴は起こりません。なぜなら、カルボカチオンを生じているからです。カルボカチオンでは、炭素原子に電子が6個しかない状態です。価電子が8個あるとオクテット則を満たして安定になります。しかし、カルボカチオンはオクテット則を満たしておらず不安定です。
つまり、こうした共鳴はほぼ起こらないといえます。二重結合(π結合)があれば、自由に共鳴するわけではありません。
一方で、オクテット則を満たすように共鳴構造式を書ける場合、電子は非局在化するようになります。そうした共鳴は構造安定化への寄与が大きいといえます。
酸素原子・窒素原子や共役構造の存在が共鳴構造式に重要
それでは、どのようなときに分子は共鳴するのでしょうか。見つけ方はあるのでしょうか。π結合(二重結合や三重結合)を有するのは必須条件だと既に記しました。他に見つけ方としては、以下の条件が加わると共鳴を起こしやすいです。
- 酸素原子または窒素原子がある
- 共役している
実際には、他にも共鳴する条件はいくつもあります。例えば、リン(P)や硫黄(S)などの原子があると共鳴します。ただ分かりやすく考えるため、最初はこれらの条件に着目しましょう。
共鳴を書ける場合、多くのケースで酸素原子(O)または窒素原子(N)が分子内にあります。これらの原子は非共有電子対があり、さらには二重結合を作れます。また、プラスまたはマイナスの電荷になることも可能です。性質を変化させることができるため、共鳴の起点になりやすいです。
ただ、酸素原子や窒素原子だけが存在しても共鳴構造を書くことはできず、二重結合が必要です。特に共役構造がある場合、共鳴を書けるようになります。二重結合がいくつも連なっている構造が共役です。例えば、ベンゼン環は共役の一種だといえます。
以下はアニリンの共鳴構造です。
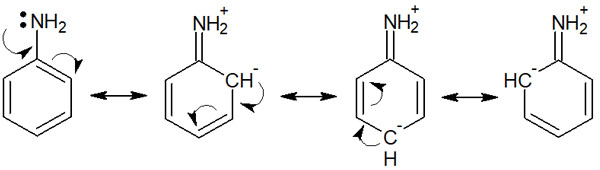
このようにアニリンでは共鳴構造を描くことができます。窒素原子の電子を起点として、芳香環(ベンゼン環)の共役構造によって複数の共鳴を書けるのです。
もちろん共役構造がなかったとしても、硝酸イオン(NO3–)や炭酸イオン(CO32-)などのように、複数の共鳴を書けるケースはあります。ただいずれにしても、酸素原子や窒素原子を起点にして、二重結合や三重結合を利用しながら共鳴を書きます。
共鳴するから分子が安定化し、酸性度や塩基性に関わる
これら共鳴を書くことで何が分かるのでしょうか。先ほど説明した通り、多くの共鳴によって分子の非局在化が起こることで、分子は安定しやすくなります。オクテット則を満たす必要はありますが、電子が広く分散することで、分子が安定して存在できるのです。
これが分子の酸性度や塩基性に関与します。
例えば、ヒドロキシ基(-OH)は中性の分子です。酸性でも塩基性でもありません。一方でフェノールは酸性の分子として知られています。
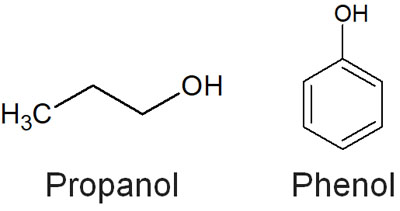
ベンゼン環に-OHが結合しているフェノールですが、なぜアルキル鎖に結合しているヒドロキシ基のように中性ではないのでしょうか。フェノールでは、イオン化することで共鳴構造を書くことができます。以下の通りです。
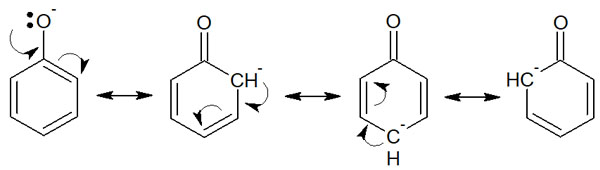
プロパノールの場合、すべて単結合(σ結合)なので共鳴構造を書くことはできません。一方でフェノールでは、イオン化した後にベンゼン環との共鳴構造をいくつも書くことができます。つまり、イオン化した後に構造が安定化します。これが、フェノールで酸性を示す理由です。
共鳴によって安定化するというのは、酸性度に関わります。高校化学では「フェノールは酸性を示す」と覚えるだけであり、理由を理解することはありません。そこで共鳴について学べば、なぜアルキル鎖に結合したヒドロキシ基(-OH)が中性なのに、フェノールが酸性なのか理解できるようになります。
有機化学の基礎が共鳴構造
基本ではあるものの、理解しにくい概念が共鳴です。共鳴について初めて学ぶとき、多くの人が「なぜ電子が勝手に動くのか?」と疑問に思います。その結果、有機化学を理解できなくなってしまいます。
オゾンのように、いくつもの構造が複数存在するケースがあります。そこで共鳴構造を書くことで、複数の分子が混じっていることを理解する必要があります。次々と絶え間なく電子が動いているわけではなく、電子が広い範囲に存在することを、共鳴を書くことによって示すのです。
ただオクテット則を満たすように共鳴を書く必要があります。これらのルールを理解し、π結合(二重結合と三重結合)や酸素原子・窒素原子に着目すると、共鳴構造を描けるかどうかを見分けられるようになります。
またこうした共鳴構造を学ぶのは、有機化学反応を理解するときに役立ちます。共鳴の概念を理解しなければ、有機化学の反応機構を理解するのは不可能だといえます。そこで共鳴の概念を理解し、共鳴構造式を書けるようにしておきましょう。