物理化学でも有機化学でも、原子の状態を理解することは重要です。どのように原子同士が結合し、分子を形成するのか学ぶのです。これら結合の状態を知ることで、有機化合物の合成反応がどのように進行するのかを把握できます。
分子の結合には、HOMOとLUMOが知られています。結合性軌道や反結合性軌道とも呼ばれています。HOMOは結合性軌道に関与しており、LUMOは反結合性軌道に関わっています。
物理では、量子力学の分野になるのがHOMOとLUMOです。ただ物理の教科書では難しい数式が多く、理解するのが難しいです。
結合の概念を理解するだけであれば、数式は不要です。抽象的な概念になりがちな結合性軌道と反結合性軌道ですが、できるだけ簡単に分かりやすく解説していきます。
もくじ
量子力学のフロンティア軌道論を波動関数で考える
電子のような、小さい物質を理解するための学問に量子力学があります。量子力学にはフロンティア軌道論というものがあります。大まかに考えると、以下がフロンティア起動論になります。
- 化学反応では、HOMOとLUMOが関与する
また量子力学では、波動関数で表します。電子は波の一種であり、波動関数を利用するのです。
海の波を見れば分かる通り、波は上下に波打っています。このとき同じ位相の波が組み合わさると、重なり合うことで波の振動幅は大きくなります。一方、逆位相の波が組み合わさると互いに打ち消しあい、振動は起こらなくなります。
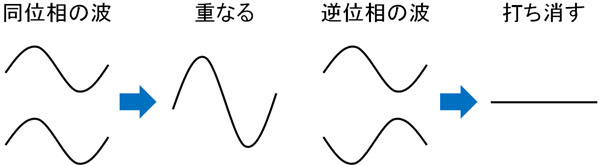
波動関数という言葉を使うと難しくなってしまいます。そうではなく、電子は波の一種であると理解すればいいです。
結合性軌道と反結合性軌道の違い
電子が波としての性質があり、互いの性質を増強したり打ち消したりすることを理解すれば、HOMOとLUMOの考え方を理解できます。
HOMOはHighest Occupied Molecular Orbitalの略であり、HOMOは結合性軌道のことを指しています。一方でLUMOはLowest Unoccupied Molecular Orbitalの略であり、LUMOは反結合性軌道のことを指します。
結合性軌道と反結合性軌道の違いは何でしょうか。これは文字通り、分子の結合に関与しているのが結合性軌道です。一方で、分子結合の開裂に関与しているのが反結合性軌道です。
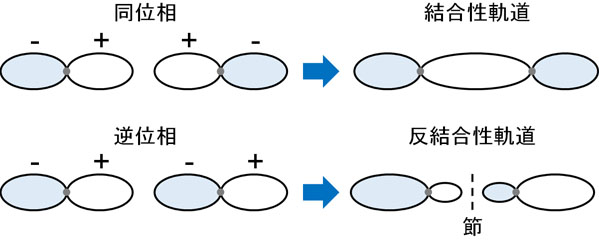
まず、水素分子の例で考えてみましょう。水素原子は一つの電子があり、s軌道を有しています。同位相の水素原子同士が近づいたとき、2つの水素原子は重なり合います。つまり、原子同士が結合して分子を形成します。

原子は陽子をもっています。そのため原子同士は反発します。ただ電子はマイナスの電荷をもつため、水素原子同士の間に電子が存在することで安定状態となり、結合を作るようになります。電子が水素分子の結合を作るのを助けるのです。
これが結合性軌道です。同位相の軌道が組み合わさることで結合性軌道(HOMO)が作られます。その結果、原子同士の結合を作ります。
反結合性軌道(LUMO)は節があり、エネルギーが高い
それに対して、逆位相の波はどうでしょうか。逆位相の場合、先ほどとは様子が異なります。逆位相のため、水素原子の中間は波が完全にゼロになります。逆位相によって、互いの波を打ち消しあうからです。
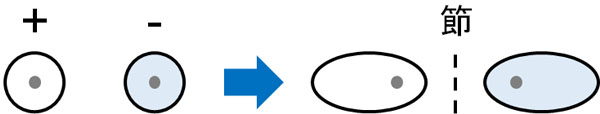
このとき、波が存在しない中間部分を節といいます。節では、電子の存在確率がゼロになります。軌道に電子があったとしても、2つの水素原子の間には電子密度がありません。そのため結合形成を助けるのではなく、むしろ結合を開裂させるように働きます。これを反結合性軌道(LUMO)といいます。
結合性軌道(HOMO)と反結合性軌道(LUMO)を比較したとき、当然ながら結合性軌道のほうがエネルギーは低いです。水素原子は互いに電子を共有し、水素分子を形成することで、より低いエネルギーになることを目指します。
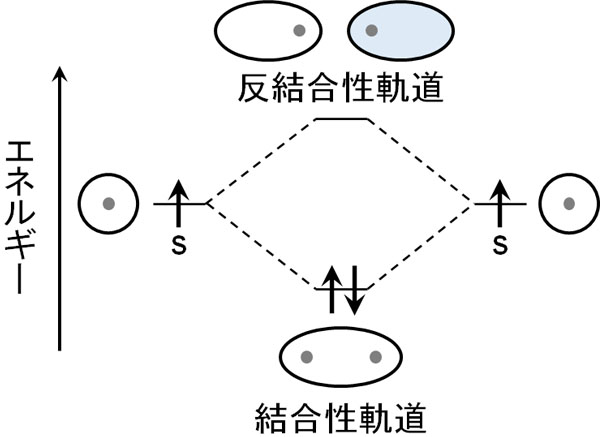
それに対して、反結合性軌道はエネルギーが高いです。水素原子のs軌道よりも、高いエネルギー状態となるのがLUMOです。
有機化合物が反応するとき、結合が切れなければいけません。エネルギーを与えることで、電子状態を反結合性軌道に導けば、分子の結合が切れます。その後、有機化学反応が起こり、分子同士が新たな結合を作ります。
HOMOとLUMOのエネルギー差をHOMO-LUMOギャップといいます。エネルギーギャップに相当するエネルギーを外から与えることで、電子は反結合性軌道へ移動し、結果として不安定な状態になります。
例えば臭素分子(Br2)の場合、光エネルギーを当てることで結合が切れます。これはHOMO-LUMOギャップに相当する光エネルギーが加えられた結果、電子の状態が反結合性軌道となり、結合が切れて臭素原子となるからです。
ヘリウムが分子にならないのは反結合性軌道が関係する
結合性軌道と反結合性軌道を学べば、なぜヘリウムが分子ではなく原子で存在するのか理解できるようになります。
水素原子が1つの電子をもつのに対して、ヘリウムは2つの電子をもちます。仮にヘリウム(He)が分子を形成し、He2となればどうでしょうか。この場合、結合性軌道に電子が2つ入ります。また同時に、反結合性軌道にも電子が2つ入ります。
以下のような状態です。
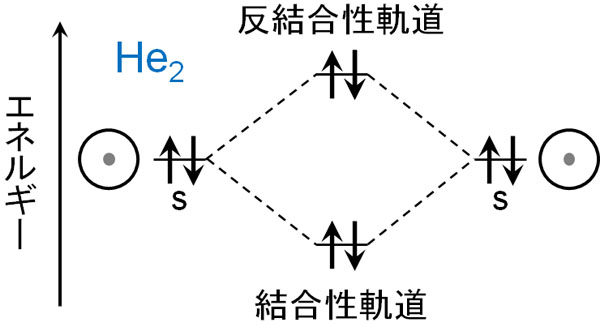
結合性軌道だけに電子が入る場合、安定な状態になるため、水素のように結合が作られて分子となります。しかしヘリウムでは、反結合性軌道に電子が入ります。
反結合性軌道は結合が開裂するように機能します。そのためヘリウム分子が作られたとしても、すぐに結合が開裂してヘリウム原子に戻ります。これが、ヘリウムが結合を作らず原子で存在する理由です。
p軌道でのσ結合とσ*結合によるHOMOとLUMO
ここまでの説明では、水素原子によるs軌道を用いて解説してきました。ただ水素以外の原子だと、s軌道だけでなくp軌道も持ちます。また電子軌道で共有結合を作るとき、σ結合やπ結合などの種類もあります。
これらの軌道や結合はどのように考えればいいのでしょうか。次にs軌道だけではなく、p軌道でも考えてみましょう。
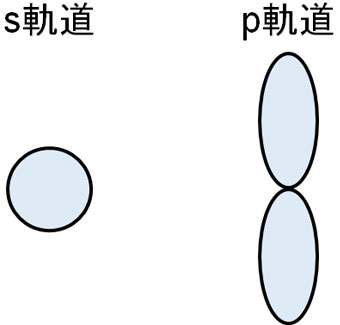
炭素や窒素、酸素などの原子では、より多くの電子をもつようになります。その結果、s軌道だけではなくp軌道を有するようになります。
分子同士がつながるとき、最初は必ずσ結合(シグマ結合)を作ります。それぞれの原子が電子を出し合うことで、単結合を作るのです。p軌道が結合を作るとき、s軌道と同じように波の性質が異なるようになります。同位相では互いを強め合い、強い共有結合を作ります。これがσ結合です。
それに対して、逆位相では中間地点で電子密度がゼロになる部分が存在します。反結合性軌道であり、節を作ります。
s軌道とp軌道では、電子雲の形が異なります。ただ同位相や逆位相という違いによって、HOMOとLUMOを作るのは同じです。p軌道のσ結合では、以下のようなイメージで結合性軌道と反結合性軌道が形成されます。
なお結合性軌道では、単結合はどれもσ結合です。一方で反結合性軌道では、σ*結合と記します。同じσ結合(シグマ結合)ではあっても、LUMOで結合の開裂に関与する場合は書き方がσ*結合になると理解しましょう。
σ結合だと、非常に結合エネルギーが強いです。強い結合ですが、エネルギーを加えることで反結合性軌道であるσ*結合になると、単結合が開裂するようになります。
p結合で二重結合・三重結合を作るときのπ結合とπ*結合
ただp軌道の結合では、σ結合(シグマ結合)だけでなくπ結合(パイ結合)も存在します。単結合ではσ結合になりますが、二重結合や三重結合を作る場合はπ結合が形成されます。共有結合には、σ結合とπ結合の種類があります。
π結合では、HOMOやLUMOはどのようになるのでしょうか。π結合では、電子が直接重なるわけではありません。p軌道が上下に伸び、互いが薄く重なることで結合を形成します。同位相の場合、これによって形成される結合がπ結合です。
単結合はどれもσ結合ですが、二重結合などのように結合が増える場合、新たな結合の部分はπ結合となります。
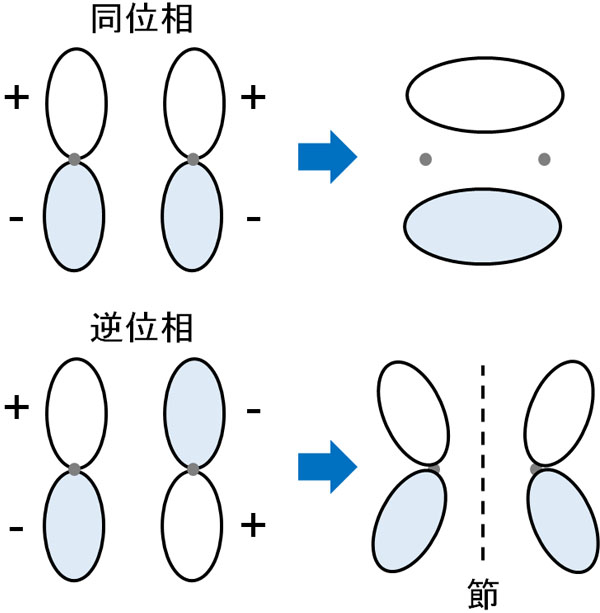
それに対して、逆位相では反結合性軌道となります。互いに反発し、π軌道の中間地点で電子密度がゼロになります。節を生じることで、結合が切れるようになります。反結合性軌道のπ結合はπ*と書かれます。
ブタジエンでのHOMOとLUMO
それでは、結合性軌道・反結合性軌道とHOMO・LUMOは性質が違うのでしょうか。結合性軌道の一つにHOMOがあります。また、反結合性軌道の一つにLUMOがあります。結合性軌道や反結合性軌道はいくつか存在し、その中の一つがHOMOとLUMOだと理解しましょう。
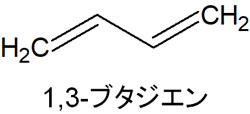
HOMOとLUMOの説明では、1,3-ブタジエンが例として頻繁に利用されます。1,3-ブタジエンは2つの二重結合があり、以下がブタジエンの構造です。
二重結合が一つある場合、1つのπ結合を有していることになります。1つのπ結合は結合性軌道と反結合性軌道の1つずつを生み出します。
そうしたとき、ブタジエンには2つのπ結合(二重結合)があります。これらは共役構造のため、結合性軌道と反結合性軌道をそれぞれ2つずつ有することを意味します。節の数が多くなるほど化合物は不安定になります。そのためエネルギー順に並べると、ブタジエンは以下のような軌道に分けることができます。
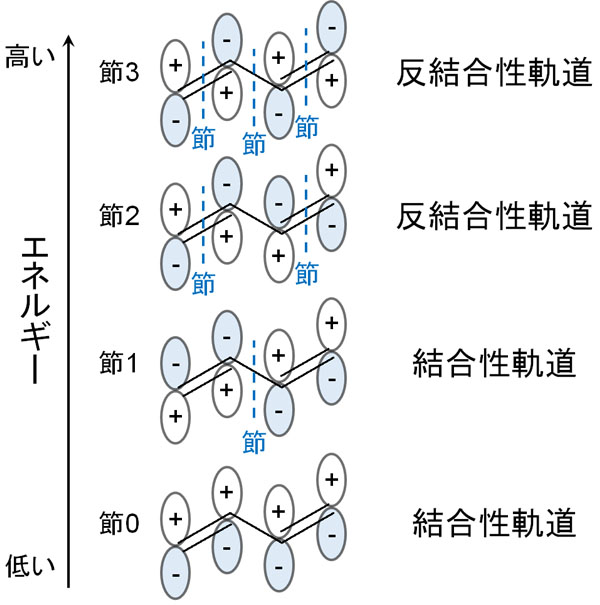
1つのπ結合は2つの電子をもっています。p軌道には、電子が2つ入るからです。
ブタジエンには、2つのπ結合があります。つまり、ブタジエンにある2つのπ結合は4つの電子を有していることが分かります。そこでエネルギー順に電子を入れると、以下のようになります。
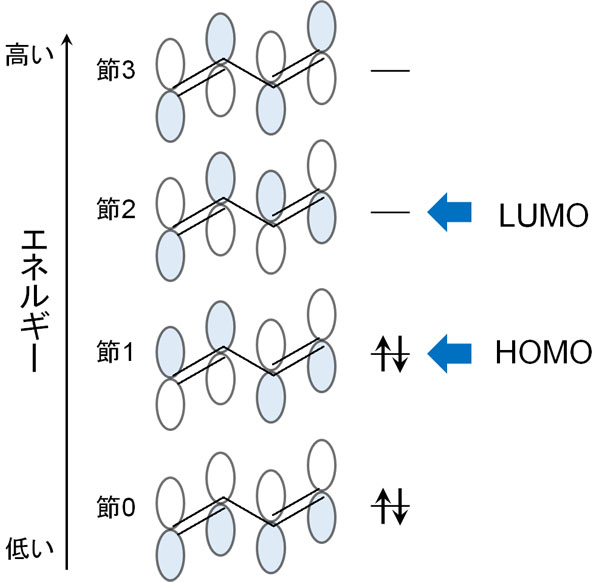
電子が入っている軌道が結合性軌道です。これら結合性軌道の中で、最もエネルギーの高い軌道がHOMOです。これが、最高被占軌道(Highest Occupied Molecular Orbital)の意味です。
一方で電子が入っていない軌道は反結合性軌道です。これら反結合性軌道の中でも、最もエネルギーの低い軌道がLUMOです。これが、最低空軌道は(Lowest Unoccupied Molecular Orbital)の意味です。
共役のHOMO-LUMOギャップでスペクトルが変わる
ブタジエンでは、二重結合を2つもちます。それでは、こうした共役構造が増えていくとどうなるのでしょうか。その場合、HOMOとLUMOの間にあるエネルギーギャップは小さくなります。
二重結合が一つだけだと、結合性軌道と反結合性軌道は1つずつ存在します。ただ共役構造をもつブタジエンでは、結合性軌道と反結合性軌道が2つずつあります。このとき二重結合がさらに増え、共役構造が伸びていけばどうでしょうか。それに伴い、結合性軌道と反結合性軌道の数は多くなります。
共役構造が増えると、それに応じてHOMO-LUMOギャップは小さくなります。
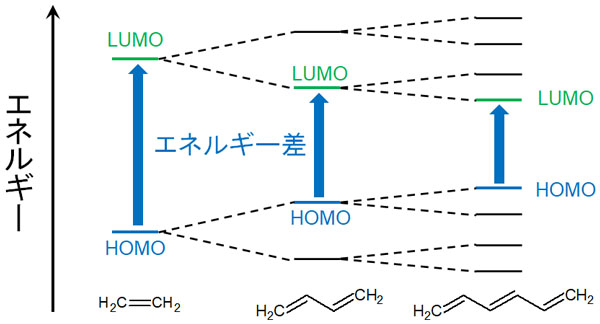
こうした共役構造を有する化合物では、色を吸収しやすいです。共役構造が増えるとHOMOとLUMOのエネルギー差は小さくなり、少しエネルギーを与えるだけで電子は不安定な状態に陥ります。
共役構造が増えるほど、化合物を溶液に溶かしたとき、吸収スペクトル(光を吸収する波長)は長波長へシフトすることが知られています。長波長になるほど、光のエネルギーは弱いです。そのため、以下のようになります。
- 共役構造が増える
- HOMO-LUMOギャップが小さくなる
- わずかなエネルギーを加えるだけで不安定になる
- 長波長(低エネルギー)の光を吸収する
共役が増えるとHOMOは高くなり、LUMOは低くなります。その結果、長波長(低エネルギー)の光を吸収しやすくなるのです。
なお、HOMOとLUMOの差がなくなるとどうなるのでしょうか。この場合、金属のような状態になります。金属ではHOMOとLUMOのエネルギー差がなく、電子は自由に金属を移動できます。
共有結合での電子軌道には種類がある
原子が結合することで分子となります。これら分子には電子が存在し、電子は動くようになります。ただ電子は自由に動けるわけではなく、規則に従って動きます。
そうしたとき、電子の状態や結合の様子を知るためのツールに結合性軌道や反結合性軌道があります。また結合性軌道と反結合性軌道の中には、HOMOとLUMOがあります。量子力学の波動関数では、電子を波として取り扱います。そうすると、HOMOとLUMOについて違いを理解できるようになります。
物理化学や有機化学を学ぶとき、最初に学ぶ内容の一つが結合性軌道と反結合性軌道です。しかし、これらの違いやエネルギーの意味、見分け方は分かりにくいです。
そうはいっても、電子が波であることを認識し、互いに重なったり打ち消し合ったりすることさえ理解すれば、HOMOとLUMOの概念が分かるようになります。電子の状態を知ることは化合物の反応を学ぶために重要です。電子軌道がどうなっているのか、最初に理解するようにしましょう。






