ケトンやアルデヒドを官能基としてもつ化合物は多いです。カルボニル基やホルミル基とも呼ばれますが、多くの種類の化学反応を起こすため、非常に重要な官能基でもあります。
ケトンやアルデヒドは反応性が高いため、何も対策をしていないと、カルボニル炭素が求核攻撃を受けることで合成反応が進行してしまいます。そのため、カルボニル基やホルミル基が反応しないように保護しなければいけません。これを保護基といいます。
カルボニル化合物の保護基としてアセタールが頻繁に利用されます。カルボニル化合物はヘミアセタールを経由して、アセタールを合成できます。
なぜ、これらの保護基が有用なのでしょうか。また反応機構や脱保護の方法はどうなっているのでしょうか。これらを解説していきます。
もくじ
ケトンやアルデヒドは水和し、ヘミアセタールを生じる
化合物によっては、化合物単体で存在しているときと、溶液中に溶けているときで形が異なるケースがあります。この代表例としてカルボニル基やホルミル基を有する化合物があります。
ケトンやアルデヒドを官能基としてもつ化合物では、水やアルコールの溶媒に溶けている場合、異なる形をしています。これは水和といわれます。特にアルデヒドであれば、水和反応によってほとんどの化合物が形を変えています。
このようにケトンやアルデヒドが水和反応し、結果として生成する化合物がヘミアセタールです。ヘミアセタールの反応機構は以下のようになります。
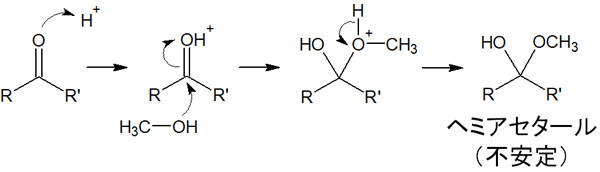
上図は酸性条件での反応機構です。ただ酸性だけなく、塩基性であってもヘミアセタールが生成されます。ケトンやアルデヒドでは、あらゆるケースでヘミアセタールとなります。
ヘミアセタールは不安定であり、水和物は可逆反応となる
ただ、有機化学の実験をするときにヘミアセタールを単離できることはありません。カルボニル基やホルミル基をもつ化合物を溶かすと水和反応するのは間違いありません。しかし、ヘミアセタールは不安定であるため、水分やアルコールを除去すると、元のケトンやアルデヒドの化合物に戻ります。
これは、水和物は可逆反応だからです。水和反応によってヘミアセタールが生成したとしても、水やアルコールが存在しなくなると、逆反応を起こします。
水和物が元のカルボニル化合物に戻るときの反応機構は以下のようになります。
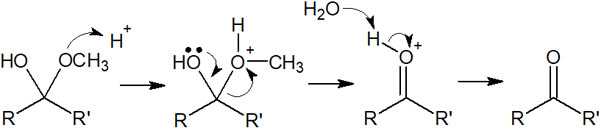
水溶液中ではヘミアセタールになっていたとしても、溶媒を除去するとヘミアセタールの化合物を得られないのは、こうした可逆反応によって元通りになるからです。
ヘミアセタールからアセタールの合成が可能
なお、酸性条件で合成反応させると、ヘミアセタールからさらに反応が進み、アセタールを得ることができます。中性や塩基性の条件では、アセタールが合成されることはありません。酸性条件のみ、アセタールを得られます。
酸性条件で反応させると、ヘミアセタールは以下のような反応機構によってアセタールになります。
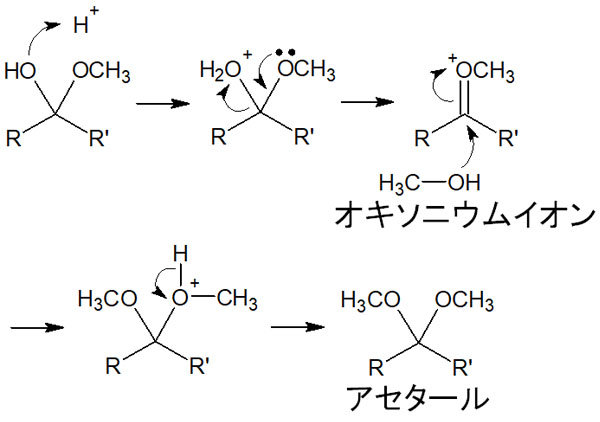
この反応で重要なのは、反応によって水(H2O)を生じることです。最初、酸素原子がプロトンと結合することでH2Oが離脱します。その結果、オキソニウムイオンが形成されます。
溶液中にプロトン(H+)が存在しなければ、アセタールの合成反応は進みません。これが、中性や塩基性ではアセタールを得られない理由です。
なおオキソニウムイオンは不安定な中間体です。そのためアルコールが攻撃することでさらに反応が進み、アセタールが生成されます。ヘミアセタールとは異なり、アセタールは安定な物質なので単離することができます。
水を除去しながら合成反応を進める
ヘミアセタールが可逆反応なのと同じように、アセタールも可逆反応です。水和反応で合成されたアセタールに水を加えると、ケトンやアルデヒドへと戻ります。
ただ先ほどの反応機構で述べた通り、ヘミアセタールからアセタールを合成するとき、水が生成されます。水が存在すると可逆反応が起こり、アセタールが加水分解されて元通りになります。そこでアセタール合成をするとき、生成される水を除去しながら合成反応を進めなければいけません。
・加水分解は酸性条件であり、塩基性条件でアセタールは安定
なお、アセタールが加水分解することで、元のカルボニル化合物へ戻るときの反応条件は酸性です。酸性でなければ、アセタールの加水分解は起こりません。
塩基性条件では、アセタールは安定です。アセタールは酸によって加水分解されるものの、塩基には安定だと理解しましょう。
保護基で重要なアセタールの利用
それでは、なぜアセタール化が有機化学で重要なのでしょうか。それは、アセタールはケトンやアルデヒドの保護基として頻繁に利用されるからです。
カルボニル基やホルミル基は反応性が高いです。カルボニル炭素が求核攻撃を受けることで、容易に求核付加反応が進行してしまいます。例えば、塩基性の非常に強い化合物にグリニャール試薬があります。ただ分子内にケトンがあると、以下のように分子内で反応してしまいます。
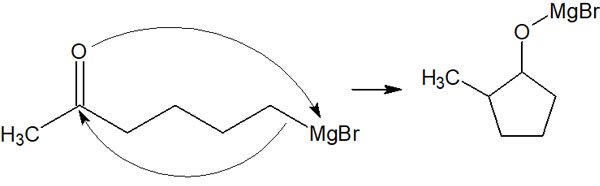
そこで、事前にアセタール保護しておきます。ケトンをアセタールにしておけば、マグネシウム(Mg)を加えてグリニャール試薬を作ったとしても、分子内反応を起こすことはありません。
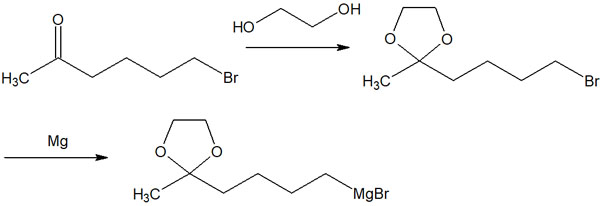
前述の取り、アセタールは塩基性条件で安定です。グリニャール試薬は強塩基であるため、アセタールと反応することはありません。このような保護基を利用することで、位置選択的な有機合成が可能になります。
・環状アセタールは鎖状アセタールより安定で頻用される
参考までに、鎖状アセタールよりも環状アセタールのほうが安定です。そのため、エチレングリコールによってアセタール保護することがよくあります。
エチレングリコールを利用すると、5員環の環状アセタールが生成されます。この化合物をジオキソラン(dioxolane)といいます。
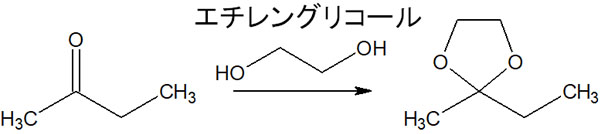
エチレングリコールは安く手にできる有機化合物の一つです。そこでカルボニル化合物をアセタール保護すれば、塩基性物質による求核攻撃から保護することができます。
加水分解で脱保護し、目的化合物を得る
なお、当然ですがアセタールによる保護基はどこかの時点で取り去ることになります。保護基を取るため、これを脱保護といいます。
脱保護の方法は簡単です。塩酸や硫酸などの酸性溶液と混ぜるだけです。これらの酸触媒を加えるだけで加水分解が進行し、容易にケトンまたはアルデヒドへ戻すことができます。
なお、アセタール保護している状態からカルボニル化合物へ加水分解される反応機構については、既に説明しているので省きます。ヘミアセタールが加水分解によってケトンまたはアルデヒドになる反応機構を前に記しており、これと同じように反応してカルボニル化合物を得られます。
容易にカルボニル基やホルミル基を保護することができ、脱保護の方法も簡単であることから、有機化学ではアセタール保護が頻繁に利用されます。
アルコール保護など、アセタールによる保護基の応用例は多い
なお、こうした保護基は多くの場面で利用頻度が高いです。アセタール保護を利用した保護基としては、カルボニル化合物だけでなく、ヒドロキシ基(-OH)の保護でも利用されます。
例えば、1,3ジオールの化合物があるとします。1,3ジオールとカルボニル化合物を反応させることで、環状アセタールを合成できます。これにより、1,3ジオールの部分の保護基になります。
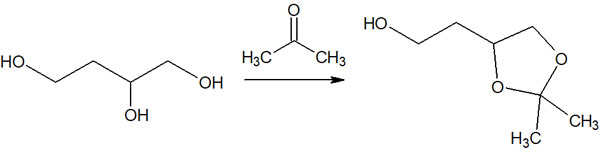
・THP基やMOM基によるアルコール保護
一方で1,3ジオールだけでなく、一つのヒドロキシ基を保護することもできます。こうした保護基としては例えば以下があります。
- THP基(テトラヒドロピラニル基)
- MOM基(モノメトキシメチル基)
THP基を作るとき、DHP(ジヒドロピラン)を試薬として利用します。一方でMOM基では、クロロメチルメチルエーテルを試薬で利用します。以下のようになります。
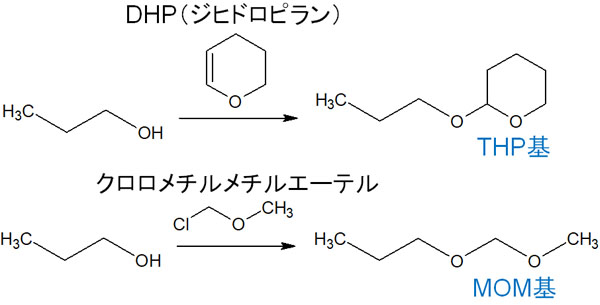
重要なのは、THPとMOMの両方ともアセタールになっていることです。カルボニル化合物でのアセタール保護について説明しましたが、このようにTHP基やMOM基を利用することで、アルコールをアセタール保護することもできます。
アセタールは塩基性で安定なため、アルコールを保護した後に塩基性条件で反応させれば副反応は起こりません。アセタール保護はカルボニル基やホルミル基だけでなく、ヒドロキシ基でも広く利用されています。
保護基で重要なアセタールの性質を学ぶ
カルボニル化合物は非常に多くの種類の合成反応を起こします。その中でも重要な反応の一つが水和です。水やアルコールと反応することで、ヘミアセタールを生じるのがカルボニル化合物です。また、酸性条件下であればアセタールを得ることができます。
なぜ、アセタール合成が重要なのかというと、保護基になるからです。特定の場所だけ位置選択的に反応させたい場合、保護基は非常に有効です。
またカルボニル基やホルミル基だけでなく、アルコールの保護基としてもアセタールは有効です。あらゆる場面でアセタール保護は有益です。
酸性条件下であれば脱保護も容易であるため、保護基として頻繁に利用されるのがアセタールです。そこで、これらアセタールの性質を理解しておくようにしましょう。






