官能基の形を変えることで、あなたが望む置換基に変換することは有機化学で重要です。合成反応させるとき、あなたが望む官能基をもつ化合物を合成しなければいけません。
そうした合成反応の一つに還元があります。還元反応の中でも、カルボニル化合物の還元反応は重要な合成反応です。C=Oの構造を有する官能基は多く、どのような官能基をもつカルボニル化合物を還元できるのか学ばなければいけません。
また位置選択性も重要です。一つの化合物でいくつもの官能基をもつのは普通であり、特定の官能基だけを還元する必要があります。
利用する試薬によって、還元するときの様子が異なります。そこでカルボニル基の還元をするとき、どのように考えればいいのか解説していきます。
もくじ
ヒドリド還元剤によるカルボニル還元
C=Oの構造を有する化合物はたくさんあります。C=Oの官能基をもつ分子はカルボニル化合物と呼ばれます。カルボニル化合物には、例えば以下があります。
- アルデヒド(ホルミル基)
- ケトン(カルボニル基)
- エステル
- アミド
- カルボン酸
これらの化合物を還元するとき、ヒドリド還元剤が頻繁に用いられます。
ヒドリド(H–)を与える還元剤をヒドリド還元剤といいます。カルボニル化合物にヒドリド還元剤を混ぜることで、C=Oが還元されます。その結果、官能基の形が変化します。
NaBH4とLiAlH4で異なるカルボニル化合物の還元
ヒドリド還元剤にはいくつか種類があります。具体的には、以下の種類の還元剤がカルボニル還元で利用されます。
- 水素化ホウ素ナトリウム(NaBH4)
- 水酸化ホウ素リチウム(LiBH4)
- 水素化アルミニウムリチウム(LiAlH4)
- ボラン(BH3)
これらの還元剤を利用します。特にヒドリド還元剤で重要になるのが水素化ホウ素ナトリウム(NaBH4)と水素化アルミニウムリチウム(LiAlH4)です。
水素化アルミニウムリチウム(LiAlH4)は反応性が高く、ほとんどのカルボニル化合物を還元します。また反応性の高さから、水と触れると発火します。一方の水素化ホウ素ナトリウム(NaBH4)では、緩和な条件で合成反応を進めることができます。
水素化ホウ素ナトリウム(NaBH4)と水素化アルミニウムリチウム(LiAlH4)では、還元できる官能基が異なります。水素化ホウ素ナトリウムの場合、アルデヒド(ホルミル基)とケトン(カルボニル基)の還元が可能です。

一方の水素化アルミニウムリチウムでは、ほとんどのカルボニル化合物を還元できます。そのため還元したい化合物によって、ヒドリド還元剤を使い分ける必要があります。
・より詳しいヒドリド還元剤による官能基選択性と違い
重要なのは、ヒドリド還元剤によって還元できる官能基が異なることです。この違いを利用すれば、位置選択的に特定の官能基だけを還元できます。
例えば、分子内にケトンとカルボン酸を有する化合物があるとします。この化合物に水素化ホウ素ナトリウム(NaBH4)を加えると、ケトンだけ還元されます。水素化ホウ素ナトリウムはカルボン酸を還元しないからです。
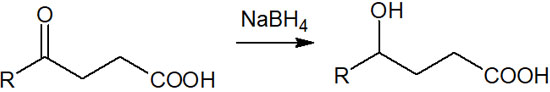
このようにして、位置選択的に分子を還元できます。
なお、先ほどは水素化ホウ素ナトリウムと水素化アルミニウムリチウムの還元についてのみ確認しました。ただ重要なヒドリド還元剤は他にも存在します。そうしたとき、ヒドリド還元剤の官能基選択性は以下のようになっています。
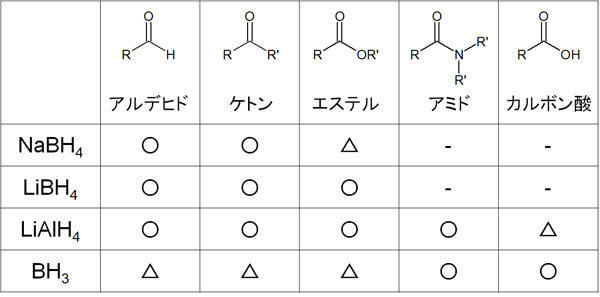
還元できる官能基の違いを利用することで、目的とする部分だけを還元し、あなたが望む化合物を得られるようになります。
ヒドリド移動が反応機構で重要
ヒドリド還元剤を利用するとき、重要になる反応機構がヒドリド移動です。H–がヒドリドであり、ヒドリドが求核攻撃することで、カルボニル化合物が還元されます。ヒドリド移動を引き起こす試薬がヒドリド還元剤です。
それでは、どのようにヒドリド移動が起こるのでしょうか。例として、水素化ホウ素ナトリウム(NaBH4)をエタノール溶媒中でカルボニル化合物と反応させるときの反応機構を記します。
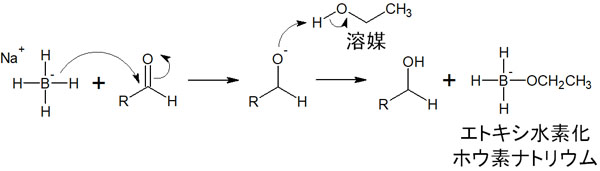
ヒドリド還元剤を加えると、ヒドリド移動によってH–がカルボニル炭素を求核攻撃します。それと同時に、C=Oの二重結合を作っている電子は酸素原子に移動します。その後、マイナスの電荷を有する酸素原子はエタノールの水素原子を奪います。その結果、化合物はアルコール(ヒドロキシ基:-OH)へと還元されます。
エタノールは水素原子がなくなるため、エトキシドが生成されます。その後、エトキシドはヒドリドを放出した水素化ホウ素ナトリウムと反応し、エトキシ水素化ホウ素ナトリウムとなります。
エトキシ水素化ホウ素ナトリウムは水素化ホウ素ナトリウム(NaBH4)と同様に、カルボニル化合物を還元する能力があります。エトキシ水素化ホウ素ナトリウムには3つの水素原子が結合しているため、あと3回はカルボニル化合物を還元させることができます。
カルボニル化合物のさまざまな還元方法
それでは、どのようにカルボニル化合物を還元すればいいのでしょうか。前述の通り、カルボニル化合物の種類は多いです。それぞれの官能基について、最適なヒドリド還元剤を選ばなければいけません。
ヒドリド還元剤の利用では、反応させたい官能基によって試薬を使い分ける必要があります。具体的には、以下のように考えましょう。
- ケトンまたはアルデヒドをアルコールに還元:NaBH4を利用
- エステルからアルコールに還元:LiBH4を利用
- アミドからアミンに還元:LiAlH4を利用
- カルボン酸をアルコールに還元:BH3を利用
- エステルをアルデヒドへ還元:DIBAL-Hを利用
- アミドをアルデヒドへ還元:LiAlH4を利用(低温:0℃)
実際の有機合成では、官能基ごとの還元方法を理解しなければいけません。そこで、官能基別の還元方法を確認していきます。
ケトンやアルデヒドをアルコールに変換する
分子内にケトン(カルボニル基)やアルデヒド(ホルミル基)を有する化合物の場合、ヒドリド還元剤を利用することでアルコールに変換することができます。
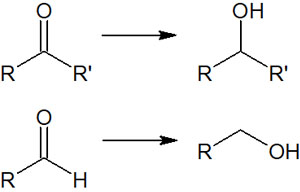
アルコールを酸化することで、ケトンやアルデヒドを合成できることが知られています。つまり還元剤を利用すれば、反対にケトンやアルデヒドからアルコールに変換できます。
ケトンやアルデヒドの還元反応で最も利用される試薬は水素化ホウ素ナトリウム(NaBH4)です。水素化アルミニウムリチウム(LiAlH4)でも還元できますが、前述の通りLiAH4は水などと反応することで発火します。また、他の官能基と反応することで副生成物を生じます。
そのため、ケトンやアルデヒドを選択的に還元したい場合はNaBH4を利用します。反応機構は以下の通りです。
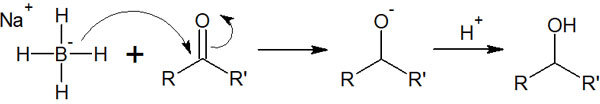
先ほど、ヒドリド還元剤を用いた反応機構を記しました。まったく同じ反応機構にて、ヒドリド還元が行われます。
エステルからアルコールの還元で水酸化ホウ素リチウムを使う
一方で、エステルからアルコールへ還元するときはどのようにすればいいのでしょうか。ケトンやアルデヒドであれば、水素化ホウ素ナトリウム(NaBH4)が素早く化合物を還元します。しかし、エステルとは反応がほぼ進行しません。
そこで、エステルの還元反応では水酸化ホウ素リチウム(LiBH4)が利用されます。強力な還元作用により、エステルであっても容易にアルコールへと還元できるようになっています。
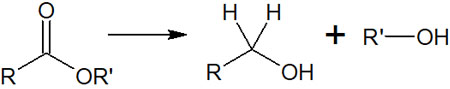
ヒドリド還元剤によってエステルが還元されるとき、先ほどとは少し複雑な反応機構になります。以下の通りです。
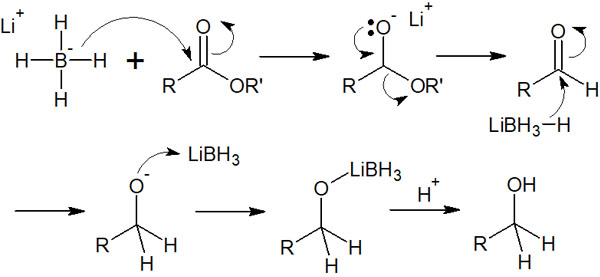
ヒドリド移動によって求核攻撃が起こった後、エステルが脱離します。その結果、アルデヒドが生成されます。
ただ溶液中にヒドリド還元剤が存在する場合、アルデヒドは還元されてアルコールになります。そのため、LiBH4によってエステルは最終的にアルコールになります。-COORの構造を還元することで、-CH2OHに変換できます。
なお、水素化アルミニウムリチウム(LiAlH4)でもエステルを還元できますが、前述の通り水と反応して爆発し、火災事故を起こす危険性があります。一方で、水酸化ホウ素リチウム(LiBH4)は緩和な条件で反応が進行するため、LiAlH4に比べて火災事故の心配は少ないです。
アミドからアミンへの合成方法は水素化アルミニウムリチウム
カルボニル化合物として、安定した構造をもつ分子がアミドです。構造が安定というのは、反応しにくいことを意味しています。そのためアミドの還元では、強力なヒドリド還元剤である水素化アルミニウムリチウム(LiAlH4)を利用します。
アミドを還元することで、アミンを合成することが可能です。アミドの還元では、それぞれの構造を以下のように変換できます。
- -CO-NH2 → -CH2-NH2
- -CO-NRH → -CH2-NRH
- -CO-NR2 → -CH2-NR2
反応機構はエステルと似ています。ただエステルとは異なり、中間体としてイミニウムイオンが生成されます。エステルではヒドリド還元剤によって、途中にアルデヒドが生成されることを記しました。一方でアミドの場合、中間体がイミニウムイオンになります。
アミドに対するヒドリド還元の反応機構は以下の通りです。
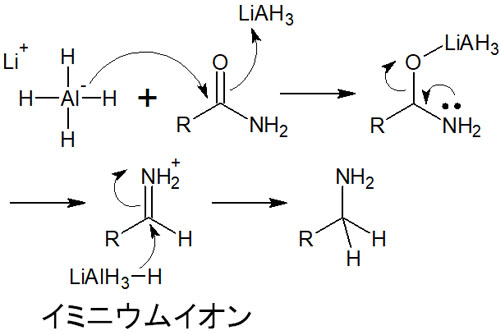
イミニウムイオンに対して求核攻撃が起こることで、再びヒドリド移動が発生します。その結果、アミンを得られます。
カルボン酸をボランでアルコールに変える
一方でカルボン酸はどのように還元されるのでしょうか。水素化アルミニウムリチウム(LiAlH4)は反応性の高いヒドリド還元剤です。しかし、カルボン酸へLiAlH4を加えたとしても反応はほぼ進行しません。長時間・高温条件にて反応させることで、ようやくカルボン酸の反応が進みます。
なぜ、カルボン酸ではLiAlH4の反応性が悪いのでしょうか。LiAlH4は塩基でもあり、酸・塩基反応によってカルボン酸のH+が引き抜かれます。この状態でヒドリド還元による反応が進行すると、ジアニオンが中間体として生成されます。
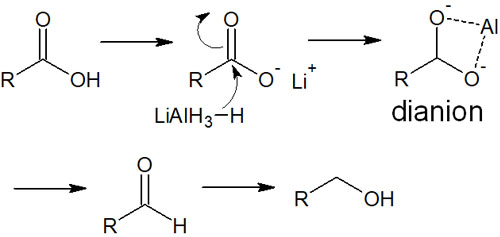
ジアニオンでは、2つの酸素原子がAl+と配位します。そのため還元反応が起こりにくくなっています。これらの理由からカルボン酸の還元では、通常は他の試薬が利用されます。具体的には、ボラン(BH3)を還元剤として使います。
ボランには空のp軌道があり、ルイス酸として機能することが知られています。そのため、カルボン酸の酸素原子に存在する非共有電子対がボランを攻撃し、ホウ素原子と結合します。その後、ホウ素と結合した酸素原子が脱離します。
こうして還元反応が進行します。反応機構は以下になります。
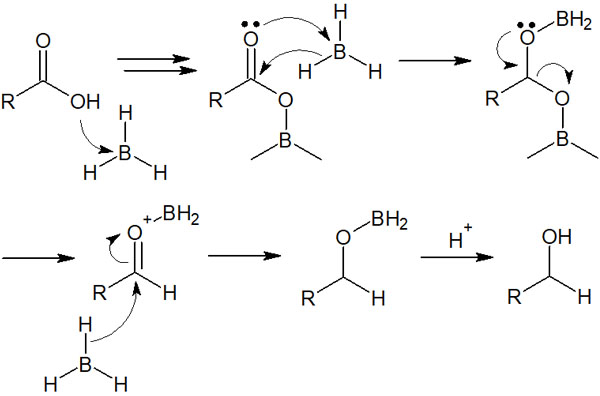
ルイス酸であるボランは3量体を形成するため、本当はより複雑な反応機構です。ただ分かりやすさを優先するため、1つの分子同士が反応すると仮定して、簡単な方法での反応機構を記しています。
ボランはアミドやカルボン酸を素早く還元できます。一方、アルデヒドやケトン、エステルとはほぼ反応しません。そのため、官能基選択性に優れています。
エステルからDIBAL-Hでアルデヒドへ還元する
ここまで、還元によってアルコールを合成する反応をみてきました。そうしたとき、エステルの還元では中間体としてアルデヒドが生成されます。反応をアルデヒドで止めることで、アルデヒド化合物を得ることは可能なのでしょうか。
これまで説明してきたヒドリド還元剤では、アルデヒドで反応を止めるのは不可能です。アルコールを合成後、酸化反応によってアルデヒドを得るようにするのが一般的です。ただ試薬によっては、エステルからアルデヒドを直接合成できます。
このような試薬として水素化ジイソブチルアルミニウム(DIBAL-H)があります。-70℃でエステルと反応させることで、DIBAL-Hは安定な四面体中間体となります。
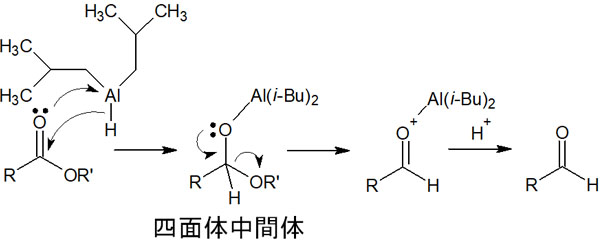
その後、水を加えることで化合物が分解し、アルデヒドを得ることができます。なお、DIBAL-Hの反応機構はボランと似ています。
アミドを低温条件でLiAlH4と反応させ、アルデヒドを得る
ヒドリド還元によってアルデヒドを合成する手法としては、他にも存在します。その一つがアミドを低温条件(0℃)にて、水素化アルミニウムリチウム(LiAlH4)と反応させる方法です。
LiAlH4によるアミドの還元で説明した通り、中間体としてイミニウムイオンが生成されます。重要なのは、低温条件でアミドとLiAlH4を反応させると、合成反応はアミンまで進行せず、イミニウムイオンの生成で止まるという事実です。
イミニウムイオンに対して水を加えると、加水分解されます。イミニウムイオンの加水分解は以下のような反応機構になります。
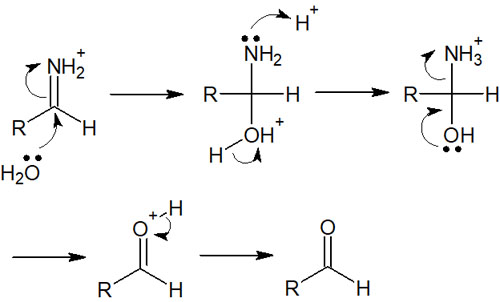
このように0℃で反応させた後、イミンの加水分解と同じ反応機構によって、イミニウムイオンはアルデヒドになります。
ヒドリド還元剤の違いや強さ、官能基選択性
どのように化合物を還元するのかは有機化学で重要になるポイントの一つです。化合物を還元するとき、重要になるのがカルボニル化合物です。ケトンやアルデヒド、エステルなどカルボニル化合物は種類が多く、それぞれの官能基に応じたヒドリド還元剤を利用しなければいけません。
ヒドリド還元剤の多くは金属を含み、それぞれ還元力の強さに違いがあります。また還元できる官能基の種類やスピードにも違いがあります。
利用する還元剤を選ぶことで、特定の官能基だけを選択的に還元できるようになります。代表的なヒドリド還元剤を反応機構と共に掲載したため、どのような還元剤を利用すればいいのか理解するようにしましょう。
カルボニル還元では、選択肢となるヒドリド還元剤の種類は多いです。また反応機構も違います。そのため内容は複雑になりやすいですが、重要な有機反応なので事前に学んでおくのは必須です。






