分子に炭素鎖を導入することは、有機化学で化合物合成をするときに非常に重要です。こうした合成反応の一つにWittig反応(ウィッティヒ反応)があります。
Wittig反応では、カルボニル基(ケトン)またはホルミル基(アルデヒド)をアルケンに変えることができます。つまりC=OをC=Cへと変換できます。炭素鎖を作る合成反応では、頻繁に利用される合成反応がWittig反応です。
それでは、どのようにしてカルボニル化合物から二重結合への合成を行うことができるのでしょうか。アルケンを作るとき、EZ選択性はどうなるのでしょうか。
反応条件や反応機構を理解しなければ、目的化合物を得られません。そこで、どのようにWittig反応を利用すればいいのか解説していきます。
もくじ
アルケン合成反応で最も重要なWittig反応(ウィッティヒ反応)
二重結合を作る方法としては、有名な合成反応がE2反応(脱離反応)です。ただE2反応は強塩基や高温条件下で反応させるなど、反応条件が過激です。またEZ異性体(シス・トランス)の問題が存在します。
それだけでなく、E2反応では求核置換反応が起こる可能性があり、結果として副生成物が生まれます。
それに対して、Wittig反応ではC=Oに対して選択的に反応して二重結合を合成できます。また反応条件は緩和であり、EZ異性体の制御も可能です。そのためアルケン合成で最も重要な合成反応がWittig反応(ウィッティヒ反応)です。
二重結合をもつ炭素鎖を合成したい場合、真っ先に考えるべきなのがWittig反応です。
ケトンやアルデヒドからアルケンを合成できる
カルボニル化合物には種類があります。その中でも、カルボニル基(ケトン)とホルミル基(アルデヒド)を有する分子でWittig反応が可能です。
Wittig反応では有機リン化合物を利用します。Wittig反応で利用する有機リン化合物をホスホニウムイリド(Wittig試薬)といいます。
ホスホニウムイリド(Wittig試薬)はトリフェニルホスフィンとハロゲン化アルキルを反応させた後、塩基性条件で処理することで合成できます。Wittig試薬を合成するときの反応機構は以下の通りです。
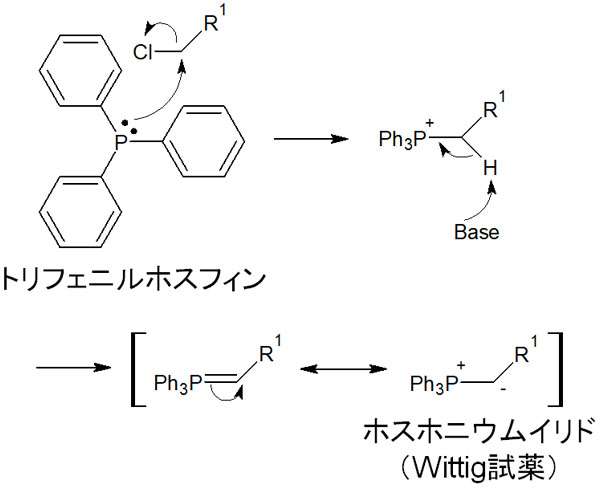
ホスホニウムイリド(Wittig試薬)を利用すれば、ケトンまたはアルデヒドを以下のように反応させ、アルケンを得ることができます。
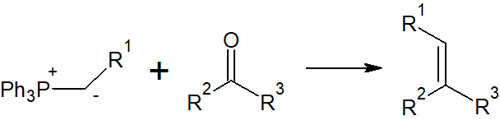
ホスホニウムイリドという特殊な試薬を用いることになるものの、これによってアルケンの合成が可能になります。
なお、Wittig反応(ウィッティヒ反応)はゲオルク・ウィッティヒによって発見された合成手法です。彼は有機リンを用いた有機合成の研究によって、1979年にノーベル化学賞を受賞しています。
反応機構はリンイリドの求核付加
それでは、Wittig反応の反応機構はどのようになっているのでしょうか。Wittig反応では、Wittig試薬というリンイリドを利用します。リンイリドはカルボニル炭素に対して、求核付加による攻撃をします。
反応機構は以下のようになります。
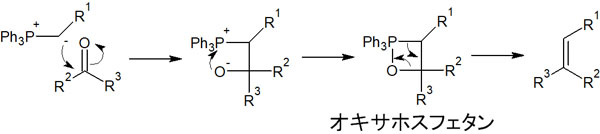
リンイリドが求核攻撃した後、マイナスの電荷を有する酸素原子はリン原子を攻撃します。その結果、四員環の中間体が生成されます。この中間体をオキサホスフェタン(oxaphosphetane)といいます。
オキサホスフェタン中間体は非常に不安定な化合物です。そのためオキサホスフェタン中間体が合成された後、脱離反応が起こることによって アルケンを得られます。
重要なポイントとしては、P=O結合が非常に強いという事実です。オキサホスフェタン中間体が生成された後、アルケンが合成されるのは、P=O結合が作られるように脱離反応が進行するからです。
Wittig試薬のイリドとは何か?安定イリドと不安定イリド
なおWittig反応では、Wittig試薬という特殊な試薬を使います。当然、どのようなホスホニウムイリド(Wittig試薬)を利用するのかによって、得られる化合物が異なります。
そうしたとき、イリドとは何なのでしょうか。イリドとは、マイナスの電荷をもつ炭素原子と、プラスの電荷をもつヘテロ原子(炭素または水素以外の原子)が隣り合って存在している分子を指します。イリドの中でも、最も頻繁に利用されるのがリンイリドです。
ホスホニウムイリド(Wittig試薬)はリンイリドの一種です。
・安定イリドと不安定イリド
なおWittig試薬を作るとき、安定イリドと不安定イリドについて理解しなければいけません。リンイリドは安定イリドと不安定イリドの2種類が存在します。安定イリドでは、その名の通り安定状態のイリドです。一方の不安定イリドだと、不安定な状態で存在しています。
どのようなとき、安定イリドになるのでしょうか。それは、マイナスの電荷を有する炭素原子の隣に電子吸引基が存在するときです。電子吸引基としては、例えば以下の官能基が知られています。
- ニトロ基(-NO2)
- シアノ基(-CN)
- カルボニル基(-CO)
- スルホン基(-SO3H)
なぜ、これらの官能基が存在すると安定イリドになるのでしょうか。それは、以下のような共鳴構造式を書けるからです。
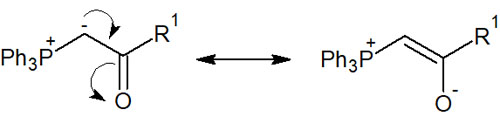
安定イリドは単離することができます。電子吸引基が存在することで、非常に安定な状態の化合物としてWittig試薬を作れます。
一方の不安定イリドでは、安定イリドのような電子吸引基が存在しません。この場合は水や空気と触れることで分解するため、単離するのは不可能です。
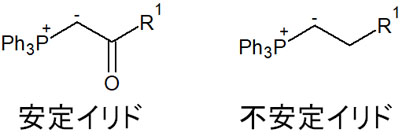
安定イリドは単離可能であることから、イリドとしては反応性が悪いです。それに対して、不安定イリドは単離できないものの、イリドとしての反応性は優れています。いずれにしても、このように安定イリドと不安定イリドが存在することを理解しましょう。
シス・トランス(EZ化合物)の立体化学制御が可能
それでは、なぜ安定イリドと不安定イリドを理解することが重要なのでしょうか。それは、立体化学の制御が可能だからです。
アルケンを合成するとき、必ず問題になるのか幾何異性体です。シス・トランスの問題が生じるのです。そこでEZ異性体のうち、E体またはZ体のどちらかを選択的に得られるように合成しなければいけません。
Wittig反応(ウィッティヒ反応)では、利用するホスホニウムイリドが安定イリドなのか不安定イリドなのかによって、合成される化合物がE体なのかZ体なのかが変わります。具体的には、Wittig試薬によって以下の違いがあります。
- 安定イリド:生成化合物はE体(トランス)
- 不安定イリド:生成化合物はZ体(シス)
一般的なアルケン生成では、EZ異性体を明確に区別して合成するのが困難です。それに対してWittig反応では、これらを区別して合成できます。
EZ異性体を区別して合成できる理由
なぜ、イリドの安定性によってEZ異性体の合成を分けることができるのでしょうか。この理由については、立体障害や可逆反応の違いになどによって説明されています。
安定イリドでは、リン原子がカルボニル炭素を攻撃してオキサホスフェタンを形成する反応が可逆反応です。そのため中間体の安定性を考えたとき、シス体(Z体)では立体障害が起こります。トランス体(E体)のほうが、大きな置換基が反対側に存在するため、安定イリドではE選択的に合成反応が進行します。
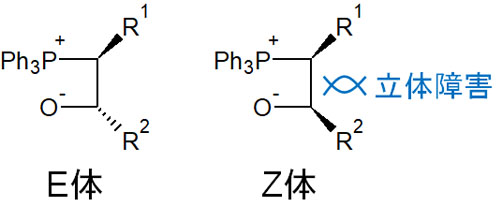
一方、不安定イリドがカルボニル炭素を攻撃するとき、生成されるオキサホスフェタンは不可逆反応です。そのためオキサホスフェタンを生成後、可逆反応によって立体障害が少ない配置(トランス)に変換されるわけではありません。
最初に生成したオキサホスフェタンのまま、合成反応が進行します。そうしたとき、最も立体障害が小さい状態で反応するためには、下図のような四員環の中間体を経る必要があります。
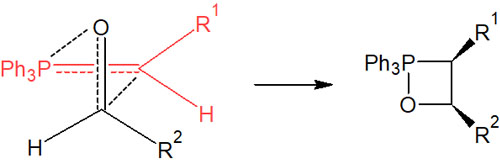
このように、立体障害が少なくなるようにオキサホスフェタンが合成される場合、Z異性体(シス)の中間体を得られます。安定イリドのように、中間体を形成後にE異性体(トランス)へ変換されることはありません。
オキサホスフェタン中間体がシン体になるのかアンチ体になるのかは、可逆反応なのか不可逆反応なのかによって違いが説明されています。
ホーナー・ワズワース・エモンズ反応の応用例
Wittig反応によって二重結合を作る反応は非常に有益であり、多くの応用例が存在します。その中でも、Wittig反応を発展させた合成反応としてホーナー・ワズワース・エモンズ反応(Horner-Wadsworth-Emmons reaction)が知られています。
有機リン化合物として、リン酸エステルを試薬に用いる合成反応がホーナー・ワズワース・エモンズ反応です。
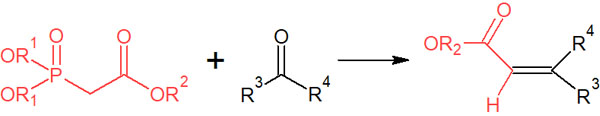
またエステルだけでなく、アミンやエーテル、アリルなど他の官能基でも利用できます。そのため、有用性の高い合成反応です。
ホーナー・ワズワース・エモンズ反応では、E選択的に合成反応が進みます。ただ特殊な試薬を用いると、Z選択的になることが知られています。重要なのは、ホーナー・ワズワース・エモンズ反応についてもWittig反応と同様に、シス・トランスの立体化学の制御が可能という事実です。
有機リン化合物を用いたWittig反応の応用例は他にもあるため、これらの合成反応を学ぶことで、さまざまな化合物を合成できるようになります。
アルケン合成で最重要なWittig反応
二重結合を有する化合物の合成を考えるとき、最初に意識するべき反応がWittig反応(ウィッティヒ反応)です。炭素鎖を作る有機化学の反応として、Wittig反応は有益です。
アルケン合成では常に幾何異性体が問題になります。しかしWittig反応では、利用するホスホニウムイリドを変えることで、EZ異性体の選択的な合成が可能です。安定イリドではE体(トランス)となり、不安定イリドではZ体(シス)の化合物を得られます。
またカルボニル基に対して選択的に反応するため、他の合成反応に比べると副生成物が少ないです。Wittig反応の応用例は多く報告されており、さまざまな化合物の合成が可能です。
人名反応の中でも、多くの有機化学者が利用する合成反応の一つがWittig反応です。大学で有機化学を学ぶとき、ほぼ全員がWittig反応を習うため、どのような合成反応なのか理解するようにしましょう。






