分子内に三重結合を有する化合物としてアルキンが知られています。アルカンやアルケンの構造を有する化合物が多いものの、分子内に三重結合をもつこともあるのです。
単結合や二重結合とは異なり、三重結合には特殊な性質があります。例えば「酸性度が高い」などの性質により、他の化合物とは異なる合成反応が可能です。
またアルキンから二重結合を合成することが可能です。付加反応により、アルケンを自由に作れるのです。もちろん、新たなアルキン化合物を合成することも可能です。
それでは三重結合のある化合物は、どのように有機化学反応を起こすのでしょうか。アルキンの付加反応や酸性度、アセチリド合成についてここでは解説していきます。
もくじ
アルキンは求電子付加反応でアルケンを生じる
三重結合をもつ化合物だと、化学反応によって二重結合になることができます。アルキンからアルケンを合成するとき、求電子付加反応が広く利用されます。
アルキンにはπ結合(π電子)があります。共有結合の中でも、比較的弱い力で結合しているのがπ結合です。またπ電子の存在により、アルキンは電子リッチの状態だといえます。そのため、アルキンと求電子試薬と反応することで付加反応が起こるのです。
求電子付加反応ではHX(ハロゲン化水素)が例として頻繁に出されます。例えばアルキンに臭化水素が付加反応することで、以下の化合物が生成されます。
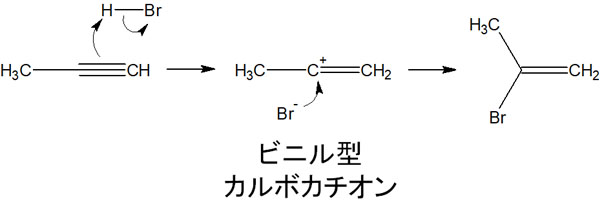
反応機構としては、アルケンへの付加反応と同じです。中間体としてカルボカチオンを生成し、その後にブロモイオンが攻撃することで付加反応が完了します。
ビニル型カルボカチオンの安定性と超共役
なおアルキンが付加反応をするとき、中間体で生成されるのはビニル型カルボカチオンです。一般的なカルボカチオンと比較すると、ビニル型カルボカチオンは安定性が低いです。
カルボカチオンの安定性の順番は以下の通りです。
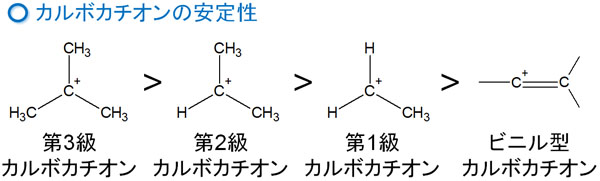
アルケンに比べると、アルキンの付加反応は速度が遅いです。ビニル型カルボカチオンの安定性が低く、中間体を生成しにくいからです。
・超共役による位置選択
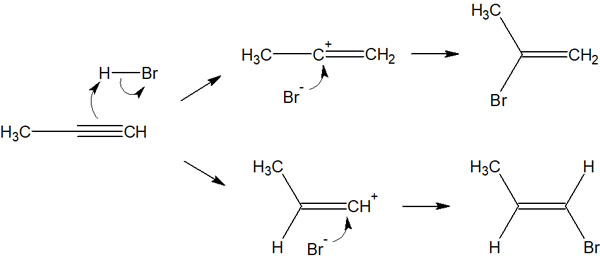
ただ重要なのは、付加反応のときにどこに置換基が結合するのかだといえます。先ほどの化合物であれば、以下の2種類の化合物を得られる可能性があります。
この点について、どのように考えればいいのでしょうか。ポイントになるのは超共役です。
カルボカチオンの安定性は超共役によって説明されます。カルボカチオンは不安定な中間体ですが、隣にC-H結合があると、電子を弱く共有します。
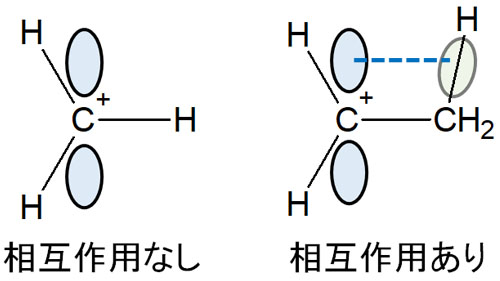
カルボカチオンのp軌道とC-H結合が平行になることで、互いに相互作用します。その結果、電子がいろんな場所に分散することで分子は安定します。
ビニル型カルボカチオンであれば、超共役による影響は以下のようになっています。
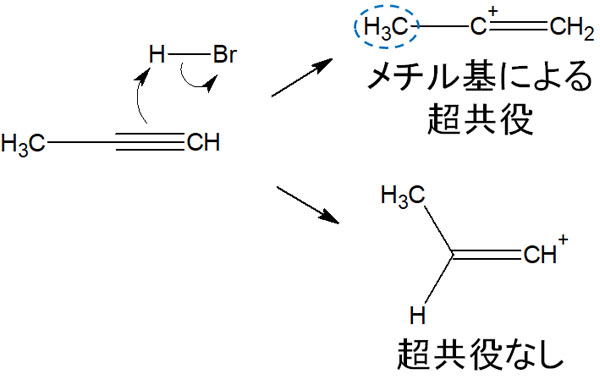
アルキンの付加反応が起きるとき、一方ではメチル基が隣にあるため、C-H結合による超共役が発生します。カルボカチオンのp軌道とC-H結合が平行になるのです。
それに対して、もう一方のカルボカチオンでは超共役がありません。隣の炭素原子は二重結合によって固定されており、C-H結合はカルボカチオンのp軌道と平行になることができません。その結果、一方の化合物を得ることができます。
アルキンなどsp混成軌道はs性が高く、電子を引き寄せるので酸性度が高い
なお一般的なカルボカチオンに比べて、なぜビニル型カルボカチオンは不安定なのでしょうか。それは、アルキンやビニル型カルボカチオンなどsp混成軌道の分子はs性が高いからです。
sp混成軌道では、s軌道1つ・p軌道1つです。つまり、s性は50%です。一方でsp2混成軌道では、s軌道1つ・p軌道2つです。そのためs性は33%です。sp3混成軌道は、s軌道1つ・p軌道3つなのでs性は25%です。
p軌道に比べてs軌道は小さいです。そのためs性が高いほど、電子は原子核との距離が近くなります。マイナスの電荷を有する電子と、プラスの電荷を有する陽子がお互いに引き合うため、アルキンは酸性度が高いことで知られています。
酸性度の順番は以下の通りです。
- HC≡CH(アセチレン:pKa25)
- H2C=CH2(エチレン:pKa44)
- CH3CH3(エタン:pKa50)
つまりアルカンやアルケンに比べて、アルキンはH+を放出してイオン(HC≡C– + H+)になりやすいです。このように酸性度が高いのは、マイナスの電荷を生じたとしてもs性が高いため、電子は陽子(プラスの電荷)との距離が近く安定化しやすいからです。
・カルボカチオンは反対に不安定となる
ただ酸性度が高く、マイナスの電荷を安定化しやすいというのは、プラスの電荷ではより不安定になりやすいことを意味しています。
ビニル型カルボカチオンはsp混成軌道であり、s性は50%です。アセチレンと同じように、高いs性を有しています。ビニル型カルボカチオンは炭素原子がプラスの電荷を帯びており、それでいてsp混成軌道であるため、他のカルボカチオンに比べて不安定です。
2当量以上のハロゲン化水素でアルカンになる
ここまで、HCl(塩化水素)やHBr(臭化水素)などのハロゲン化水素を用いたとき、どのようにアルキンが付加反応を起こすのかについて解説してきました。
ただ付加反応は三重結合だけでなく、二重結合にも起こります。そのためHX(ハロゲン化水素)を2当量以上加えると、二重結合を有するアルケンではなく、単結合のアルカンが生成されます。
合成されるアルケンについて、どのような位置選択性になるのかについて既に説明しました。ただアルケンからアルカンが合成されるとき、再び位置選択性を考慮しなければいけません。例えば、以下の化合物のうちどちらが合成されるでしょうか。
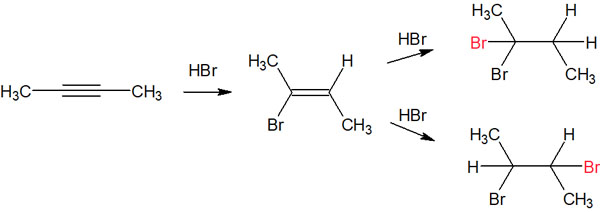
どちらの化合物が優先されるのかについては、同じように中間体の安定性を考えましょう。アルケン(二重結合)からアルカン(単結合)が合成されるとき、ブロモが隣に結合しているカルボカチオンは共鳴構造を書くことができます。
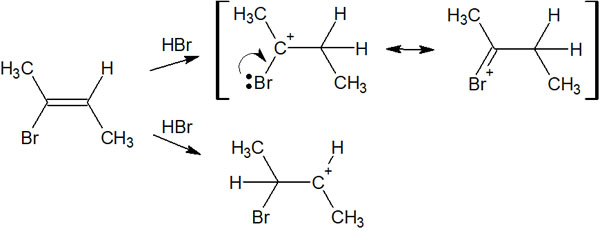
共鳴構造式を書くことができれば、その分だけ分子は安定します。そのため、アルケンからアルカンが合成されるとき、特定の中間体のみ生成されて合成反応が進みます。
今回の場合、同じ炭素原子に臭素原子が2つ結合した化合物を得られます。
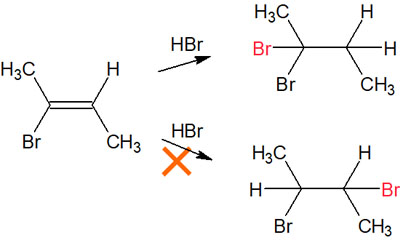
どのような化合物を得られるのかについては、中間体の安定性を確認しましょう。そうすれば、メインの生成物を予測できます。
一般的には、アルケンの付加反応はマルコフニコフ則を考えます。第三級や第二級など、カルボカチオンの安定性によってどちらの化合物が生成されるのか予測できます。ただ今回の化合物では、どちらのカルボカチオンも第二級カルボカチオンです。
そのためマルコフニコフ則で考えても、どちらの化合物が主生成物なのか分かりません。そこで、共鳴構造というその他の要素を考慮する必要があります。
・ハロゲンの付加でトランス化合物を得られる
なおハロゲン化水素の付加反応を考えてきましたが、ハロゲン(Cl2やBr2など)の付加反応であれば、反応機構は簡単になります。塩素原子や臭素原子など、同じハロゲン原子が付加されるため、どちらの置換基に結合するのかなどの位置選択性を考えなければいけない場面は少なくなります。
ハロゲンが付加反応をする場合、アンチ付加によってトランスのアルケンを得られます。また2当量以上のハロゲンが存在する場合、さらに反応が進行してアルカンを得られます。
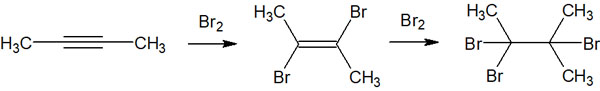
このようにして合成反応が進んでいきます。
水和でケトンを合成する:ケト-エノール互変異性体
一般的な付加反応では、ここまで述べた通りアルキン(三重結合)からアルケン(二重結合)が合成されます。また試薬の量が多ければ、生成物はアルカン(単結合)になります。一方で水和反応では、ケトンが合成されます。
水和反応では、硫酸などの酸触媒を利用します。こうした酸触媒(硫酸)により、アルキンではカルボカチオンを生じます。カルボカチオンの生成後、水分子が攻撃することでアルコールを得られるようになります。反応機構は以下の通りです。
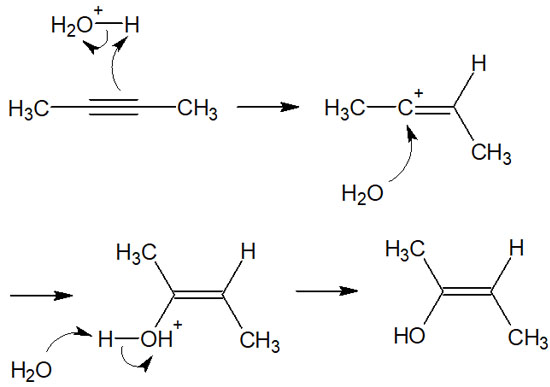
付加反応によってアルケンが合成されるのは共通です。また分子によっては位置選択性を考慮しなければいけないものの、ここまで説明してきたことを理解していれば、どの場所に置換基が結合するのかが予測できるようになります。
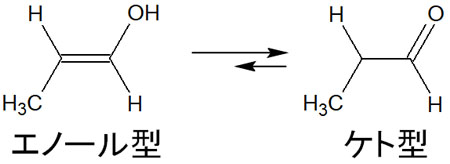
・ケト-エノール互変異性体でケトンになる
ただアルキンの水和反応では、得られる化合物はアルコールではなくケトンになります。なぜ、アルコールではなくケトンなのでしょうか。これには、ケト-エノール互変異性体が関与しています。
二重結合にアルコールが結合している場合、エノール型と呼ばれます。ただエノール型は不安定であり、通常はケト型になります。ケト型ではケトンになります。そのためアルキンの水和反応では、エノール型からケト型へと変換されます。以下の通りです。
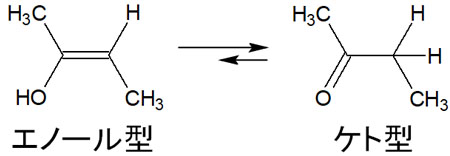
通常だと、アルキンへの付加反応によってアルケンが合成されたあと、試薬が過剰であればさらに反応が進むことでアルカン(単結合)を得られます。ただアルキンの水和反応では、このようにケト-エノール互変異性体によってケトンを得られます。
アルキンへのヒドロホウ素化でアルデヒドを得る
このようにアルキンへの付加反応では、ケト-エノール互変異性を考慮しなければいけません。そうしたとき、付加反応で非常に有名な合成反応としてヒドロホウ素化があります。
通常、マルコフニコフ則に従って求電子付加反応が進行します。ただマルコフニコフ則に従わず、反マルコフニコフ則による付加反応がヒドロホウ素化です。アルケンでもアルキンでも付加反応ではマルコフニコフ則が重要であるものの、ヒドロホウ素化では逆の位置にて付加反応が進行します。
ヒドロホウ素化ではボラン(BH3)を試薬として利用します。立体障害があるため、アルケンでもアルキンでも、ボランのホウ素原子は置換基の少ない原子と化学反応します。
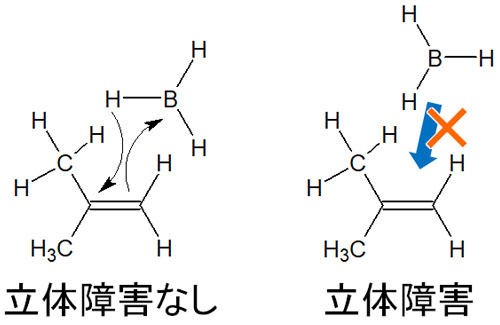
アルキンのヒドロホウ素化では、末端アルキンでの合成が特に重要です。分子の末端にアルキンがある場合、ボランは以下のように反応します。
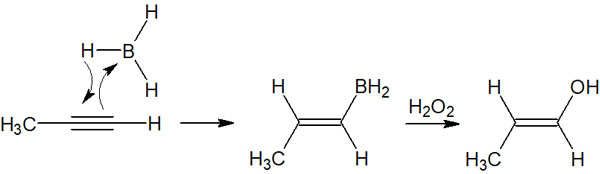
マルコフニコフ則であれば、既に説明した通りカルボカチオンの安定性が重要になります。そのため超共役などの影響を考慮し、置換基の少ない炭素原子に水素原子(プロトン)が付加します。
ただヒドロホウ素化では、カルボカチオンの中間体は生成されません。シン付加(同じ方向からの付加反応)により、付加反応するのがヒドロホウ素化です。このとき立体障害により、置換基の少ない末端の炭素原子にホウ素原子が結合します。
その後、過酸化水素(H2O2)などで別に酸化反応をすることで、アルコールが合成されます。
ただアルキンの付加反応なので、合成された化合物はエノール型のアルコールです。そのためケト-エノール互変異性体によって、化合物の形が変わります。末端アルキンをもつ分子に対してヒドロホウ素化・酸化の合成反応をした場合、アルデヒドが最終化合物です。
三重結合が末端ではなく分子の中間にある場合、ケト-エノール互変異性体によってケトンを得られます。一方で末端アルキンに対してヒドロホウ素化をする場合、アルデヒドを得られます。
強塩基により、アセチリドが生成する
ここまで、アルキンに対する求電子付加反応について説明してきました。ただアルキンで重要なのは付加反応だけではありません。アセチリドを用いた三重結合の反応でも重要です。
付加反応は有用性が高いものの、必ず三重結合が消失します。二重結合や単結合の化合物が得られるのです。それでは、三重結合をもつ化合物を合成するためにはどうすればいいのでしょうか。そうしたとき重要なのがアセチリドです。
前述の通り、アルカン(単結合)やアルケン(二重結合)に比べて、末端アルキンの酸性度は高いです。酸性度が高いというのは、「H+(プロトン)が引き抜かれることでイオンを形成しやすい」ことを意味しています。
そこで、末端アルキンを有する化合物に対して、ナトリウムアミド(NaNH2)などの強塩基と反応させます。その結果、末端アルキンの水素原子が引き抜かれてアセチリドが生成されます。
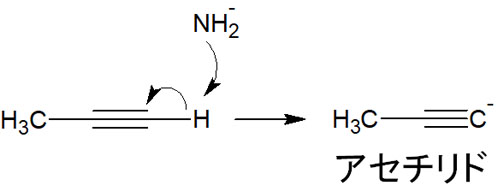
なおアセチリドについては、ナトリウムアセチリドなど試薬として売られていることもあり、これを利用してもいいです。ただ金属アセチリドは爆発性を有することがあるため、取り扱いには注意が必要です。
求核置換反応で三重結合をもつアルキル鎖を合成できる
このように強塩基によってアセチリドを得た後、求核置換反応をさせることでアルキン化合物を得ることができます。
アセチリドアニオンは強塩基であり、強い求核性をもっています。そのため求核置換反応を起こすことで、アルキル化をすることができます。その結果、三重結合を有するアルキル化された化合物を合成できます。
求核置換反応には、SN1反応やSN2反応があります。特にSN2反応は頻繁に利用されますが、以下のような求核置換反応によってアセチリドアニオンを用いたアルキル化が可能になります。
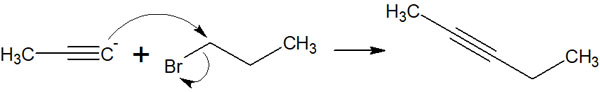
三重結合を有する化合物を合成したいとき、一つの方法としてアセチリドを用いた求核置換反応があります。アセチレンなどの末端アルキンは酸性度が高いため、この性質を利用することで、アルキン化合物を合成できるのです。
三重結合を有する化合物の合成反応を理解する
有機化学では単結合や二重結合を有する化合物の合成反応がメインです。そのため、ほとんどの反応メカニズムは単結合や二重結合での電子の動きに焦点を当てています。
ただ、化合物の中には三重結合を有するケースもあります。これらアルキンで重要な反応は以下の2つです。
- 求電子付加反応
- アセチリドを用いたアルキル化
アルキンの付加反応では、どのような合成反応をするのかによって最終生成物が異なります。またどの位置に置換基が結合するのかも重要です。中間体の安定性を考慮しながら、どのような化合物を合成できるのか予測できるようにしましょう。
また三重結合を有する化合物を合成したい場合、アセチリドアニオンを活用するといいです。求核置換反応により、アルキン化合物を得られます。これらの反応機構を理解することで、どのようにアルキンの合成反応を進めればいいのか考えるようにしましょう。






