芳香族性をもつ化合物は種類が多いです。分子内にベンゼン環があると、すべての化合物が芳香族性を示します。
ただ、ベンゼン環とは異なる芳香族化合物が存在します。それがヘテロ環化合物です。別名で複素環化合物とも呼ばれますが、芳香族性を示すものの、ベンゼン環とは異なる性質をもつ化合物が芳香族ヘテロ環化合物です。
複素環化合物を有機化学で取り扱うとき、何に注意すればいいのでしょうか。また、芳香族ヘテロ環化合物はどのような性質があるのでしょうか。
有機化学の大きな分野の一つが複素環化合物です。ヘテロ環化合物の性質について、どのように考えればいいのか解説していきます。
もくじ
芳香族ヘテロ環化合物とは?複素環化合物の種類
ヘテロ環化合物について理解する前に、まずヘテロ原子について学ばなければいけません。ヘテロ原子とは、炭素原子または水素原子外の原子を指します。代表的なヘテロ原子としては以下があります。
- 酸素原子(O)
- 窒素原子(N)
- 硫黄原子(S)
- リン原子(P)
環状化合物は多いですが、ヘテロ原子を有する化合物をヘテロ環化合物(複素環化合物)といいます。芳香族性を示すヘテロ環化合物はたくさんあり、代表的な化合物としては例えば以下があります。
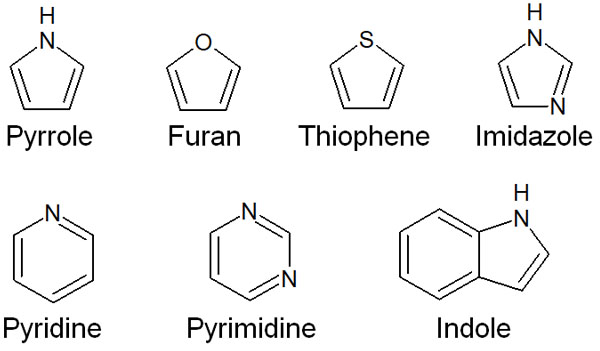
もちろん、他にも多くの芳香族ヘテロ環化合物が存在します。
(4n+2)のπ電子をもつ場合、化合物は芳香族性を示します。上記の複素環化合物について、すべて6個または10個のπ電子をもちます。そのため、芳香族性を示します。
・脂肪族のヘテロ環化合物も種類が多い
参考までに、脂肪族のヘテロ環化合物も種類が多いです。芳香族性を満たす二重結合がないものの、環状化合物の中にヘテロ原子がある場合は脂肪族のヘテロ環化合物だといえます。例えば、脂肪族の複素環化合物には以下のようなものがあります。
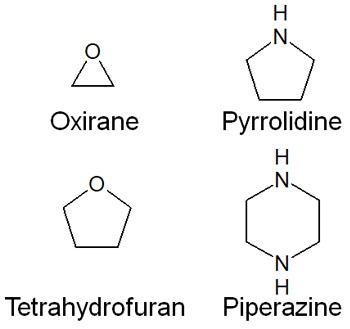
いずれにしても、このようにヘテロ環化合物には多くの種類があります。
ピリジンとピロールの芳香族性と塩基性
なお、同じ芳香族複素環化合物であっても、5員環と6員環では性質が異なります。この例として、頻繁に利用されるのがピリジンとピロールです。

6員環のヘテロ環化合物について、芳香族性を示すことは容易に理解できます。ピリジンは6員環であり、二重結合が3つあります。π電子が6つあるため、芳香族性を示します。
ただ、なぜピロールが芳香族性を示すのでしょうか。ピロールには二重結合が2つしかありません。そのため、π電子は4つしかもたないのではと考えてしまいます。π電子が4つの場合、芳香族性を示すことはできません。
・ピロールの窒素原子が芳香族性(2p軌道)に関与する
芳香族性を示すためには、π電子が6個でなければいけません。そこでピロールの窒素原子を確認すると、非共有電子対(ローンペア)が存在することが分かります。窒素原子は炭素原子2つおよび水素原子1つと結合しています。それだけでなく、結合に関与していない電子が2つあります。
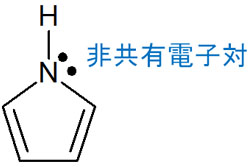
ピロールの場合、窒素原子に存在する非共有電子対が芳香族性に関与しています。つまり二重結合に存在するπ電子4つに加えて、窒素原子が保有する2つの電子(ローンペア)が芳香族性に関わっています。これにより、ピロールは芳香族性を示します。
通常、窒素原子があると塩基性を示します。そのため、窒素原子に存在するローンペアが他の分子を求核攻撃できます。
ただ、ピロールの非共有電子対は2p軌道(芳香族性に関与する軌道)に存在しています。ローンペアは窒素原子上に存在するわけではなく、環全体に分布しています。
電子が非局在化(いろんな場所に電子が分散すること)しているため、窒素原子が非共有電子対をもつとはいっても、ローンペアは他の分子を攻撃できません。つまり求核性(塩基性)はなく、ピロールが塩基性を示すことはありません。
・ピリジンのローンペアはsp2混成軌道に関与する
それに対して、ピリジンは塩基性を示します。ピリジンは3つの二重結合があるため、ピリジンの非共有電子対(ローンペア)が芳香族性に関与する必要はありません。そのため、ピリジンにある窒素原子のローンペアは2p軌道ではなく、sp2混成軌道に関わります。
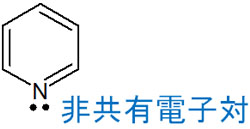
ローンペアがsp2混成軌道に関与し、芳香族性に関与していないことから、窒素原子に存在する非共有電子対は塩基性を示します。
また水に溶けないピロールとは異なり、ピリジンは親水性です。ピリジンが水溶性なのは、溶液中で水素結合するからです。
ピロールの場合、窒素原子のローンペアは芳香族性に関与しており、窒素原子上には、水素結合するために必要な電子が存在しません。一方でピリジンでは、窒素原子はマイナスの電荷を帯びており、ローンペアが水分子と水素結合できます。
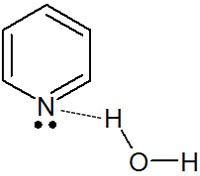
そのため、ピリジンは水溶性です。同じ芳香族ヘテロ環化合物であっても、5員環と6員環では性質が大きく異なります。
5員環と6員環で求電子置換反応の反応性が異なる
それでは、芳香族ヘテロ環化合物での反応性はどのように違うのでしょうか。性質が違うことから、5員環と6員環では芳香族化合物の反応性も異なります。
芳香族性を示す複素環化合物でチェックするべき項目は以下になります。
- 化合物の反応のしやすさ:電子密度の高さ
- 反応を起こす場所:配向性
ベンゼン環を有する芳香族化合物では、置換基の性質によって電子密度や配向性が変化します。芳香族ヘテロ環化合物でも、置換基によって反応性が変わります。ただそれよりも重要なのが、「5員環と6員環によってどのように反応性が変化するのか」だといえます。
5員環は電子密度が高く、2位に置換基が結合する
芳香族化合物で重要な合成反応として、求電子置換反応があります。ヘテロ環にある水素原子と置換基が置き換わる反応が芳香族求電子置換反応です。
芳香環の電子密度が高い場合、求電子置換反応が起こりやすいです。芳香環の電子密度が高いほど、求電子剤を攻撃しやすいからです。
5員環の複素環化合物では、芳香環の電子密度が高くなっています。5員環にも関わらず、6つのπ電子をもっているからです。5員環に6つのπ電子があるため、「6つ(π電子) ÷ 5員環 = 1.2」となり、1つの炭素原子には1.2のπ電子が存在することになります。
これが、5員環のヘテロ環化合物で反応性が高い理由です。
・配向性は2位(α位)となる
なお5員環のヘテロ環化合物では、2位(α位)と3位(β位)と2つの反応場所があります。どちらの場所で芳香族求電子置換反応が起こるのでしょうか。
答えをいうと、2位で求電子置換反応が起こります。求電子剤と芳香環が反応を起こすとき、2位に置換基があるほうが多くの共鳴構造式を書くことができます。反応機構は以下のようになります。
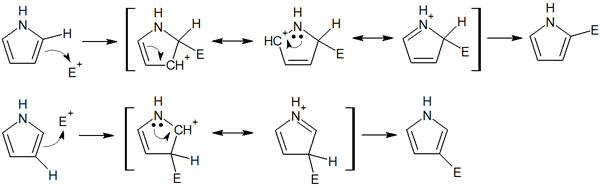
共鳴構造式を書けるほど電子はいろんな場所に分散し、構造は安定化しやすいです。この理由により、5員環のヘテロ環化合物による求電子置換反応は2位(α位)に起こります。
6員環は電子密度が低く、メタ配向性となる
一方で6員環の複素環化合物はどうなのでしょうか。5員環のヘテロ環化合物とは異なり、6員環では電子密度が低くなっています。芳香族の炭素原子に存在する電子が少なくなっているのです。
共鳴構造式を書くと、芳香環の二重結合(電子)は窒素原子に移動することができます。その結果、以下のような共鳴構造になります。
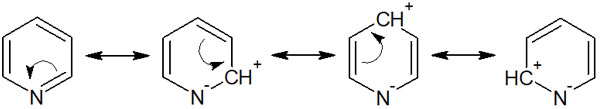
このように、炭素原子はプラスの電荷を帯びています。芳香環の電子が窒素原子に移動した結果、芳香環の電子密度が低くなり、反応性が悪くなるのです。事実、ピリジンに求電子置換反応をさせるためには、過酷な条件下で反応させなければいけません。
また共鳴構造式を確認すると、オルト位とパラ位でプラスの電荷を帯びていることが分かります。そのため、ピリジンなどの6員環ヘテロ環化合物では、必ずメタ位で求電子置換反応が起こります。オルト位やパラ位では電子密度が低いため、メタ位で反応するのです。
ピリジンでメタ配向性になるのは、メタ位のみ炭素原子がプラスの電荷を帯びていないからです。
ピリジンで理解する芳香族求核置換反応
なお、芳香族複素環化合物で起こる反応は求電子置換反応だけではありません。芳香族求核置換反も起こります。求核剤が攻撃することで、ベンゼン環上の置換基が置き換わる反応が芳香族求核置換反応です。
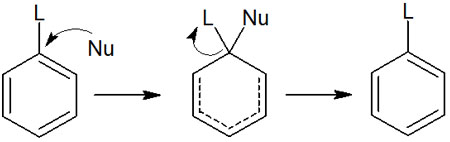
芳香族化合物は通常、求核置換反応を起こすことはありません。ただピリジンのように、芳香族化合物の電子密度が低くなっている場合、例外的に芳香族求核置換反応が起こります。
具体的には、ピリジンにフッ素(F)や塩素(Cl)などのハロゲンがオルトまたはパラに結合している場合、求核置換反応が起こります。
前述の通り、6員環の芳香族ヘテロ環化合物はオルト位とパラ位でプラスの電荷を帯びています。そのため、マイナスの電荷を有する求核剤が攻撃しやすくなっています。この条件を満たす場合、ハロゲンへの求核置換反応が起こります。
ヘテロ環化合物の反応性と配向性を学ぶ
有機化学合成で一つの大きなジャンルがヘテロ環化合物です。分子内に複素環を有する化合物は多く、どのように化学反応するのか学ばなければいけません。
ただ、ベンゼン環と比べてヘテロ環には大きな違いがいくつかあります。また同じように芳香族性を化合物が示すにしても、5員環と6員環では性質が大きく変わります。塩基性度や反応性、配向性など異なる性質をもつのです。
なお芳香族複素環化合物には非常に多くの種類があります。5員環や6員環に限らず、より複雑な環状構造になっているのは普通です。また、同じ分子内に複数のヘテロ原子をもつ化合物はたくさんあります。そこで、ピロールやピリジンなど単純な複素環化合物を例に解説してきました。
芳香族性のある化合物なので、化合物は求電子置換反応や求核置換反応を起こします。ただ、ヘテロ原子特有の芳香族特有の反応性や配向性があるため、これらの性質を理解するようにしましょう。






