有機化学で非常に重要な要素が酸・塩基です。酸と塩基があるからこそ、電子が移動することで化合物同士の合成反応が進みます。つまり酸や塩基がなければ、有機合成反応は起こらないことになります。
そこで、酸と塩基の定義を事前に理解しなければいけません。どのような化合物が酸であり、どのような化合物が塩基なのか理解するのです。
ただ、酸なのか塩基なのかは条件によって変わります。あるときは酸であっても、他の条件下では塩基になることがよくあります。溶液中で酸性を示す物質が必ずしも酸ではありません。一般的には酸と考えられている物質であっても、塩基になることはよくあります。
そこで酸と塩基の定義を理解しましょう。最初にブレンステッド・ローリーの定義を理解し、その後にルイス酸・ルイス塩基をどう考えればいいのか確認していきます。
もくじ
高校化学はアレニウスの定義とブレンステッド・ローリーの定義
酸と塩基にはさまざまな定義があります。その中でも簡単で分かりやすいのは、アレニウスの定義です。アレニウスの定義では、以下のように酸と塩基を定義しています。
- 酸:水溶液中でH+を生成する化合物
- 塩基:水溶液中でOH–を生成する化合物
しかし、この定義は化学で使い物になりません。そもそも、化学反応は水溶液中だけで進行するわけではありません。
そこで、ブレンステッド・ローリーの定義が考えられました。ブレンステッド・ローリーの定義では、以下のように酸と塩基を定義します。
- ブレンステッド酸:H+を与える分子
- ブレンステッド塩基:H+を受け取る分子
高校化学では、ブレンステッド・ローリーの定義まででした。またブレンステッド酸やブレンステッド塩基を学ぶにしても、共役酸や共役塩基、酸の強さの指標など、詳しい内容までは学びません。そのため、なぜ酸や塩基が発生するのかについて深く理解する必要があります。
またルイス酸とルイス塩基を理解するには、最初にブレンステッド酸とブレンステッド塩基を学ぶのが一般的なので、この内容を確認していきましょう。
酸と塩基では、必ず共役酸と共役塩基が存在する
酸や塩基として知られている分子はたくさんあります。例えば、アンモニアは塩基性を示します。アンモニア分子はH+を受け取るため塩基です。一方で水はH+を与えるので酸です。
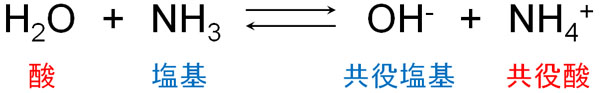
また酸がH+を与えた後、生成する分子を共役塩基といいます。酸がH+を与えたということは、マイナスの電荷を有する化合物が発生することを意味しています。この化合物は逆反応でH+を受け取るため、共役塩基という名前になっています。
一方で塩基がH+を受け取ったあと、生成する分子を共役酸といいます。プラスの電荷を得ており、逆反応のときH+を与えることから共役酸という名前になっています。
アンモニアが水に溶けてイオンになる場合、NH4+が共役酸です。反応後、プラスの電荷をもつ分子が共役酸になると考えれば分かりやすいです。一方でアンモニアが水に溶けたとき、マイナスの電荷をもつOH–を共役塩基といいます。
ブレンステッド酸とブレンステッド塩基は相対的に関与する
それでは、酸と塩基は絶対的なものなのでしょうか。そうではなく、酸と塩基は相対的です。あるときは酸であるが、他の条件下では塩基になることがよくあります。
例えば、水は酸でもあり塩基でもあります。水が塩酸(HCl)と反応すれば、水はブレンステッド塩基として機能します。一方でアンモニアと反応すれば、水はH+を与えて酸になります。
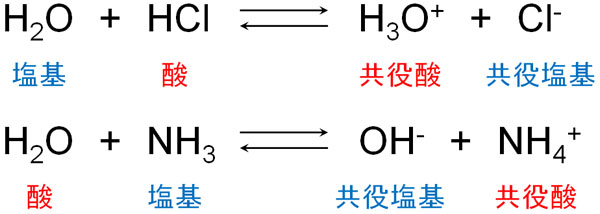
もちろん水だけでなく、多くの分子が酸になったり塩基になったりします。
より強い酸がある場合、化合物は塩基として機能します。一方で強い塩基性試薬を混ぜた場合、化合物は酸として機能します。どのような酸性試薬や塩基性試薬を使うのかによって、化合物の酸と塩基は違ってきます。
例えば、アミンは酸性物質でしょうか。それとも塩基性物質でしょうか。一般的には、アミノ基を有する化合物は塩基性物質と考えられています。ただ、これは水を対象としているからです。条件によっては、アミンは酸になります。
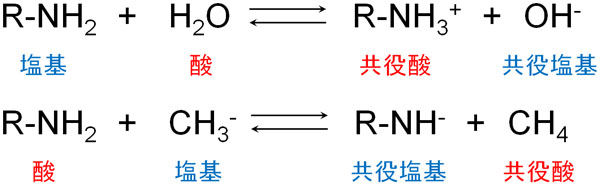
この事実を理解すると、絶対的な酸性物質や塩基性物質は存在しないことが分かります。酸性か塩基性かは、どのような試薬を使うのかによって変わるからです。
酸の強さの指標:pKa値
それでは、どのようにして酸の強さを表すのでしょうか。酸性度を示すものとして、pKa値があります。
例えば、塩酸(HCl)を水に溶かすとします。ただ、すべてがイオンになっているわけではありません。一部だけイオンになっています。あるときは塩酸分子として存在しており、あるときは塩酸がイオンとして存在することで酸性を示します。
このとき、平衡状態のときに平衡定数(K)を出すことができます。
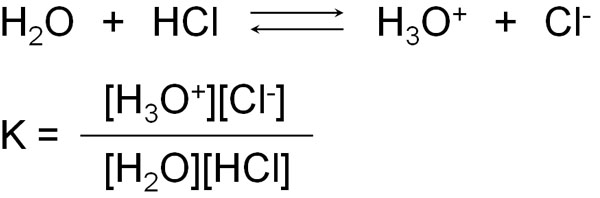
ただ平衡定数(K)の中で、水(H2O)は溶媒であり、過剰に含まれています。また塩酸と反応したとしても、溶媒として水が大量に存在していることから、水の量はわずかしか変化しません。そのため、上の式で[H2O]は無視することができます。
そのため、平衡定数は[H2O]を省いて以下のように記されます。
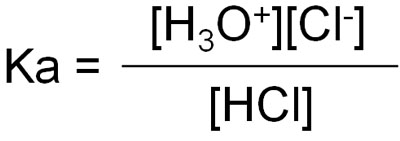
ただ平衡定数をそのまま記したのでは理解しにくいです。そこで、logを用いて以下の式に当てはめたものがpKaです。
- pKa = -log Ka
pKa値が低いほど、酸性度が強いことを表しています。反対に考えると、pKa値が高いほど、塩基性度が高いことを意味しています。酸性度や塩基性度を調べるとき、pKaの値を確認するようにしましょう。
参考までに、それぞれの分子についてpKaは以下のようになっています。
| 化合物 | pKa |
| HI | -10 |
| HBr | -9 |
| HCl | -7 |
| HF | 3.2 |
| CH3COOH | 4.8 |
| CH3OH | 15.5 |
| H2O | 15.7 |
| HC≡CH | 25 |
| NH3 | 33 |
| CH4 | 48 |
これらの分子のpKa値を覚える必要はありません。ただ、このように化合物によって酸性度に違いがあることを理解しましょう。またpKa値が低いほど酸性度が高く、pKa値が高いほど塩基性度が高いことを確認しましょう。
共役塩基が安定なほど酸性度が強い(塩基性度が弱い)
それでは、どのようなときに酸になったり塩基になったりするのでしょうか。これについて、共役酸や共役塩基の性質に依存すると理解しましょう。
化合物が酸性を示すかどうかは、共役塩基が安定かどうかで判断します。酸がイオンになると、H+を提供することでマイナスの電荷を帯びるようになります。つまりイオンでは、共役塩基が発生します。
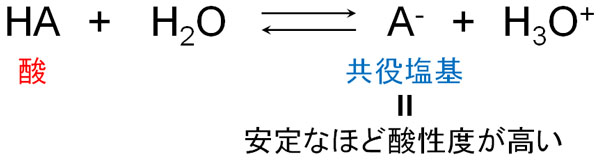
共役塩基の状態が安定であると、化合物は積極的にH+を提供しようとします。できるだけ早くH+を提供して、マイナスの電荷を帯びようとしているのです。
同じように考えると、塩基性の強さは共役酸の強さで考えることができます。塩基がH+を受け取った後、生成されるのが共役酸です。共役酸が安定であるほど、塩基はH+を受け取ることで安定な状態になろうとします。
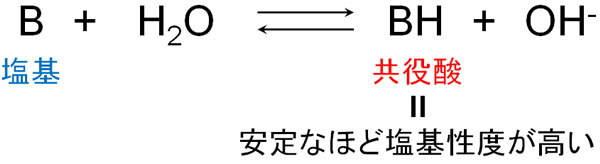
ちなみに塩基には必ず非共有電子対(ローンペア)が存在します。非共有電子対が水素を受け取ることで、共役酸が安定化します。
これら酸性度や塩基性度については、pKa値を確認する必要があります。もちろん前述の通り、化合物のpKa値を覚える意味はありません。ただ、pKaの表から共役酸や共役塩基の安定性を確認することで、酸・塩基の反応性を推測できるようになります。
酸性度や塩基性度はどのように決まるのか
それでは酸性度(または塩基性度)はどのように決まるのでしょうか。pKa値の高い低いによって酸性度や塩基性度が分かります。ただ、pKa値を覚えても意味がなく、なぜ酸性度や塩基性度が高くなるのかについてのメカニズムを理解しなければいけません。
これについて、酸性度や塩基性度には以下の要素が関わります。
- 電気陰性度
- 原子の大きさ
- 共鳴構造
- 混成軌道の様子
他にも、酸性度や塩基性度に関わる要素はたくさん存在します。ただメインとなる要素がこれらだといえます。
・電気陰性度が高いと酸性度が高い
電気陰性度の高い原子が水素原子と結合していると、分子内でプラスとマイナスの電荷に分かれるようになります。その結果、分子は分極します。分極の度合いが高いほど、電気陰性度の高い原子は電子を引き寄せます。つまり水素原子はプラスの電荷を帯びやすくなり、結果として酸性度が高くなります。
例えば、第二周期元素を比較するとどうでしょうか。この場合、酸性度は電気陰性度の順番になります。
- CH4(pKa:48)>NH3(pKa:33)>H2O(pKa:15.7)>HF(pKa:3.2)
電気陰性度が高ければ、酸性度が高くなります。
・原子が大きいと酸性度が高い
ただ、酸性度は電気陰性度だけが関与しているわけではありません。原子の大きさも重要です。例えば、ハロゲンは以下のようなpKaです。
- HF(pKa:3.2)>HCl(pKa:-7)>HBr(pKa:-9)>HI(pKa:-10)
電気陰性度で考えるなら、フッ素原子が最も電気陰性度が高いです。ただ、酸性度は電気陰性度の順番に対して逆になっています。これには原子の大きさが関わっています。
原子が大きくなるほど分子の結合距離が大きくなり、結合力は弱くなります。その結果、H+を提供してイオンになりやすいです。原子が大きいほど、共役塩基の構造が安定化しやすいのです。
・共役塩基の共鳴によって構造が安定する
共鳴も酸性度(または塩基性度)に大きく寄与します。共役塩基の共鳴により、電子がいろんな場所に存在することで安定化します。これを電子の非局在化といいます。例えばp-ニトロフェノールは以下のような共鳴構造を書けます。
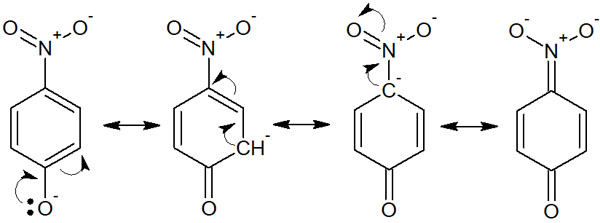
電子が多くの場所に移動できるため、フェノールよりも酸性度が高いです。共役塩基が共鳴によって安定化するからです。なお同じように、共役酸が共鳴によって安定化すると塩基性が強くなります。
・混成軌道でs性が強いと酸性度が高い
混成軌道は酸性度に関係しています。軌道にはs軌道とp軌道があり、s軌道の割合が高いほど酸性度が高いです。
p軌道よりも、s軌道のほうが原子核に近いです。原子核はプラスの電荷を帯びているため、マイナスの電荷を安定化させやすいです。つまり、共役塩基がマイナスの電荷を帯びたときに安定になりやすいです。その結果、酸性度が高くなります。
例えば、酸性度の順番は以下のようになります。
- HC≡CH(アセチレン:pKa25)
- H2C=CH2(エチレン:pKa44)
- CH3CH3(エタン:pKa50)
エタンのs性(s軌道の割合)は25%です。一方でエチレンのs性は33%です。アセチレンのs性は50%です。そのため、s性の高いアセチレンで酸性度が高くなっています。
ルイス酸・ルイス塩基の違いや考え方
ここまでがブレンステッド・ローリーの酸と塩基の定義に関する詳しい内容です。どのようなときに酸になり、または塩基になるのか理解することが有機化学で重要です。
しかし、有機化学ではブレンステッド・ローリーの定義であっても不十分です。理由は単純であり、化学反応ではH+が関与しない合成反応がたくさんあるからです。そのため、酸と塩基では別の概念を理解しなければいけません。
そこで、ルイス酸とルイス塩基を利用します。ルイス酸とルイス塩基では、以下のように定義します。
- ルイス酸:電子を受け取る分子
- ルイス塩基:電子を提供する分子
ルイス酸はブレンステッド酸であり、ルイス塩基はブレンステッド塩基でもあります。例えば、以下のように反応します。
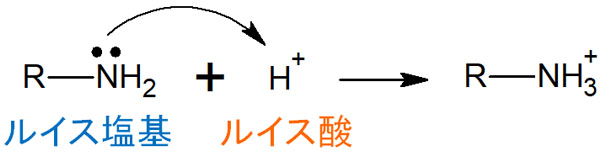
有機化学の合成反応では、電子の矢印によって化学反応を記すことが非常に多いです。このとき電子を受ける試薬として、求電子試薬があります。求電子試薬はルイス酸です。
一方で、他の化合物に対して攻撃する試薬が存在します。これを求核試薬といいます。求核試薬はルイス塩基であり、塩基性が強いと求核性も強くなることが知られています。ルイス酸とルイス塩基であれば、H+が関与しない反応であっても酸と塩基によって反応を考えられるようになります。
求電子試薬と求核試薬の見極め方
それでは、どのように考えてルイス酸(求電子試薬)とルイス塩基(求核試薬)を見極めればいいのでしょうか。
見分け方は簡単であり、化学反応の矢印を書くとき、電子を受け取る分子がルイス酸だといえます。酸性の強い化合物であるほど、電子を受け入れる能力が高いです。
そのように考えたとき、ルイス酸では以下のような、空軌道を有している化合物についても酸であると考えます。
- ホウ素(B)
- アルミニウム(Al)
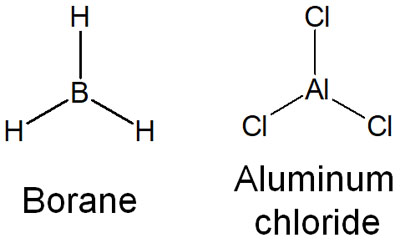
ホウ素やアルミニウムはなぜ、ルイス酸になるのでしょうか。これらは空軌道を有することで、電子を受け入れることができるからです。そのため、ホウ素(ボラン:BH3)やアルミニウム(塩化アルミニウム:AlCl3)は強力なルイス酸触媒として知られています。
ルイス酸には金属が利用されることがよくあります。金属元素は空軌道を有するため、電子を受け入れることでルイス酸になりやすいです。
空軌道を有する化合物が他の分子を攻撃し、新たな結合を作ることはありません。そのため、ルイス酸であると見分けることができます。
・ルイス塩基を見分ける
一方でルイス塩基はどうなのでしょうか。求核試薬では、非共有電子対(孤立電子対)を必ず有することになります。強い求核性(強い塩基性)を有する化合物はどれも、非共有電子対が存在すると考えましょう。

孤立電子対(ローンペア)があったとしても酸になることがあります。事実、アミンは一般的に塩基性であるものの、より強力な塩基が存在する状況ではアミンは酸になります。
ただ非共有電子対がなければ、求核剤になることはできません。相手に電子を与えるためには、結合に関与していない電子の存在が必須だと理解しましょう。このようにして、ルイス酸(求電子試薬)とルイス塩基(求核試薬)を見分けるようにしましょう。
酸・塩基には定義があり、種類や特徴を学ぶべき
有機化学では、ほとんどの反応が酸と塩基によって進んでいきます。これらのどの化合物にも酸性度と塩基性度があり、共役酸や共役塩基を見極めることで酸性度(pKa)の違いが分かるようになります。
ブレンステッド・ローリーの定義による酸と塩基は相対的なものだといえます。どのような試薬と一緒にするのかによって、あるときは酸になり、他の条件では塩基になります。酸と塩基では、この事実を認識しなければいけません。
ただ、化学反応では必ずしもH+が移動するわけではありません。そのためブレンステッド酸やブレンステッド塩基だけでは不十分です。そこでルイス酸・ルイス塩基の概念を学ばなければいけません。電子を受けるのか与えるのかによって、酸と塩基を見分けることができます。
これらの違いを学ぶことで、有機化学をより深く理解できるようになります。酸と塩基は有機化学の初歩なので、必ず概念を理解するようにしましょう。






