ベンゼン環をもつ化合物は非常に多いです。ベンゼン環は芳香族と呼ばれており、ベンゼン環をもつ化合物は芳香族化合物です。
二重結合を有する分子がベンゼン環です。ただ、ベンゼン環はアルケンとはまったく異なる化学反応を起こします。ベンゼン環はアルケンと同じように電子リッチの状態ですが、アルケンのように求電子付加反応を起こすことはありません。
付加反応ではなく、ベンゼン環では置換反応が起こります。芳香族性が失われないように化学反応が進むのです。これを芳香族求電子置換反応といいます。
ベンゼン環への置換反応としては、フリーデルクラフツ反応(Friedel-Crafts反応)が非常に有名です。これらの反応機構を含め、芳香族求電子置換反応がどのように進行していくのか確認していきます。
もくじ
ベンゼン環は安定であり、二重結合への付加反応は起こらない
非常に安定な分子としてベンゼン環が知られています。アルキル鎖であれば、アルケンへの付加反応が起こることで二重結合が単結合になります。一方でベンゼン環は二重結合を有するものの、ベンゼン環への付加反応は起こりません。
例えば、二重結合への付加反応では以下のようにアルケンからアルカンを合成できます。
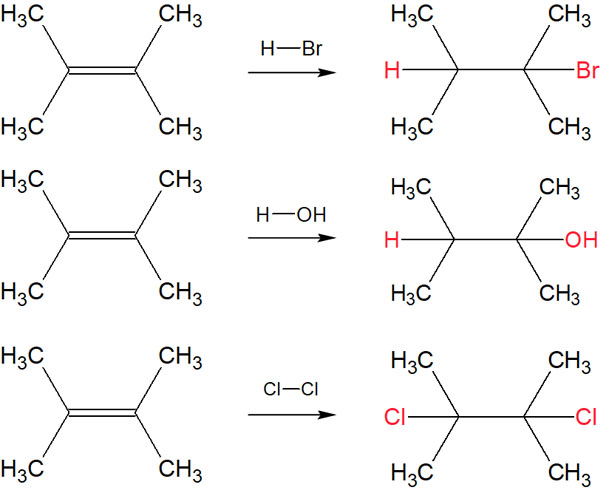
それに対して、例えばベンゼン環に臭化水素(HBr)や臭素(Br2)を加えても、以下のような化合物を得ることはできません。
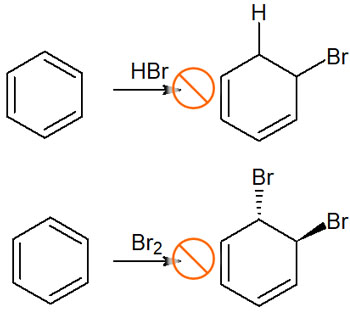
芳香族環は非常に安定であり、上図だと反応後の化合物は芳香族性が失われています。非常に安定な化合物から、不安定な化合物を合成することになるため、活性化エネルギーが大きすぎて合成反応は進行しません。
芳香族性を失わずに反応するのがベンゼン環の反応機構
それでは、芳香族性のある化合物はどのような合成反応をするのでしょうか。ベンゼン環の場合、芳香族性を失わずに合成反応が進行します。つまりベンゼン環に置換基が結合して一瞬だけ芳香族性が失われたとしても、芳香族性が復活するように次の反応が起こります。
要は、芳香族求電子置換反応では「ベンゼン環に結合している水素原子が他の置換基に置き換わる」と理解しましょう。例えば、以下のようになります。
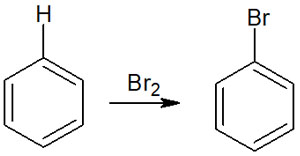
このように、ベンゼン環に結合している水素原子が他の置換基に置き換わるため、芳香族求電子置換反応と呼ばれます。
それでは、芳香族求電子置換反応の反応機構はどのようになっているのでしょうか。すべての芳香族求電子置換反応では、前述の通り芳香族性が復活するように合成反応が進みます。反応機構は以下のようになります。
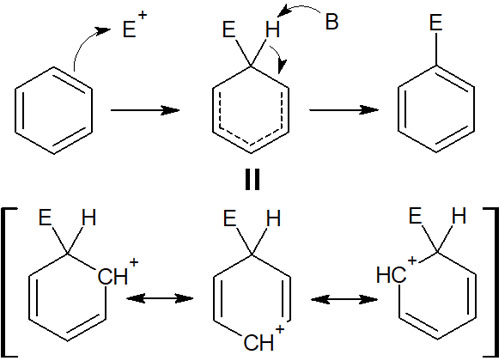
芳香族求電子置換反応が起こる中間体では、芳香族性が失われます。ただ共鳴構造式を書けるため、中間体は不安定であるものの、ある程度は安定です。その後、芳香族性を取り戻すように水素原子(プロトン)が引き抜かれ、置換反応が完了します。
すべての芳香族求電子置換反応は、このように合成反応が進みます。ベンゼン環に結合する官能基は違うものの、基本的な反応機構はどれも同じです。
ニトロ化やスルホン化は求電子置換反応の例
それでは、芳香族求電子置換反応の例としては何があるのでしょうか。代表的な芳香族求電子置換反応としては、ニトロ化やスルホン化があります。
芳香族求電子置換反応という言葉の通り、強力な求電子剤が存在することでベンゼン環への置換反応が進行します。そこでニトロ化やスルホン化では、硫酸などの強酸を用いて反応させます。
・ベンゼン環へのニトロ化
濃硝酸と濃硫酸を混合させ、ベンゼンを加えるとニトロベンゼンが生成されます。濃硝酸と濃硫酸を加えると、ニトロニウムイオンが生まれます。ニトロニウムイオンは強力な求電子剤です。
そのため、以下のような反応機構によってニトロ化が起こります。
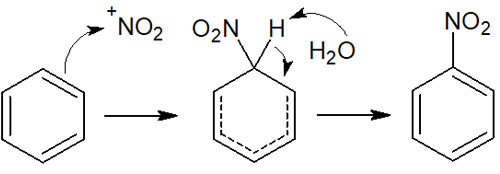
・ベンゼン環へのスルホン化
またベンゼン環のスルホン化も代表的な芳香族求電子置換反応です。発煙硫酸(濃硫酸に三酸化硫黄を吸収させた液体)とベンゼン環を反応させることでスルホン化をすることができます。
濃硫酸と三酸化硫黄が反応することで、強力な求電子剤が生まれます。以下のようになります。
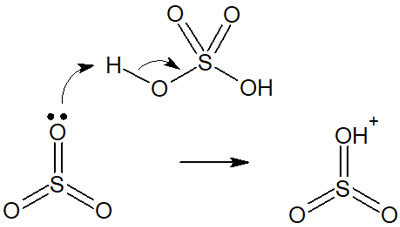
その後、求電子剤とベンゼン環が以下のように反応します。
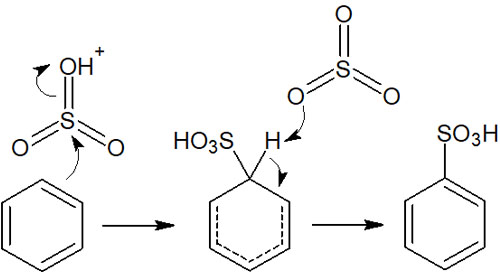
参考までに、ベンゼン環のスルホン化は可逆反応です。そのため高温条件で水と反応させると、スルホ基が外れてベンゼンになります。ベンゼンスルホン酸と水を反応させる合成反応も芳香族求電子置換反応の一つです。
芳香環にハロゲン化を行う
なお芳香族求電子置換反応では、ニトロ化やスルホン化以外に重要な反応があります。それがフリーデルクラフツ反応(Friedel-Crafts反応)です。ベンゼン環に置換基を入れるための合成反応では、必ずフリーデルクラフツ反応を学びます。
フリーデルクラフツ反応には、以下の2種類があります。
- フリーデルクラフツアルキル化反応
- フリーデルクラフツアシル化反応
この2つの反応機構を理解するためには、事前にベンゼン環のハロゲン化を学ぶ必要があります。芳香環へのハロゲン化を理解すれば、アルキル化もアシル化も反応機構は同じです。
前述の通り、ベンゼン環は非常に安定な構造しているため、アルケンのように塩化水素(HCl)や臭化水素(HBr)を加えたとしても反応しません。その代わり、FeCl3(塩化鉄)やFeBr3(臭化鉄)などのルイス酸を利用し、Cl2(塩素)またはBr2(臭素)を加えることで、ベンゼン環をハロゲン化できます。
FeCl3やFeBr3などのルイス酸触媒では空の軌道があります。この空の軌道に塩素原子または臭素原子が結合し、求電子剤が生成されます。
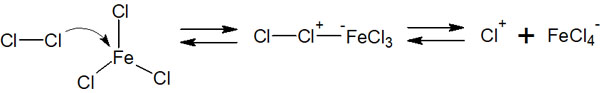
その後、ベンゼン環が求電子剤を攻撃することでハロゲン化されます。反応機構は以下になります。

ハロゲン化についても、ニトロ化やスルホン化と同様に求電子剤によって芳香族求電子置換反応が進行します。違いとしては、硫酸ではなくルイス酸触媒としてFeCl3やFeBr3を利用することがあります。
アルキル化をフリーデルクラフツ反応で行う
重要なのは、ルイス酸触媒を利用することで塩素原子や臭素原子が触媒に取り込まれ、強力な求電子剤を生じる事実です。この性質を利用すれば、ベンゼン環のアルキル化が可能になります。これをフリーデルクラフツアルキル化反応といいます。
フリーデルクラフツアルキル化反応では、ルイス酸触媒としてAlCl3やAlBr3を使用します。これらの触媒とハロゲン化アルキルを試薬として利用すれば、ベンゼン環をアルキル化できます。
反応機構はハロゲン化とほぼ同じです。最初にルイス酸触媒とハロゲン化アルキルが反応し、以下のようなカルボカチオン(求電子剤)が生成されます。
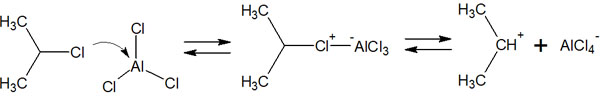
その後、ベンゼン環が求電子剤を攻撃してアルキル化が完了します。
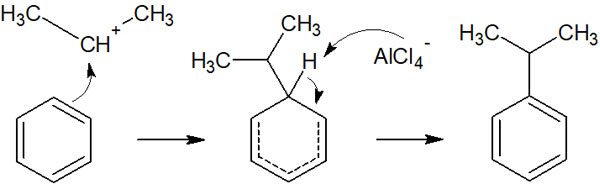
求電子剤が生成する反応機構はハロゲン化と同じです。また、芳香族求電子置換反応の反応機構も同じです。違いとしては、ルイス酸触媒を用いてベンゼン環をアルキル化できることがあります。
フリーデルクラフツアルキル化反応での転移反応
なお、フリーデルクラフツアルキル化反応では注意点があります。それは転移反応です。中間体としてカルボカチオンを経由するため、転移反応を起こすことがあるのです。
カルボカチオンの中間体には安定性の順番があります。以下のような順番になっています。
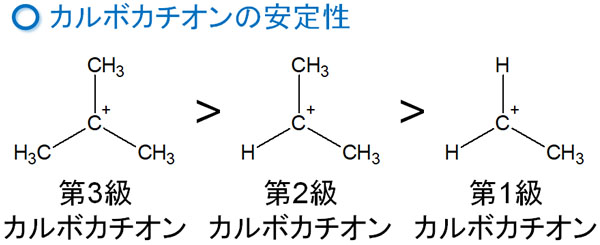
そのためカルボカチオンが生成された後、水素原子が隣の炭素に移動することで、より安定なカルボカチオンが生成されます。例えば、以下のようになります。
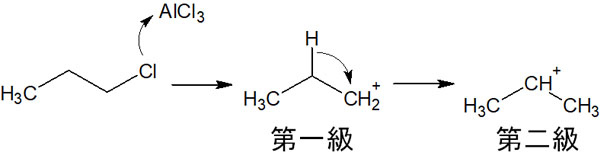
ルイス酸触媒と反応させることで、最初は第一級カルボカチオンが生成されます。ただ、この状態よりも水素原子が隣の炭素原子に移動し、第二級カルボカチオンになったほうが中間体は安定です。そのためより安定なカルボカチオンになるため、水素原子が転移します。
カルボカチオン転移が起こるため、予想していた化合物とは異なる生成物を得られることがあります。これには、カルボカチオン転移が関係しています。
・多置換の化合物生成が問題になりやすい
なおフリーデルクラフツアルキル化反応で注意しなければいけないのは、多置換のベンゼン環が合成されやすいことです。
炭素は電子を押し出すことで知られています。そのためベンゼン環にアルキル鎖が結合すると、芳香環の電子密度は高まります。その結果、ベンゼン環の反応性が高まることで一つの置換基が結合した化合物だけでなく、以下のような多置換の化合物を得られることが頻繁にあります。
ベンゼン環のアルキル鎖はオルト・パラ配向性です。そのため、オルト位またはパラ位にアルキル鎖の置換基をもつ化合物が生成されます。
この状況を回避したい場合、ベンゼンの量を多くします。ベンゼンが過剰に存在する場合、アルキル化によって生成された化合物よりも試薬はベンゼンと反応する確率が高いです。その結果、多置換ベンゼンの合成を避けられます。
ベンゼン環へのアシル化:フリーデルクラフツアシル化
またアルキル化だけでなく、フリーデルクラフツ反応はアシル化でも用いられます。これをフリーデルクラフツアシル化反応といいます。
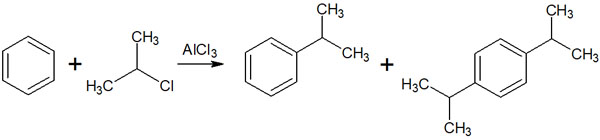
フリーデルクラフツアシル化反応では、ハロゲン化アシルを試薬として利用します。ルイス酸であるAlCl3を加えることで、フリーデルクラフツ反応が進行します。求電子剤が生成する反応機構は以下になります。
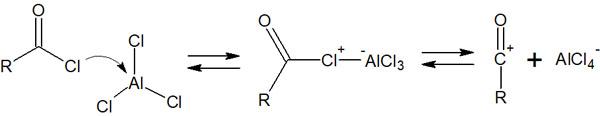
求電子剤としてアシルカチオンが生成されます。その後、以下のように芳香族求電子置換反応が進行します。
フリーデルクラフツアシル化反応については、これまでの内容を理解していれば反応機構は単純です。反応機構は同じであり、違いは試薬として塩化アシル化合物を利用するだけだからです。
・酸無水物を用いたフリーデルクラフツアシル化反応
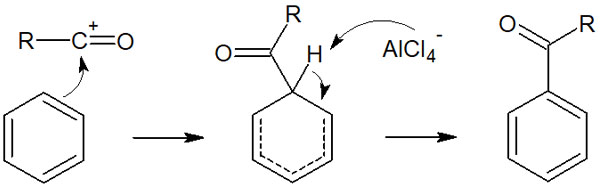
なおフリーデルクラフツアシル化反応では、ハロゲン化アシルだけでなく、酸無水物もフリーデルクラフツアシル化反応を起こします。
塩化アシルと塩化アルミニウム(AlCl3)が反応することで、アシルカチオンが生成されます。つまり求電子剤であるアシルカチオンが生成されれば、フリーデルクラフツアシル化反応が進行すると分かります。そうしたとき酸無水物とAlCl3が反応すると、以下のようにアシルカチオンが生まれます。
このようにしてアシルカチオンが生まれ、先ほど説明したフリーデルクラフツアシル化反応が起こります。反応機構は同じなので説明は省略します。
・アシル基が2つになることはない
先ほど、フリーデルクラフツアルキル化反応で多置換の化合物が生成すると説明しました。一方でフリーデルクラフツアシル化反応の場合、アシル基が2つベンゼン環に結合することはありません。
アシル基が芳香環に結合したとき、アシル基は求電子性の官能基になります。そのためベンゼン環の電子密度を下げ、芳香環の反応性は弱くなります。これが、フリーデルクラフツアシル化反応で多置換化合物の生成を心配しなくてもいい理由です。
ベンゼン環の求電子置換反応は反応機構が同じ
最も重要な分子の一つがベンゼン環です。ベンゼン環を有する有機化合物は多く、どのようにすれば芳香環に置換基を入れられるのか理解することは重要です。
ただ、芳香環はアルケンの二重結合とは性質が異なります。芳香環では付加反応は起こらず、求電子置換反応が起こります。芳香族性が失われることはなく、化学反応した後はベンゼン環が再生され、生成物を得られます。
あらゆる芳香族求電子置換反応で反応機構は同じです。そのため、ニトロ化やスルホン化、ハロゲン化、フリーデルクラフツアルキル化反応、フリーデルクラフツアシル化反応と種類は違うものの、反応機構を理解するのは簡単です。
ただ転移反応や配向性、多置換化合物の生成には注意しましょう。このようにして、ベンゼン環に置換基を入れることができます。






