有機化合物の中には、二重結合を有することがよくあります。アルカンとして単結合だけを有するのではなく、分子がアルケンなのは普通です。
こうした二重結合は有機合成によって作り出すことが可能です。その方法の一つが脱離反応です。塩基性を有する試薬と一緒に反応させることで、二重結合を有する化合物を創出できるようになります。これを脱離反応といいます。
脱離反応には大きく3種類あり、そのうちの2つがE1反応とE2反応です。特に重要になるのはE2反応ですが、こうした合成反応を利用することでアルケンを創出できます。
それでは、脱離反応はどのような合成反応なのでしょうか。反応機構がどうなっているのかを含め、できるだけ分かりやすく簡単に解説していきます。
もくじ
脱離反応では、アルカンから二重結合が作られる:β脱離
脱離反応は何かというと、先ほど述べた通り二重結合を作る合成反応になります。アルカンからアルケンを作るとき、頻繁に用いられる手法です。
二重結合を作る合成反応なのに、なぜ脱離反応という名前なのでしょうか。それは、分子の中にある置換基が脱離することで、二重結合を作るからです。
脱離反応では、塩基性物質によって水素が引き抜かれます。それだけでなく、隣の炭素に結合している脱離基が脱離していきます。その結果、二重結合が作られます。こうした有機化学の合成反応が脱離反応です。
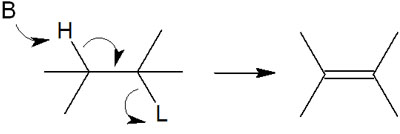
※Bは塩基(Base)、Lは脱離基(Leaving group)を意味しています。
水素がなくなる炭素原子をα位とすると、隣の炭素原子はβ位となります。β位にある脱離基が脱離していくため、この反応をβ脱離といいます。
脱離反応は3種類ある
なお前述のように、脱離反応には3種類あります。塩基性物質によって水素原子が引き抜かれ、二重結合を作りながら脱離基が脱離していくのは共通しています。ただ、反応機構がそれぞれ異なっています。以下の3種類になります。
- E1反応:最初に脱離基が脱離し、その後に水素原子が引き抜かれれる
- E2反応:脱離基の脱離と水素原子の引き抜きが同時に起こる
- E1cB反応:最初に水素原子が引き抜かれ、その後に脱離基が脱離する
それぞれの反応では、水素原子がどのタイミングで引き抜かれるのかが異なっています。
二重結合を作るという意味では、どれも同じです。しかし反応機構が異なるため、有機化学では明確に分けたうえで学ばなければいけません。
E1反応によるアルケンの反応機構
まず、E1反応から確認していきましょう。E1反応が起こるためには、最初に脱離基が脱離するのがスタートです。以下のようになります。
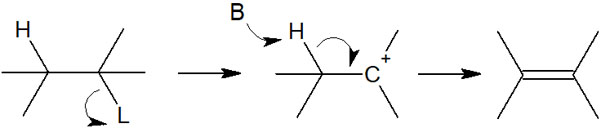
脱離基(L)が分子から離れることで、中間体としてカルボカチオンを生じるようになります。E1反応では、どれだけ素早くカルボカチオンを生成するのかが反応スピードに関わってきます。塩基性の強さや試薬の濃度は反応速度に関係なく、反応速度はカルボカチオンに依存すると考えましょう。
カルボカチオンさえ生成すれば、すぐに水素が引き抜かれ、二重結合を作るようになります。E1反応では、中間体が生成されたあと、二重結合を作る二段階の脱離反応となっています。
カルボカチオンの安定性がE1反応で重要
E1反応では最初にカルボカチオンが生成されることから、どれだけカルボカチオンが安定になれるのかが反応速度に大きく影響しています。
カルボカチオンは不安定な中間体であることは間違いありません。ただ、ある程度は中間体が安定でなければ、そもそも中間体が生成されることはありません。中間体のカルボカチオンが安定だからこそ、E1反応が進行するといえます。
こうしたカルボカチオンには安定性に順番があります。以下のようになっています。
- 第三級 > 第二級 > 第一級
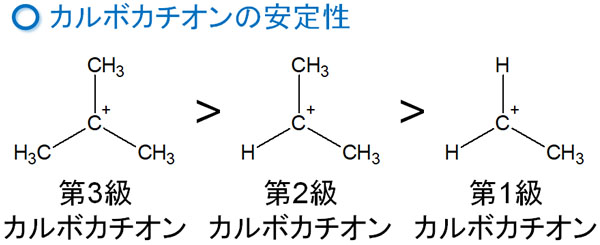
第一級カルボカチオンやメチルカルボカチオンが生成することはありません。非常に不安定だからです。一方、第三級カルボカチオンであれば自然に生成されます。第二級カルボカチオンについては、少しながら発生します。
ただE1反応で考えると、ほぼ第三級カルボカチオンがメインだと理解しましょう。アルキル鎖が3つ結合しているカルボカチオンにてE1反応が進行します。
ザイツェフ則(Saytzeff則)で合成化合物を得る
なお、E1反応で得られる化合物はどのような二重結合となるのでしょうか。先ほど、水素が引き抜かれることでアルケンが生成すると説明しました。ただ、水素が引き抜かれる位置が違うことで、以下の2種類の化合物が生成されるようになります。
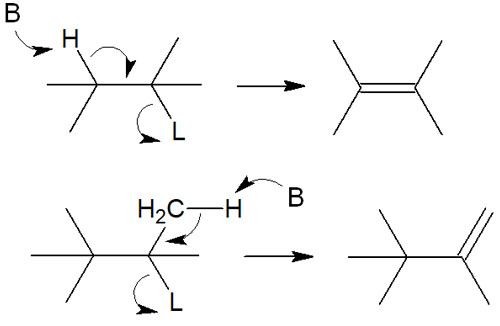
また分子に着目すると、一方は水素原子2つであり、もう一方は水素原子6個です。そのため確率を考えると、水素原子6つのほうが水素を引き抜かれる確率は高いといえます。

しかも水素原子2つの方では、水素原子を引き抜くために塩基は分子の内部に侵入しなければいけません。一方で水素原子6つのほうでは、外にむき出しで存在している水素原子を引き抜くだけなので簡単です。そのため、水素原子6つのほうで合成反応が進むように思えてしまいます。
しかし実際には、水素原子2つのほうでE1反応が進みます。これはなぜなのでしょうか。
有機化学の自然法則として、ザイツェフ則(Saytzeff則:セイチェフ則)が知られています。ザイツェフ則とは、「アルケンが作られるとき、多くの置換基が存在するように合成反応が進む法則」を指します。その結果、多くの置換基が存在するアルケンが合成されます。
ザイツェフ則が優先される理由としては、中間体の遷移状態が安定になりやすいことが挙げられます。置換基が少ないアルケンよりも、置換基の多いアルケンのほうが活性化エネルギーは少なくて済みます。反応に必要なエネルギーが少ないため、多置換アルケンの合成が優先されます。
有機合成で多置換アルケンが安定な理由は超共役
それでは、なぜ置換基の多いアルケンは安定になりやすいのでしょうか。この理由について、分かりやすく説明されているケースはほぼありません。
少し内容は難しくなるため、「脱離反応ではザイツェフ則により、多置換アルケンが生成する」とだけ覚えてもいいです。そのためこの部分を読み飛ばすのは問題ありません。ただより詳しく理由を知りたい場合、多置換アルケンが安定となるメカニズムを学ぶといいです。
アルケンの安定性では、以下の順番になっています。
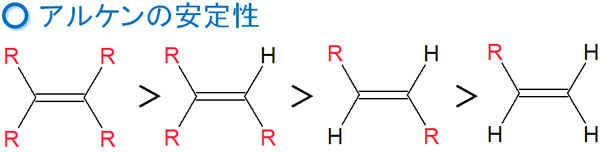
ザイツェフ則では、この安定性の順番が重要になります。この順番になる理由の一つに超共役があります。それでは、超共役とは何なのでしょうか。
「電子は広い範囲の分散したほうが安定化しやすい」と一般的に知られています。共役構造を書ける場合、安定になることは有機化学を勉強している人は全員が理解しています。これは、非局在化によって電子がいろんな場所に存在できるからです。
二重結合がある場合、そこには必ずπ結合が存在します。単結合はσ結合ですが、こうしたσ結合に対して、垂直に伸びた状態での結合がπ結合です。
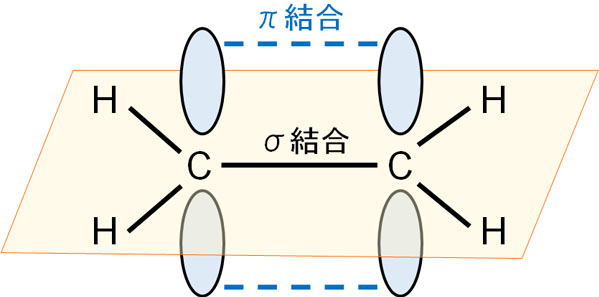
二重結合があったとしても、炭素原子に結合しているのが水素原子であれば、相互作用することはできません。
一方で、水素原子ではなくアルキル鎖が置換基として結合している場合はどうでしょうか。この場合、C-H結合と二重結合のπ結合が平行になります。平行になった結果、お互いの電子を弱いながらも共有します。
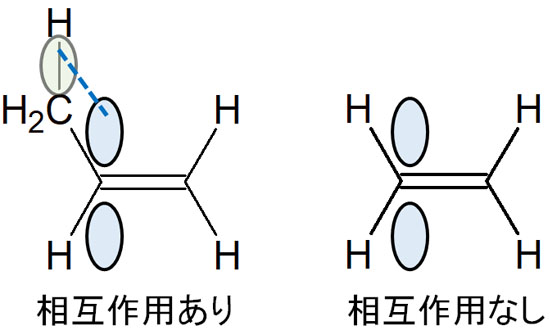
これが超共役です。共役構造のように、共鳴構造を書くことで電子が広い範囲で分散しているわけではありません。ただ軌道が平行になることで、弱く電子を共有するのが超共役です。超共役の影響により、アルケンでは多くの置換基を有するほうが安定になっています。
これらの理由から、脱離反応によって二重結合を作るときはザイツェフ則に従うというわけです。
かさ高い塩基の場合は立体障害でホフマン脱離(Hofmann脱離)
ちなみに脱離反応によっては、ザイツェフ則を無視することがあります。多くの置換基を作るのではなく、少ない置換を作るように脱離反応が進行するのです。これをホフマン脱離(Hofmann脱離)といいます。
どのようなときにザイツェフ則ではなく、ホフマン脱離を起こすのでしょうか。これは、かさ高い求核剤(立体障害の大きい塩基)を利用したときに起こります。かさ高い塩基としては、例えばtert-ブトキシド(tert-Butoxide)があります。
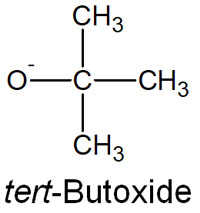
一般的な塩基とは異なり、多くのメチル基が結合しているのでtert-ブトキシドは立体障害が大きいです。こうしたかさ高い求核剤(塩基)を利用する場合、ザイツェフ則に従って反応が起こるのは困難です。先に説明した通り、分子の内部にある水素原子を引き抜く必要があるからです。
立体障害のため、分子の内部にある水素原子を引き抜くことはできません。一方で分子の外側に結合している水素原子であれば、かさ高い求核剤であっても問題なく引き抜くことができます。
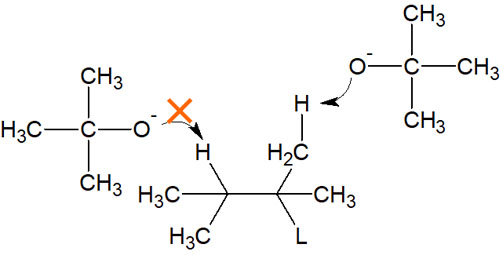
通常、塩基としては立体障害の少ない試薬を使います。そのため、ザイツェフ則に従います。一方で立体障害の大きい塩基を利用する場合、ホフマン脱離(Hofmann 脱離)によって置換基が少ないアルケンを作ることができます。
E2反応は一段階反応であり、求核剤が反応速度に関わる
一方でE2反応はどのようになっているのでしょうか。E2反応では、以下の反応が同時に発生します。
- 求核剤(塩基)が水素原子を攻撃する
- 脱離基が脱離する
E1反応では、最初に脱離基が脱離するのがスタートです。一方でE2反応では、これらの反応が同時に起こることで二重結合が作られるようになります。そのため、以下のような反応が一度に起こります。
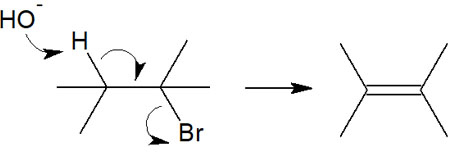
カルボカチオンが生成されることはないため、E2反応ではカルボカチオンの安定性は関係ありません。第三級、第二級、第一級とすべてのアルキル基でE2反応が起こります。中間体が存在しないため、E2反応は一段階の離脱反応になります。
また反応が一回で起こるため、E2反応の反応速度には求核試薬(塩基性の化合物)と反応分子の両方が関わります。
アンチ脱離(アンチペリプラナー)により合成反応が進行する
それではE2反応で重要なことは何でしょうか。それは立体化学です。
アルキル鎖が結合している化合物で二重結合が新たに作られるとなると、2種類の化合物が作られるようになります。いわゆるE/Z異性体であり、シス・トランスの2種類があります。これについて、E2反応では以下のうちどちらの化合物が生成されるのでしょうか。
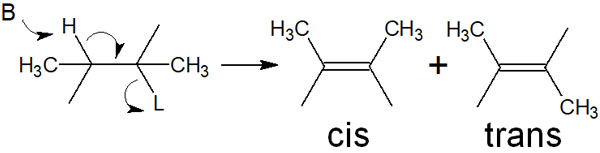
これを理解するためには、以下の2つを学ばなければいけません。
- E2反応はアンチペリプラナーで起こる
- 立体障害が少ない配置でアンチ脱離する
まず、アンチペリプラナーから確認していきましょう。ニューマン投影式で考えると、立体化学では以下の2つの立体配座を考えることができます。
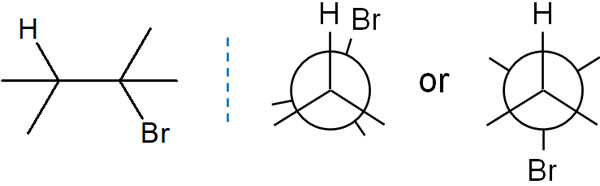
水素原子と脱離基である臭素原子が同じ位置にある場合、シンペリプラナーといいます。重なり合っている形であり、この場合はエネルギー状態が高く不安定です。
一方で水素原子と臭素原子が反対側にある場合、アンチペリプラナーといいます。この場合、互いの原子が重なっておらず、エネルギーが高い状態(不安定な状態)ではありません。さらに、アンチペリプラナーの状態のみ、軌道が完全に平行となります。
こうした理由から、アンチペリプラナーの状態になったときにE2脱離が進行します。これをアンチ脱離といいます。
立体障害を少なくするため、トランス(E体)が得られる
また、アンチ脱離する現象を理解できたものの、シス(Z体)とトランス(E体)のどちらが生成されるのでしょうか。これについて、E/Z異性体の中でもトランス(E体)がメインで生成されます。
ニューマン投影式で考えると、シス(Z体)ではメチル基が隣同士に存在していることになります。その結果、立体反発を起こすことでエネルギーが高くなります。
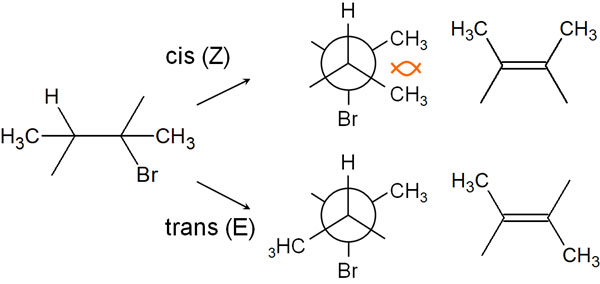
それに対して、トランス(E体)はどうでしょうか。トランスの場合、メチル基は反対側に存在しています。そのため立体反発がなく、この状態で脱離反応が起こりやすいです。脱離反応では、アンチ脱離を起こすことでトランス(E体)の生成物がメインで得られると理解しましょう。
シクロヘキサンはアキシアルの位置で脱離反応する
これら脱離反応での立体化学について理解すれば、シクロヘキサンでのE2反応の脱離機構を理解できるようになります。環状化合物として知られているシクロヘキサンでは、2つの立体配座を取ることができます。それがアキシアルとエクアトリアルです。
横の位置にあるのがエクアトリアルです。一方、上または下の位置にあるのがアキシアルです。このうち、E2反応が起こるのはアキシアルです。
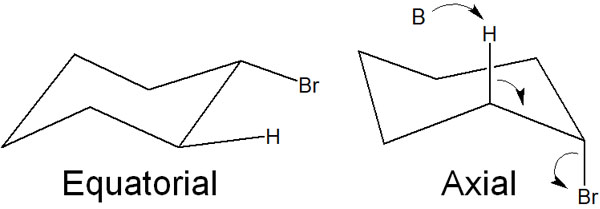
エクアトリアルでは、アンチペリプラナーの状態になることができません。つまり、E2反応は起こりません。そのため、必ずアキシアルで合成反応が進行します。
なおシクロヘキサンなど環状化合物の場合、ザイツェフ則に従わないことがあります。例えば、以下のようなケースです。
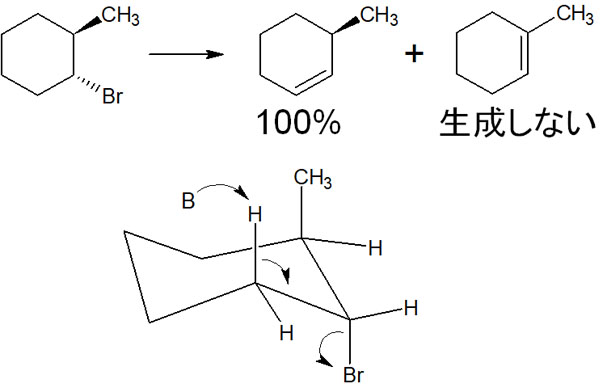
シクロヘキセンの合成をするとき、上図の化合物では、アキシアルになったときにアンチペリプラナーの位置になる水素原子は一つしかありません。その結果、ザイツェフ則に従わない化合物が合成されます。
SN1反応やSN2反応と競合するE1反応・E2反応
ここまで、E1反応とE2反応について確認してきました。脱離反応では、求核剤(塩基)を利用することで二重結合を作ります。
ただ求核剤を利用する場合、脱離反応だけではなく、求核置換反応を起こす可能性があります。求核置換反応としてはSN1反応やSN2反応が知られています。事実、脱離反応と求核置換反応は同時に起こることがよくあります。
そうしたとき、どのようなときにそれぞれの合成反応が起こるのかについて、見分けることができるのでしょうか。またE1反応やE2反応だけでなく、SN1反応やSN2反応についても確認しなければいけません。これについて、表としてまとめると以下のようになります。
| 第一級 | 第二級 | 第三級 | |
| 強い求核剤 | SN2 | SN2 | E1 or E2 or SN1 |
| かさ高い求核剤 | E2 | E2 | E2 |
| 強い塩基 | E2 (SN2) | E2 (SN2) | E2 |
| 弱い塩基 (プロトン性極性溶媒) | – | SN1 or E1 | SN1 or E1 |
上の表で重要な部分について、青字で記しています。どの反応が起こるのか予測するとき、青字に着目するようにしましょう。
反応条件によって、どの反応が進行するのかが変わります。なぜ、使用する求核剤によって合成反応が異なるのか確認していきます。
求核性が高く、立体障害が少ない場合はSN1反応またはSN2反応
反応させる試薬を考えるとき、求核性が高くて立体障害の少ない試薬ではSN1反応またはSN2反応が起こります。SN1反応やSN2反応では、求核剤は以下のように分子の内部に潜り込んで攻撃する必要があります。
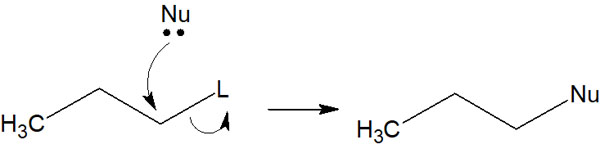
そのため、小さい分子(立体障害が少ない試薬)であるとSN1反応またはSN2反応を起こします。
強い求核性を有する化合物では、求核置換反応が優先するようになります。こうした求核性の強い物質には以下があります。
- CN–
- RS–
- I–
こうした求核剤を利用する場合、求核置換反応が主に進行します。
かさ高い求核剤や強塩基はE2反応
一方で、かさ高い求核剤を利用する場合、分子の内部に近づくことができません。その結果、E2反応を起こします。
かさ高い塩基を使うとき、どのような反応が起こるのかについては既に説明しました。一般的にE2反応はザイツェフ則(Saytzeff則:セイチェフ則)に従います。ただ立体障害があるため、tert-ブトキシドなどの試薬を用いる場合、ホフマン脱離(Hofmann 脱離)によって合成反応が進みます。
また、こうしたかさ高い塩基ではなかったとしても、強塩基を利用する場合はE2反応が進行しやすいです。
塩基性が強い場合、求核性も高くなりやすいです。そのためSN2反応も同時に起こります。ただ、一般的に強塩基は水素原子を攻撃します。炭素原子に攻撃して求核置換反応を起こすよりも、水素原子を引き抜いて安定な状態になるほうを好みます。
また求核置換反応では、分子の内部まで侵入して炭素原子を攻撃しなければいけません。それよりは、外にむき出しで存在している水素原子を攻撃するほうが容易です。そのため、強塩基であるほど求核置換反応ではなくE2反応が起こります。
特に第三級アルキル基では、立体障害によってSN2反応は起こりません。そのため、E2反応のみ起こります。
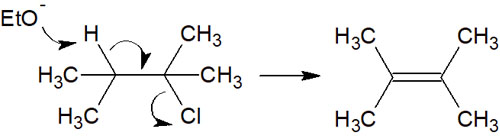
強い塩基を使うほど、また反応化合物の立体障害が高いほど、脱離反応が起こるようになると理解しましょう。
ただ、利用する強塩基試薬の分子量が小さく、反応化合物の立体障害が少ない場合、E2反応よりもSN2反応が優先されることがあります。例えば、ナトリウムメトキシド(CH3O-)やナトリウムエトキシド(CH3CH2O–)などは、強塩基ではあるものの非常に小さい分子です。
この場合は塩基性の強さだけでなく、反応化合物の立体障害や温度、化合物の状態など、あらゆる要素が関係するようになります。
弱い塩基でE1反応とSN1反応が起こる
一方で強塩基ではなく、弱い塩基にて合成反応するときがあります。弱い塩基としては、水やアルコール(メタノール、エタノール)、酢酸などがあります。これらはプロトン性極性溶媒とも呼ばれています。こうした条件ではE1反応とSN1反応が起こります。
E2反応やSN2反応では、強い求核性(強い塩基性)を有する試薬の利用が一般的です。ただE1反応やSN1反応では、求核剤の塩基性は反応速度に関係ありません。そうではなく、どれだけカルボカチオンを生成するのかが反応性に関与します。
そのため弱い塩基であっても反応が進んでいくのがE1反応とSN1反応です。なおカルボカチオンの水素原子は非常に酸性度が高いため、弱い塩基であっても問題なく水素原子を引き抜くことができます。
・E1反応とSN1反応の両方が起こる
そうしたとき、E1反応とSN1反応を分けることはできません。プロトン性極性溶媒を利用し、弱い塩基で反応させると、E1反応とSN1反応の両方が進行することで2つの化合物を得られるようになると考えましょう。例えば、以下のようになります。
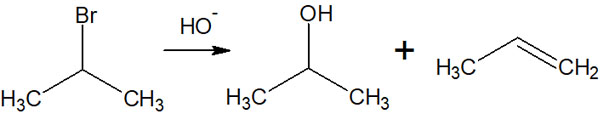
温度を高くするとE1反応が優先されるなど、反応条件によってE1反応とSN1反応の起こりやすさを変えることはできます。ただ、2つの反応が同時に進行する事実は変わりません。
共役によってアニオン生成が起こるE1cB反応
ここまで述べてきたことが脱離反応の大部分になります。これに加えて、E1cB反応についても理解するようにしましょう。最初に水素原子が塩基によって引き抜かれ、アニオンが生成するのがE1cB反応です。
どのような状況でE1cB反応が起こるのでしょうか。これは、脱離基の近くにカルボニル基(-CO)が存在するときと理解しましょう。例えば、以下のようになります。

カルボニル基では、隣接する炭素(α炭素)の酸性度が高いことが知られています。これは、α炭素に結合する水素原子が塩基によって引き抜かれ、以下のような反応を書けるからです。

要は、カルボニル基の隣にある水素は塩基によって簡単に引き抜かれ、アニオンになると考えましょう。
こうしてアニオンになった後、電子が戻るときに脱離基が脱離していきます。その結果、二重結合が形成されます。
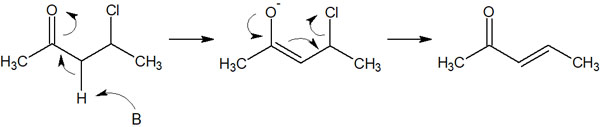
E1cB反応のcbとは、共役塩基(conjugate base)の略です。塩基が水素(プロトン)を引き抜き、すぐに二重結合が形成されるわけではありません。一度、共役塩基としてアニオンが生成されます。最初に脱プロトン化(水素原子の引き抜き)から始まるため、E1cB反応と呼ばれます。
なおE1cB反応の律速段階は「脱離基が脱離する部分」です。カルボニル基の隣にあるプロトンは酸性度が高く、塩基によって引き抜かれるのは容易です。その後、電子が戻るときに脱離基がどれだけ素早く脱離するのかが反応速度に関わります。
ちなみにカルボニル基のようにアニオンを安定化させる官能基が存在する場合、必ずE1cB反応が優先されます。あらゆる条件下にて、E1反応・E2反応・SN1反応・SN2反応よりもE1cB反応が起こると理解しましょう。
反応機構を理解し、脱離反応の違いを学ぶ
有機化学で非常に重要な合成反応として、SN1反応とSN2反応があります。ただこれら求核置換反応について学んだあとは、多くのケースで次に脱離反応を学ぶことになります。
求核置換反応と脱離反応は似ている部分が多いです。またここまで述べた通り、これらの反応が両方とも起こることがよくあります。そこで、どのような条件で反応が優先されるのか見極めなければいけません。
また同じ脱離反応であっても、求核剤(塩基)が違うことで生成される化合物が変化します。通常はザイツェフ則ですが、ホフマン脱離になることもあります。
これらの反応機構について、違いや反応条件、利用するべき試薬までを理解するようにしましょう。3種類の脱離反応を学び、利用する試薬(求核剤)によって反応の起こりやすさがどのように変化するのかを把握すれば、いつでもアルケンを合成できるようになります。