有機化合物には二重結合を有する分子が非常にたくさんあります。これらの分子は他の試薬と反応することで、付加反応を起こします。付加反応が起こることで、アルケンの二重結合が単結合へと変化し、生成物を得ることができます。
有機化学の反応では、アルケンの付加反応は基礎といえます。ただ、アルケンの付加反応にはいくつも種類があり、反応機構がそれぞれ異なります。そのため、どのように有機化学反応が進行するのかについて区別しなければいけません。
アルケンの付加反応では、マルコフニコフ則や反マルコフニコフ則、ヒドロホウ素化、ハロゲン付加など多くの反応を学ばなければいけません。
ただ有機反応が起こる理由を順に確認していけば、アルケンの付加反応が起こる理由や仕組みを理解できるようになります。ここでは、二重結合に対する付加反応のメカニズムを確認していきます。
もくじ
二重結合で生じる求電子付加反応
アルケン(二重結合)やアルキン(三重結合)に対して起こる有機化学反応の一つが付加反応です。
有機化学では、いくつかの反応機構が存在します。その中でも、反応化合物がすべて生成化合物の分子内に含まれる有機化学反応が付加反応です。付加反応としては、例えば以下のような合成反応があります。
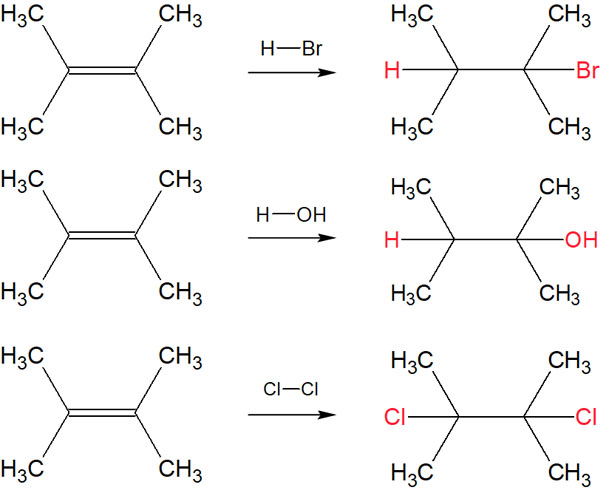
これらはすべて付加反応です。反応した化合物がすべて一つの分子内に存在しています。そのため、付加反応と呼ばれています。
また、付加反応は求電子付加反応とも呼ばれています。二重結合や三重結合では、単結合に比べて電子をたくさん保有しています。電子リッチの状態であり、電子不足の試薬(求電子試薬)に対して電子を提供し、化学反応を起こします。
HX(HBr)によるアルケンへの付加反応の反応機構
それでは、これらアルケンへの付加反応はどのような反応機構なのでしょうか。アルケンへの求電子付加反応では、HX(ハロゲン化水素)の付加反応が最も簡単なため、この反応機構の説明を最初にするのが一般的です。
Xはハロゲンを意味しています。そのためHXとは、HCl(塩化水素)やHBr(臭化水素)だと理解しましょう。アルケンへの付加反応では、特にHBrが例として頻繁に利用されます。
二重結合や三重結合があると、前述の通り電子が豊富に存在します。二重結合はπ結合(π電子)によって形成されています。π結合は弱い結合であり、他の分子に電子を与えることができます。
一方でハロゲンは電気陰性度が強い原子として知られています。そのためハロゲンに水素が結合していると、分子は大きく分極するようになります。HCl(塩化水素)やHBr(臭化水素)では、分子内でプラスとマイナスの電荷を有しています。
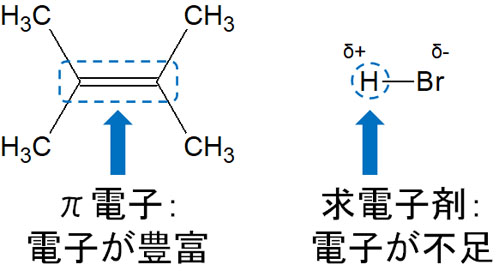
これらHClやHBrの水素原子はハロゲンに電子が吸い寄せられているため、電子不足の状態です。つまり、電子を強く求めています。HClやHBrは電子が不足しているため、求電子剤といえます。
これら求電子剤とアルケンが化学反応します。具体的には、二重結合を作っているπ電子が水素原子(電子不足の原子)を攻撃します。アルケンにプロトン(水素)が付加されるのです。その結果、中間体としてカルボカチオンを生じます。
例えばアルケンと臭化水素が反応すると、以下のようになります。

その後、先ほど生成した臭素イオンがカルボカチオンを攻撃します。生成した臭素イオンはマイナスの電荷を帯びており、さらには非共有電子対(ローンペア)があります。つまり、電子をたくさん有しています。
それに対してカルボカチオンはプラスの電荷を帯びており、電子を求めています。そのため臭素イオンはカルボカチオンを攻撃し、付加します。こうして、ハロゲン化アルキルの化合物が生成されます。
マルコフニコフ則:カルボカチオンの安定性
HXによるアルケンへの付加反応はこのように進行します。先ほどは分かりやすくするため、左右対称のアルケンを利用して説明しました。ただ、非対称のアルケンでは複数の化合物が生成されるように思えます。
例えば、以下のケースではどちらの化合物が生成されるでしょうか。
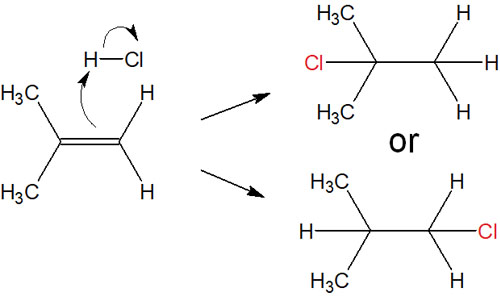
この問題について、アルケンへの求電子付加反応では生成する化合物が決まっています。付加反応では、アルキル基の少ない炭素原子に水素が付加します。この経験則をマルコフニコフ則といいます。
なぜ、マルコフニコフ則が起こるのでしょうか。これは、中間体のカルボカチオンに理由があります。カルボカチオンには安定性の順位があり、以下のようになっています。
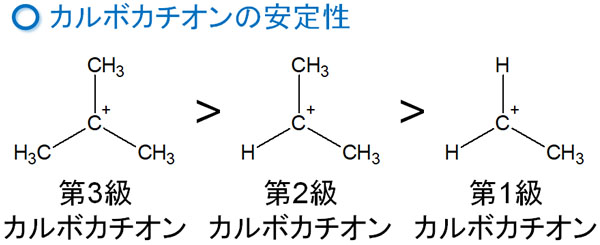
そのため中間体であるカルボカチオンが生成するとき、第三級カルボカチオンが優先的に作られます。また第三級カルボカチオンが生成しない場合、第二級カルボカチオンが作られます。
先ほどの付加反応を確認すると、中間体は以下のようになります。
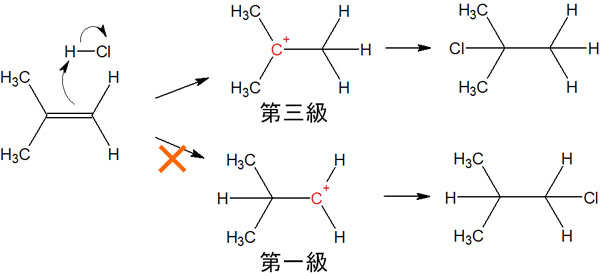
カルボカチオンの中間体を確認すると、一方は第三級カルボカチオンが生成し、もう一方は第一級カルボカチオンが生成します。
カルボカチオンの安定性では、第三級カルボカチオンが最も安定です。そのため第一級カルボカチオンではなく、第三級カルボカチオンが優先的に生成します。その結果、マルコフニコフ則に従ってアルケンへの付加反応が進行します。
・ザイツェフ則とは異なる法則
有機化学ではいくつか法則があります。その中の一つがマルコフニコフ則です。マルコフニコフ則はアルケンの付加反応で考慮するべき法則です。
ただ中には、マルコフニコフ則をザイツェフ則と混同する人がいます。ザイツェフ則は脱離反応で考慮するべき法則です。アルカンからアルケン(二重結合)を作る合成反応の代表が脱離反応です。マルコフニコフ則とザイツェフ則はまったく別物の法則であることを理解しましょう。
カルボカチオン転移でプロトンが移動する
カルボカチオンの安定性を理解することは、その他の有機化学反応を理解することにも役立ちます。マルコフニコフ則だけでなく、なぜ付加反応でカルボカチオン転移が起こるか理解できます。
二重結合に対して付加反応が起こるとき、プロトン(水素原子)が隣の炭素原子に移動することがあります。これをカルボカチオン転移といいます。プロトンが移動した結果、異なる化合物を生じるようになります。
例えば、以下のような有機化学反応が該当します。
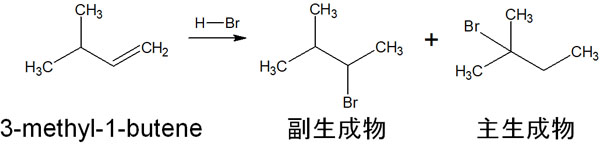
マルコフニコフ則に従って付加反応が起こる場合、上図の副生成物だけが生じるように思えてしまいます。ただ実際には、異なる化合物を生じます。なぜ、このような有機化学反応になるのでしょうか。この理由がカルボカチオン転移です。
カルボカチオンはより安定な構造になることを考えます。そのためカルボカチオン中間体が生成された後、プロトン(水素原子)が隣の炭素に移動します。今回の合成反応であれば、カルボカチオン転移によって第二級カルボカチオンから第三級カルボカチオンになります。
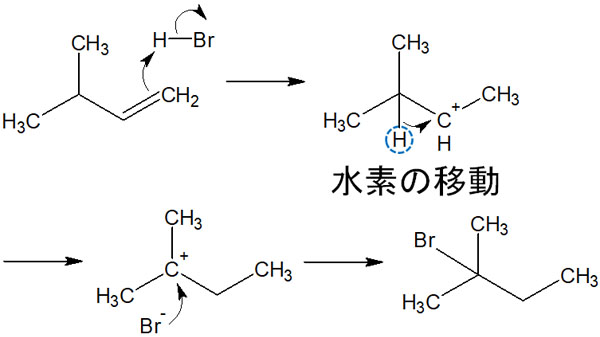
その後、第三級カルボカチオンにハロゲンが攻撃することで主生成物を得ることができます。
より安定なカルボカチオンを生じる場合、カルボカチオン転移が起こります。またカルボカチオン転移は、隣にある水素原子のみ移動します。プロトン(水素原子)であれば、あらゆる部分から移動するわけではないことを理解しましょう。
アルケンへの水の付加反応(水和)
HXによる反応機構を学んだ後は、水の付加反応を理解できるようになります。水は試薬の一種として考えることができ、水とアルケンの付加反応が起こるのです。
ただ水は弱い酸であり、カルボカチオンを生成させることができません。つまり、アルケンへの水の付加(水和)は起こりません。そこで酸触媒として硫酸(H2SO4)などを加えることで、水の付加反応が進むようになります。
酸触媒(硫酸など)が存在すると、オキソニウムイオン(H3O+)が生成されます。オキソニウムイオンは強酸なので、アルケンにH+を与えることができます。
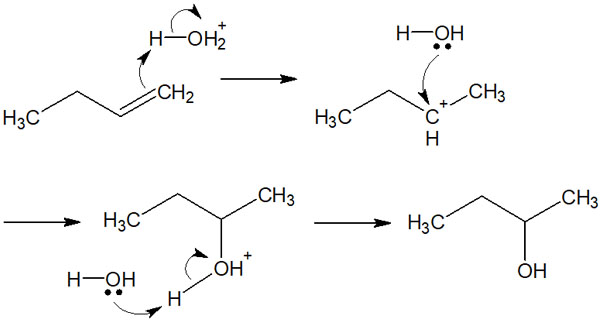
その後、マルコフニコフ則による位置選択性に従って付加反応が進みます。酸触媒が必要なこと以外は、水の付加反応はHXの付加反応と同じだと理解しましょう。
強酸触媒を用いた化学反応なので、水溶液中にOH–は存在しません。そのため、今回の水和反応ではオキソニウムイオン(H3O+)と水分子のみが化学反応に関与します。
アルコールの付加反応の反応機構
このように理解すると、HXによる付加反応も水の付加反応も反応機構はほぼ同じだと理解できます。水の場合、酸触媒が必要なだけです。
この事実を理解すれば、アルコールの付加反応の反応機構が分かるようになります。先ほど、水による付加反応(水和)を解説しました。これが水ではなく、メタノールやエタノールなどのアルコールを溶媒として利用すれば、アルコールによる付加反応が進行します。
水の付加反応と同じく、アルコールの付加反応では酸触媒を利用します。そうすると、アルコールと酸触媒が反応することで、アルコールにH+が結合します。
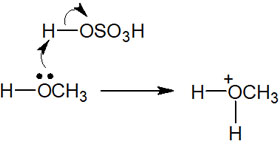
その後は、水の付加反応とまったく同じ反応機構によってアルコールの付加反応が進行します。以下のようになります。
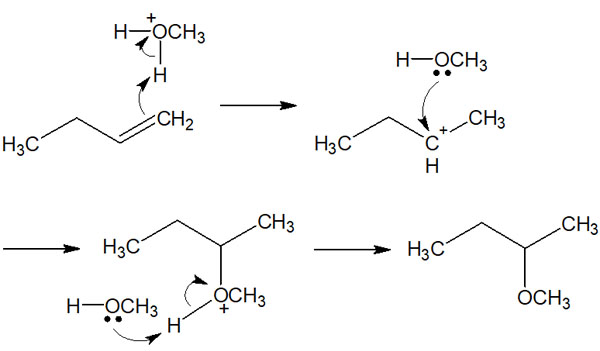
アルケンへの付加反応を理解すれば、あらゆる化合物を合成できるようになります。反応させる試薬を変えるだけで、得られる生成物を変化させられると理解しましょう。
ヒドロホウ素化での酸化反応:反マルコフニコフ則
ここまでマルコフニコフ則に従う化学反応について解説してきました。これら水やアルコールを利用した合成反応では、どれもマルコフニコフ則が優先されるため、多置換のアルカンが合成されます。それでは、少ない置換基のアルカンを合成することはできないのでしょうか。
マルコフニコフ則に従わない付加反応として、反マルコフニコフ則があります。反マルコフニコフ則にはいくつか種類があり、代表的な有機化学反応がヒドロホウ素化によるアルコール合成です。
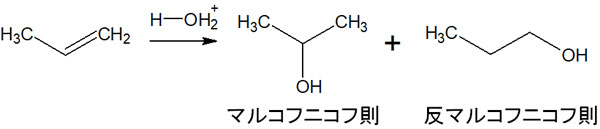
それでは、反マルコフニコフ則になるヒドロホウ素化とは、どのような化学反応なのでしょうか。ヒドロホウ素化とは、アルケンに対してボラン(BH3)が付加する反応を指します。
ボランはルイス酸であることが知られています。ボランには空のp軌道が存在し、電子を受け入れることができます。ボランはルイス酸であり、アルケンの二重結合に存在する電子を受け入れる強力な求電子試薬です。
ただボランがアルケンに付加するとき、マルコフニコフ則とは逆の付加反応が起こります。以下のようになります。
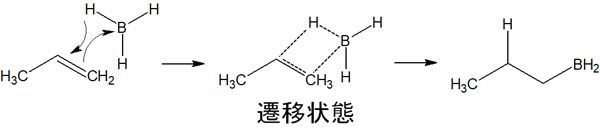
ボランが付加反応を起こすとき、中間体のカルボカチオンは生成しません。そのためカルボカチオンの安定性は関係なくなり、反マルコフニコフ則になります。
それでは遷移状態のとき、なぜ反マルコフニコフ則になるのでしょうか。これには立体障害が関与しています。置換基の少ない炭素原子のほうが立体障害は少ないです。そのため、ホウ素原子は置換基の少ない炭素原子と結合します。
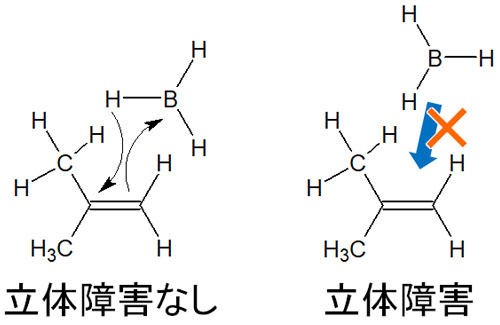
立体障害の少ない条件で付加反応をするため、ヒドロホウ素化は反マルコフニコフ則になります。カルボカチオンを生成しないため、前述の通りカルボカチオンの安定性は関係ありません。当然、カルボカチオン転移も起こりません。立体障害により、反マルコフニコフ則が起こります。
なお、反マルコフニコフ則によってボランを付加させた後、アルキルボランに対して過酸化水素(H2O2)などを利用して酸化させます。
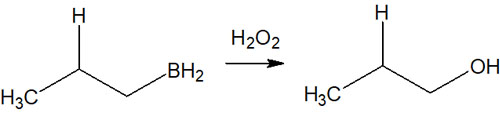
ヒドロホウ素化はアルコール合成で頻繁に利用されます。ヒドロホウ素化によってアルキルボランを合成後、過酸化水素によって酸化することで、アルキルボランがヒドロキシ基(-OH)になります。こうして、アルコール合成が可能になります。
ハロゲンによるアンチ付加反応
ここまでの内容を理解した後は、ハロゲンによる付加反応を説明していきます。なぜハロゲンによるアルケンの付加反応が重要なのでしょうか。それは、立体化学が関与するからです。これまでの説明では立体化学を考慮してきませんでしたが、ハロゲンを例に立体化学を考えていきましょう。
Cl2やBr2などのハロゲンが付加反応するとき、アンチ付加を引き起こすことが知られています。同じ側に付加する場合、シン付加といいます。一方で、反対側で付加反応が起こる場合をアンチ付加といいます。
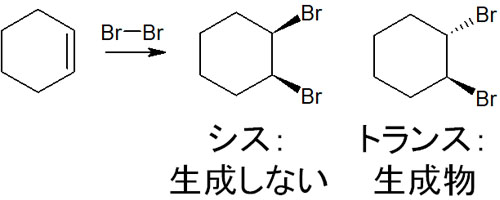
シン付加ではなく、ハロゲンは必ずアンチ付加です。なぜ、アンチ付加になるのでしょうか。
ハロゲンが二重結合に付加するとき、カルボカチオンを生成せずに反応が進行します。ヒドロホウ素化と同じように、同時に反応が進みます。またハロゲンの反応では、環状のイオン中間体を生じます。例えばブロモを反応させると、環状ブロモニウムイオンが中間体として生成されます。
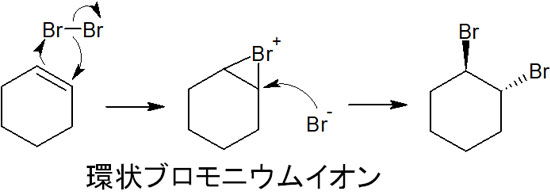
その後、ブロモイオンが反対側から攻撃します。これにより、シン付加ではなくアンチ付加によって合成反応が進行します。立体選択的にハロゲンイオンが攻撃するため、立体化学を考慮した化学反応になると理解しましょう。
なお前述の通り、カルボカチオンの中間体は生成しません。そのため、ハロゲンの付加ではカルボカチオン転移は起こりません。
・キラル中心ができる場合、立体選択が重要
ハロゲンによる付加反応がアンチ付加であることは立体化学で重要です。光学異性体としてキラル中心ができる場合、分子がどのような立体になるのかを考えなければいけません。
カルボカチオン中間体が生成される場合、キラル中心のある化合物はラセミ化します。カルボカチオンが生成された後、上または下から化合物(求核剤)が攻撃するからです。ラセミ体となるため、キラル中心のある化合物では2つの光学異性体が混ざってしまいます。
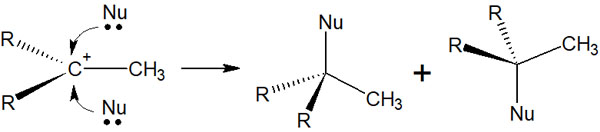
一方でハロゲンによる付加反応では、前述の通りアンチ付加のみ起こります。そのためラセミ化はせず、キラル中心があったとしても特定の化合物のみ得ることができます。
水やアルコールが溶媒でトランス化合物を合成する
このハロゲン反応を応用すると、アルコールやアルコキシ化合物を合成できるようになります。アンチ付加によってトランス体の化合物を得られます。
これらの合成では、溶媒として例えば水やアルコール(メタノール、エタノールなど)を利用します。そうすれば、ブロモニウムイオンではなく水またはアルコールが中間体を攻撃することで、アルコールを得られるようになります。
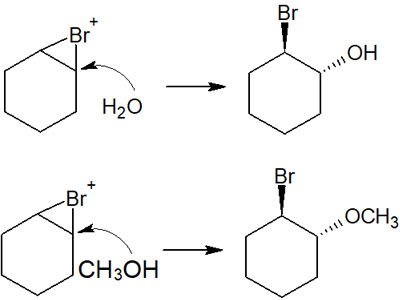
溶媒として水を使えば、ヒドロキシ基(-OH)が置換基になります。一方でメタノール(CH3OH)が溶媒であれば、メトキシ基(-OCH3)が付加します。利用する溶媒によって、合成したい化合物を変化させることができます。
なぜブロモニウムイオンではなく、水やメタノールが攻撃するのでしょうか。この理由としては、水やメタノールを溶媒として利用しているからです。
溶媒であれば、化合物の周辺には非常に多くの水(またはアルコール)が存在しています。そのため低濃度のブロモニウムイオンではなく、溶媒が求核攻撃する可能性のほうが高いです。そのため、こうした化合物を得られるようになります。
ヒドロホウ素化と水素接触還元はシン付加
なお立体化学で考えると、ヒドロホウ素化・酸化によるアルコール合成はシン付加であると分かります。ボランを用いて合成反応させるとき、カルボカチオン中間体なしにシン付加するのがボランです。その後、酸化させることでアルコールを得られます。
他の付加反応としては、水素を用いた接触還元はシン付加であると知られています。
接触還元では、空気中に水素を満たした状態でパラジウム炭素を加え、還元反応させます。水素がパラジウム炭素に吸着し、このときにシン付加を起こします。
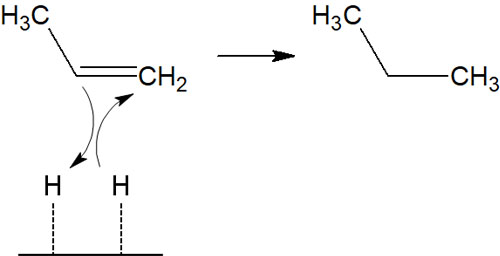
シン付加のみ進行するため、キラル中心があったとしてもラセミ化しません。またカルボカチオン中間体なしに、水素の付加反応が進行します。
キラル中心がない場合、シン付加やアンチ付加による違いを考慮する必要はありません。ただ反応後にキラル中心が生成する場合、立体化学が重要になります。
アルケンの付加反応が起こる理由と位置選択性を学ぶ
高校化学であれば、有機化学反応が起こった後に生成される化合物を覚えるだけでいいです。ただ大学の有機化学では、反応機構を理解しなければいけません。そうしたとき、有機化学の初歩としてアルケンの付加反応があります。
基本的な内容とはいっても、付加反応には有機化学でさまざまな反応の種類があります。また合成反応を実施するとき、付加反応を利用する有機化学者は非常に多いです。反応試薬を変えるだけで、あらゆる化合物の合成が可能になるからです。
なお、反応の種類は多いです。さらにはマルコフニコフ則やシン付加・アンチ付加の違いを理解する必要があります。さらには、位置選択性まで学びましょう。ただ、反応機構はどれも似ています。
それぞれの反応がどのように進行するのか理解しましょう。ここでは可能な限り、分かりやすく付加反応を簡単に記したため、これら有機化学の基本を理解するようにしましょう。