酸素原子が関わる有機化合物は非常に多いです。これら化合物の中でも、酸素原子によって炭素原子がつながっている官能基としてエーテルがあります。
エーテルを用いた重要な有機反応は種類が少なく、酸性条件下での開裂反応を理解すれば問題ありません。つまり、エーテルを開裂させて1つの分子を2つに分けます。
またエーテルの中でも、三角形の環状化合物の場合はエポキシドと呼ばれるようになります。有機化学でエポキシドは重要な化合物であり、どのようにエポキシドを合成し、その後にどう反応させることで目的化合物を得られるのかについて理解しなければいけません。
そこでエーテルやエポキシドの合成反応について、どのような生成物を得られるのか解説していきます。
もくじ
酸触媒で開裂するエーテル
反応性が低いために、そのままの状態では化学反応しにくい官能基があります。その一つがエーテルです。酸素原子は炭素原子と強力に結合しており、結合が開裂することはありません。そのため、エーテルを化学反応させるためには、エーテルを活性化しなければいけません。
どのようにすれば、エーテルを活性化することができるのでしょうか。この方法として、酸触媒の利用があります。硫酸(H2SO4)や塩化水素(HCl)、臭化水素(HBr)などの酸触媒を加えることで、エーテルを活性化させることができます。
なぜ、酸触媒が存在すればエーテルが活性化するのでしょうか。酸が存在することで、エーテルの酸素原子に水素原子(プロトン)が結合します。H+が結合した結果、エーテルはプラスの電荷を帯びるようになります。
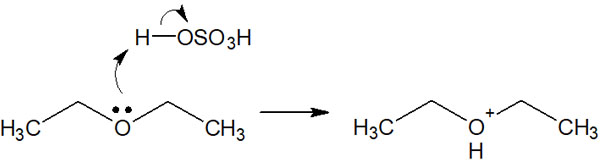
プラスの電荷を帯びた酸素原子は優れた脱離基になります。そのため、エーテル開裂によって2つの分子に分かれるようになります。
位置選択性はカルボカチオンの安定性で考える
酸触媒によってエーテル開裂するとき、複数の種類の化合物を得られるように思えてしまいます。例えば以下の化合物であれば、臭化水素を反応させるとき、強酸条件下では以下の2つの化合物が中間体として生成されるように思えます。
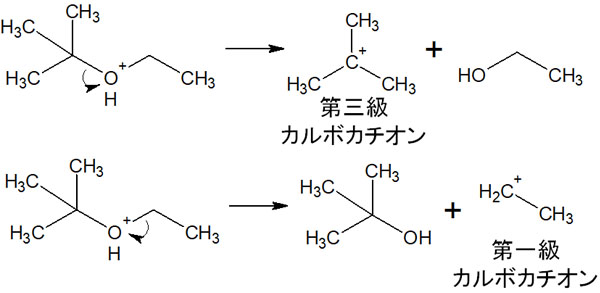
ただ実際の合成反応では、1つの中間体しか生成されません。そのためいくつも化合物が合成されることはなく、特定の化合物のみ合成することができます。
なぜ、一つの中間体しか生成されないのでしょうか。これは、中間体であるカルボカチオンの安定性が関与しています。カルボカチオンの安定性は以下のようになっています。
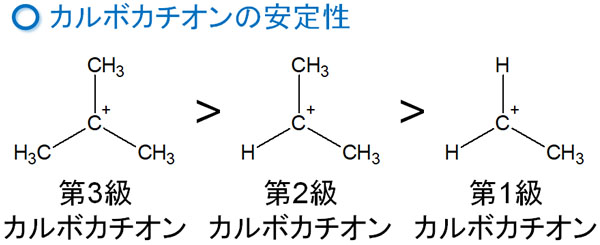
先ほどの化合物であれば、酸によってエーテルが活性化された後、第三級カルボカチオンまたは第一級カルボカチオンが生成されます。ただ第三級カルボカチオンのほうが安定性は高いため、第三級カルボカチオンが優先的に生成されます。
その結果、特定の化合物のみ合成できます。
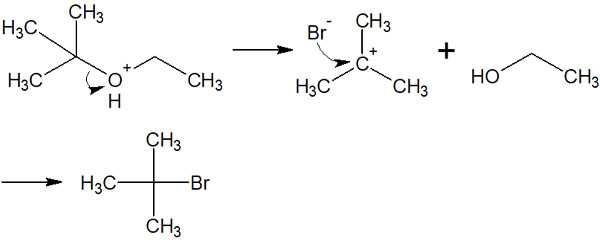
このようにエーテルの開裂反応では位置選択性があります。塩化水素(HCl)や臭化水素(HBr)など、ハロゲン化水素を酸触媒として利用したとき、エーテル開裂が起こる場所は決まっています。
・SN1反応が無理な場合、SN2反応が起こる
先ほどの合成反応は求核置換反応の中でも、SN1反応と呼ばれる合成反応です。SN1反応では最初にカルボカチオンの中間体が生成され、その後に求核剤(ブロモイオンなど)が攻撃することで化合物が生成されます。
一方で第一級カルボカチオンなど、通常ではほぼ生成しない不安定な中間体の場合はどうなるのでしょうか。この場合、カルボカチオンが中間体として生成されるSN1反応ではなく、SN2反応によって合成反応が進行します。
カルボカチオンの生成なしに、1つの反応によって生成物を得られる反応がSN2反応です。例えば、以下のようになります。
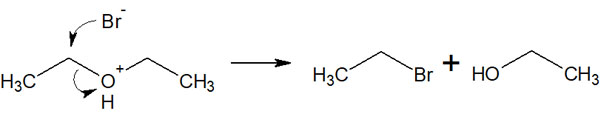
いずれにしても、SN1反応またはSN2反応によってエーテル開裂を起こし、1つの分子が2つに分かれることを理解しましょう。
硫酸触媒ではE1反応でアルケンを生じる
なおハロゲン化水素を酸触媒として利用する場合、エーテル開裂によって前述の通りハロゲン化アルキルを合成できます。一方、同じ酸触媒であっても硫酸を利用する場合、アルケン(二重結合をもつ化合物)を合成できます。
塩化水素(HCl)や臭化水素(HBr)の場合、水素原子(プロトン)を提供した後に塩化イオンまたは臭化イオンが発生します。これら塩化イオンや臭化イオンが炭素原子を攻撃することで、ハロゲン化アルキルが生成されます。
一方で硫酸の場合、H+を提供したとしてもハロゲンイオンが生成されるわけではありません。また硫酸イオンは安定であるため、硫酸イオンが求核攻撃することはありません。
そのため硫酸を触媒として利用した場合、E1反応が起こります。脱離反応としてE1反応が知られており、硫酸イオンが水素原子(プロトン)を引き抜くことで、二重結合をもつ化合物が生成されます。
例えば先ほどの化合物であれば、臭化水素ではなく硫酸を使うことで、以下の化合物が合成されます。
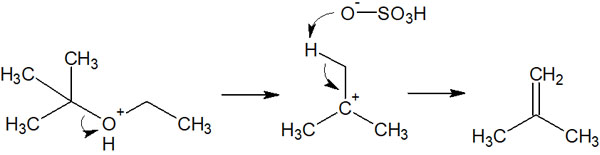
硫酸は求核試薬として働くことができないため、その代わりにプロトンを引き抜き、E1反応による脱離反応を起こすことを理解しましょう。
酸化剤によるエポキシ化でエポキシドを合成
このように酸性条件により、エーテルが開裂することで他の化合物を得られるようになります。一方で同じエーテルではあっても、特殊なエーテルが存在します。それがエポキシドです。環状エーテルであり、さらには三角形の形をしています。
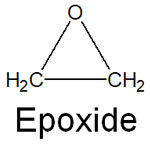
エーテルの反応性を学ぶとき、エポキシドはかなり特殊な有機反応をします。
三角形の化合物はひずみが大きいです。結合角が60°であり、さらにはねじれひずみ(二面角ひずみ)を有します。三角形の化合物では、以下のような形になります。
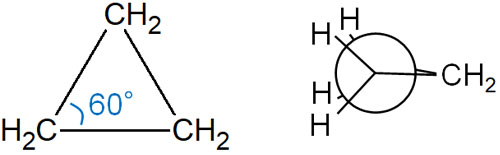
そのため反応性が非常に高い化合物として、三角形の環状化合物が知られています。
・アルケンを酸化してエポキシドを得る
それでは、どのようにしてエポキシドを合成すればいいのでしょうか。エポキシドを得る合成反応をエポキシ化といいます。エポキシ化ではアルケンを用います。
また、エポキシ化では過酸を使います。有名な過酸は過酸化水素であり、過酸を利用することでエポキシドを合成することができます。反応機構は以下のようになります。
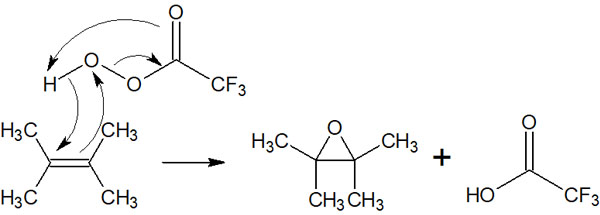
反応機構は少し複雑ですが、電子の移動が一度に起こることでエポキシ化による合成反応が起こります。
シン付加によってアルケンと過酸が反応し、エポキシ化します。同じ側から合成反応が進むのがシン付加です。そのためシスの化合物では、シス化合物のエポキシドを得られます。一方でトランスの化合物では、トランス化合物のエポキシドを合成できます。
過酸によるエポキシ化では、シン付加によってアルケンの立体が保持されたまま合成反応が進行します。
酸性や塩基性の条件でのエポキシドの反応性
なおエポキシドを合成後、次の合成反応をします。エポキシドはひずみが大きく、不安定な化合物です。そこで、エポキシドを用いて次の合成反応を進めるのが一般的です。
エポキシドは反応性が高いため、利用できる求核剤が非常に多いです。
- アルコール(R-OH)
- アミン(R-NH2)
- チオール(R-SH)
これらの求核剤だけでなく、他にも多くの求核剤とエポキシドが反応することで生成物を得られます。ただ重要なのは、求核剤がエポキシドを攻撃するとき、以下の2つの場所が存在することがあります。
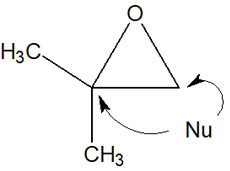
求核剤はどちらの炭素原子を攻撃するのでしょうか。これについて、反応条件が塩基性なのか酸性なのかによって変わります。
塩基性条件では置換基の少ない炭素が求核攻撃される
エポキシドと試薬を反応させるとき、塩基性条件で合成反応すると、置換基の少ない炭素原子が攻撃されます。つまり、エポキシドを用いた合成反応では位置選択性があります。
以下のように合成反応が進みます。
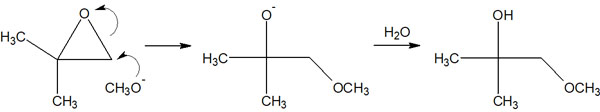
なぜ、求核剤は置換基の少ない炭素原子を攻撃するのでしょうか。それは立体障害があるからです。置換基が多い場合、立体障害によって求核剤は炭素原子に近づくことができません。そのため、置換基の少ない炭素原子を選択的に攻撃します。
立体障害のない炭素原子を攻撃することで、特定の生成物のみ得られるのが塩基性条件下でのエポキシドの合成反応です。
酸性条件では多置換の炭素が攻撃される
一方で酸性条件ではどうなのでしょうか。塩基性条件とは異なり、酸性条件では多置換の炭素原子が攻撃されます。なぜ、立体障害の大きい炭素原子が求核剤によって攻撃されるのでしょうか。それは、酸性条件の反応では酸素原子にプロトンが結合するからです。
エーテル開裂で既に説明しましたが、酸触媒を加えると酸素原子にH+が結合し、エーテルを活性化することができます。同じように、酸性だとエポキシドの酸素原子にプロトンが結合し、酸素原子はプラスの電荷を帯びます。
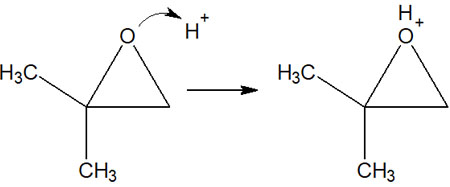
また炭素原子に着目すると、仮に結合が切れてカルボカチオンを生じた場合、一つは第三級カルボカチオンであり、もう一方は第一級カルボカチオンです。
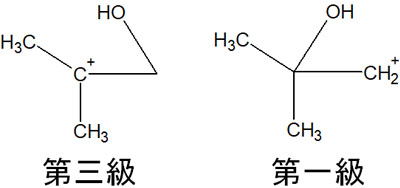
カルボカチオンの安定性の順番を考慮すると、第三級カルボカチオンのほうがプラスの性質が強いです。そのため、プラス電荷の酸素原子と多置換の炭素原子は反発します。イメージとしては、以下のようになります。
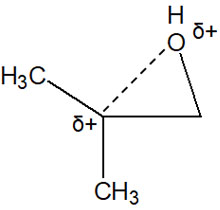
他の結合に比べて、C-O結合は長くなっています。また他の結合に比べて、結合力は弱いです。その結果、求核剤は多置換の炭素原子を攻撃します。
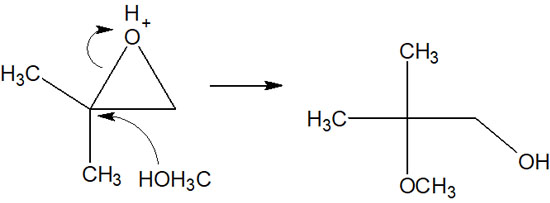
これらの理由により、酸性条件下だと求核剤は多くの置換基を有する炭素原子を攻撃します。
エポキシドの反応条件が酸性なのか塩基性なのかによって生成される化合物が異なるため、これらの反応機構を理解するようにしましょう。
エーテルとエポキシドの合成反応を行う
酸素原子が存在する分子として、エーテルを有する化合物は多いです。そこでエーテルがどのように有機化学で関与するのかについて学ばなければいけません。
そのままの状態だと、エーテルの反応性は悪いです。そこで活性化する必要があり、酸触媒を利用することで酸素原子にプロトンが結合し、エーテル開裂を起こします。また利用する酸触媒を変えれば、求核置換反応が起こったり、E1反応(脱離反応)が起こったりと変化します。
さらに、エポキシドの反応性も学ぶようにしましょう。過酸を利用することでエポキシ化し、エポキシドを得ることができます。その後、求核剤を加えることでエポキシドと反応させます。
これらがエーテルとエポキシドの反応性で重要な内容です。エーテルは反応条件によって生成化合物や位置選択性が異なるため、これらを理解するようにしましょう。






