高校化学で学ぶ有機化学では、化合物が反応することでどのような生成物を得られるのかを学びます。そのため、化合物の性質を理解しなければいけません。
有機化合物の性質で重要なのが官能基です。どの種類の官能基をもつのかによって、反応の種類が変わります。また、官能基の周辺に存在する炭素鎖の数によっても反応の種類が変化します。そのため、有機化学反応では化合物の構造式を確認しなければいけません。
化学反応で特に重要なのが酸素Oを含む官能基です。酸素を含む有機化合物にはアルコール、エーテル、アルデヒド、ケトン、カルボン酸、エステルがあります。
これらの有機化合物の中でも、ここではアルコールとエーテルについて解説していきます。アルコールとエーテルがどのような性質をもつのか学びましょう。
もくじ
アルコールの名称と分類
私たちにとってアルコールは身近であり、一般式はR-OHで記されます(Rはアルキル鎖)。また-OHをヒドロキシ基といいます。なお官能基の名前はヒドロキシ基であるものの、主鎖がアルコールの場合、オール(ol)を名前で利用します。
例えば、アルコールには以下の種類があります。
- メタノール(Methanol):CH3OH
- エタノール(Ethanol):CH3CH2OH
- 1-プロパノール(Propanol):CH3CH2CH2OH
- 1-ブタノール(Butanol):CH3CH2CH2CH2OH
参考までに、お酒に含まれている成分はエタノールです。
それでは、主鎖に-OHが複数結合している場合はどのようにアルコールの名前を付ければいいのでしょうか。この場合、数詞である「ジ(2)」や「トリ(3)」を利用しましょう。例えば、以下のようになります。
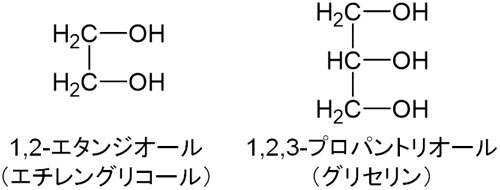
ジは2を意味し、トリは3を意味します。またアルコールが主鎖の場合は名前に「オール(ol)」を加えるため、こうした名称になります。
・アルコールの合成
それでは、アルコールの合成はどのようにすればいいのでしょうか。アルケンの性質を学んでいる場合、アルコールの合成方法は既に理解していると思います。アルケンにH2Oを付加させるとアルコールを生じます。
例えばエチレンにH2Oを付加させるとエタノールを得られます。
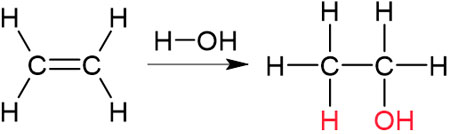
アルケンへの付加反応は一般的なアルコールの合成法の一つです。
アルコールの分類を行う:-OHの数またはアルキル鎖の数
次にアルコールの分類をしましょう。アルコールの分類では以下の2種類があります。
- -OHの数による分類
- 「-OHが結合している炭素C」について、結合しているアルキル鎖の数による分類
まず、単純な分類である「-OHの数による分類」を確認していきましょう。
-OHの数による分類:1価、2価、3価
炭素に結合している-OHの数に着目してアルコールの分類をしましょう。以下のように分類します。
- -OHが1つ結合:1価アルコール
- -OHが2つ結合:2価アルコール
- -OHが3つ結合:3価アルコール
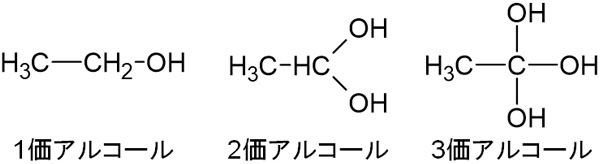
-OHが2つ以上結合している場合は多価アルコールといいます。
なお、H2Oは水素結合することで知られています。言い換えると、-OHがあると水素結合します。アルコールには-OHがあるため極性が高くなり、水素結合を作れるので水との親和性が高いです。そのため、メタノールやエタノール、プロパノールは水によく溶けます。
また-OHの数が多いほど分子の極性が高くなるため、水に溶けやすくなります。そのため1価アルコールよりも、2価アルコールのほうが水に溶けやすいです。また2価アルコールよりも、3価アルコールのほうが水に溶けやすいです。
一方、炭素数が多くなるほど油に溶けやすくなる作用(疎水性)が強くなり、その反対に水に溶けやすい作用(親水性)が弱くなります。炭化水素の割合が大きいと疎水性が高くなり、-OHの数が多いと親水性が高くなるのです。
そのためアルコールであっても、炭化水素の数が多いと水に溶けにくくなります。また炭化水素の少ないアルコールを低級アルコールと呼び、炭化水素の多いアルコールを高級アルコールといいます。
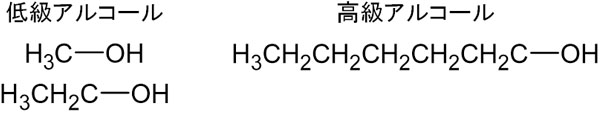
高級アルコールは水に溶けにくいです。理由としては、前述の通り分子内に存在する炭化水素の割合が高いからです。有機化学で低級や高級というのは、炭素数が多いのか少ないのかを意味します。
炭素に対するアルキル鎖の数による分類と酸化反応:第一級、第二級、第三級
炭素に対するアルキル鎖の数を基準にしてアルコールを分類する方法も重要です。分類法を学んでいない場合、アルコールを用いた合成反応を理解することができません。
まず、-OHが結合している炭素Cに着目しましょう。炭素Cに対して、いくつのアルキル鎖が結合しているのか確認するのです。-OHが結合している炭素原子について、結合しているアルキル鎖の数に応じて以下のように分類します。
- 1つのアルキル鎖が結合している:第一級アルコール
- 2つのアルキル鎖が結合している:第二級アルコール
- 3つのアルキル鎖が結合している:第三級アルコール
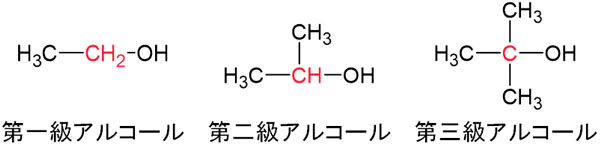
アルコールの分類では、第一級アルコール、第二級アルコール、第三級アルコールが非常に重要です。理由としては、アルコールを酸化するときに生成される物質が異なるからです。
第一級アルコールを酸化すると、アルデヒド(-CHO)が生成されます。また、さらにアルデヒドが酸化されるとカルボン酸(-COOH)になります。
第二級アルコールでは、酸化されることによってケトン(-C=O)になります。ケトンを得られた後、反応は止まります。また第三級アルコールでは、酸化剤を加えても反応は進行しません。
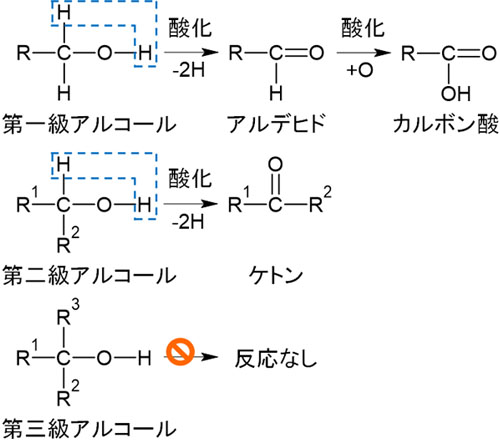
※Rはアルキル鎖を意味します。
分子内から水素Hがなくなったり、酸素Oが加わったりする場合は酸化反応です。また、この反応は非常に重要であるため、必ず覚えるようにしましょう。
・第一級アルコールでは沸点が高い
なお第一級アルコール、第二級アルコール、第三級アルコールでは他にも違いがあります。これらの化合物を比較すると、沸点に違いがあります。
前述の通り、-OHは水素結合を作ります。このとき第一級アルコールでは、立体障害が少ないです。有機化学では分子構造を立体で考えることが多く、立体が込み合っているかどうかを確認しなければいけません。
水素とアルキル鎖を比べると、当然ながら水素Hのほうがサイズは小さいです。第一級アルコールは結合しているアルキル鎖が一つのみなので、立体障害が少ないのです。
一方で第二級アルコールや第三級アルコールでは、-OHの近くにアルキル鎖が存在するため、水素結合を作りにくくなります。
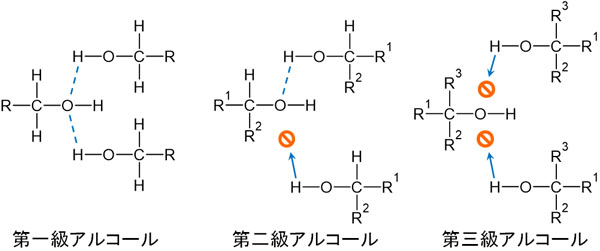
水素結合を作れる場合、分子間の結合が強くなって沸点が高くなります。そのため、沸点の高さは以下の順番になります。
- 第一級アルコール > 第二級アルコール > 第三級アルコール
立体障害により、第三級アルコールでは第二級アルコールに比べて沸点が低くなります。また第二級アルコールでは、第一級アルコールに比べて沸点が低くなります。
アルコールを用いる合成反応の種類
それでは、アルコールを用いる合成反応を確認しましょう。先ほど、アルコールの酸化反応を確認しました。ただ、アルコールには酸化反応以外にも重要な合成反応が存在します。有機化学の基礎では、以下の2種類の反応を覚えましょう。
- 金属ナトリウムNaと反応し、水素が発生する
- 濃硫酸を加えて加熱すると、エーテルまたはアルケンになる
まず、金属ナトリウムとの反応を確認しましょう。ナトリウムはイオン化傾向が強く、積極的にイオンになろうとします。そのため-OHからHを引き抜き、NaはNa+になります。例えばエタノールとNaが反応すると以下のようになります。
- 2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
なお、CH3CH2ONaはCH3CH2O–とNa+で存在しており、イオンとなっています。金属ナトリウムはアルコールと反応することでイオンとなり、水素H2を生成するのです。
参考までに、金属ナトリウムは-OHに限らず、H2Oやカルボン酸-COOHに存在するHについても引き抜く性質があります。ナトリウムはイオン化傾向が強いため、さまざまな有機化合物からHを引き抜くのです。
・濃硫酸を利用してエーテルまたはアルケンを合成する
濃硫酸を利用することで、アルコールからエーテル-O-を合成できます。酸素Oによって2つのアルキル鎖が結合している化合物をエーテルといいます。
濃硫酸には脱水作用があり、分子からH2Oを取り去ります。そこで、比較的低温でアルコールと濃硫酸を反応させると、分子間で脱水反応が起き、H2Oが取り去られることでエーテルを得ることができます。
例えばエタノールと濃硫酸を混ぜ、130~140℃で熱するとジエチルエーテルを合成できます。
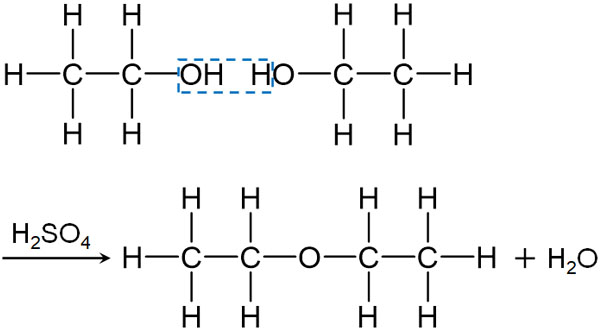
分子の脱離(今回の例ではH2Oの脱離)を伴い、2つの分子(または複数の分子)が反応することで新たな化合物が生成する反応を縮合といいます。アルコールと濃硫酸を反応させ、エーテルを得る合成反応は縮合です。
一方、比較的高温で熱する場合、分子間ではなく、分子内で脱水反応が起こります。その結果、アルケンを得られます。例えばエタノールを160~170℃で熱する場合、分子内脱水が起こることでエチレンを得ることができます。
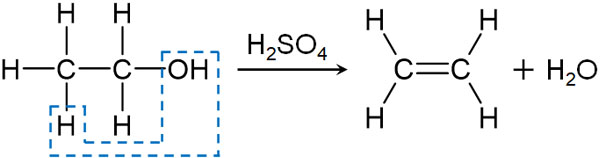
アルコールと濃硫酸を反応させるとき、熱する温度によって主な生成物が異なります。
エーテルの性質とアルコールとの違い
次にエーテルの性質を確認しましょう。エーテルの製法は先ほど解説しました。アルコールと濃硫酸を利用することによって、エーテルを合成することができます。
それでは、エーテルの性質には何があるのでしょうか。エーテルでは、酸素原子Oに2つのアルキル鎖が結合しています。そのため、エーテルはR-O-R’と表すことができます。また、酸素Oによって2つのアルキル鎖が結合している場合、この結合をエーテル結合といいます。
なお、エーテルとアルコールは構造異性体の関係にあります。例えば分子式がC2H6Oの場合、化合物には以下の2つの候補があります。
- エタノール:CH3CH2OH
- ジメチルエーテル:CH3-O-CH3
アルコールとは異なり、エーテルは金属ナトリウムと反応しません。エーテルには、酸素Oに結合している水素Hが存在しません。そのため金属ナトリウムは水素を抜き取ることができず、イオンになれないのです。これが、エーテルと金属ナトリウムが反応しない理由です。
化合物の化学式がC2H6Oとわかっている場合、金属ナトリウムを加えて水素H2が発生する場合、その化合物はエタノールです。一方、金属ナトリウムを加えても反応しない場合、その化合物はジメチルエーテルです。
アルコールとエーテルの性質は有機化学で重要
有機化学で酸素を含む化合物を学ぶとき、アルコールとエーテルは重要です。特にアルコールは私たちにとって身近な物質であり、有機化学でもひんぱんに利用されます。
またアルコールでは、重要な合成反応がたくさんあります。高校化学など、有機化学の基礎では酸化反応、金属ナトリウムとの反応、濃硫酸との反応を覚えましょう。すべて重要な反応であり、特に「アルコールの構造によって酸化反応での生成物が異なる」ことを必ず覚えましょう。
アルコールは合成反応の種類が多く、性質も複雑なので、整理して特徴を理解する必要があります。
なおアルコールと親せきの関係にあるのがエーテルです。アルコールを利用することによってエーテルを合成できます。また、アルコールとエーテルは構造異性体の関係にあります。アルコールとエーテルの性質を学ぶことは、酸素を含む有機化合物を理解するときに必須です。






