元素周期表で3~11族に存在するのが遷移元素です。遷移元素はすべて金属元素であり、遷移元素で重要な元素が鉄Fe、銅Cu、銀Ag、クロムCr、マンガンMnです。これらの中でも、特に重要な金属元素が鉄、銅、銀になります。
無機化学で鉄や銅、銀の性質を学ぶことは重要です。これら遷移元素は性質が似ているものの、それぞれの元素に特徴的な性質を学ぶ必要があります。
これらの元素はイオン化傾向や錯イオン、酸化還元反応など多くの場面で利用されます。そのため覚えなければいけないことは多いです。
それでは、これらの元素にはどのような性質があるのでしょうか。無機化学で重要な遷移元素の特徴を解説していきます。
もくじ
遷移元素で重要な鉄、銅、銀、クロム、マンガン
元素周期表には典型元素と遷移元素があります。典型元素と遷移元素は以下になります。
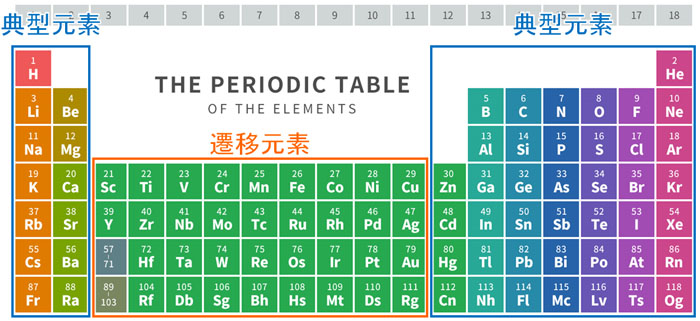
化学で私たちがメインで学ぶ元素は典型元素です。一方、遷移元素にも重要な金属元素が存在します。先ほど解説した通り、以下の元素は必ず性質を学ぶ必要があります。
- 鉄:Fe
- 銅:Cu
- 銀:Ag
- クロム:Cr
- マンガン:Mn
遷移元素の価電子は1~2個であり、錯イオンを作ることが多いです。また、同じ元素であっても複数の酸化数をもつことが多いです。それでは、それぞれの元素の特徴を確認していきましょう。
鉄Fe:酸化鉄やイオン化傾向、硫化水素との反応
自然界では、鉄FeはFe2O3またはFe3O4で存在しています。そのため単体の鉄を得るためには還元しなければいけません。
鉄の還元では一酸化炭素(CO)を利用します。まず、C(コークス)を利用して一酸化炭素を作ります。
- CO2 + C → 2CO
一酸化炭素を得たら、酸化鉄を還元することによって単体の鉄を得ることができます。
- Fe2O3 + 3CO → 2Fe + 3CO2
- Fe3O4+ 4CO → 3Fe + 4CO2
それでは、単体の鉄にはどのような性質があるのでしょうか。単体の鉄がもつ性質として、以下の特徴を覚えましょう。
・鉄は空気中で酸化され、酸化鉄となる
前述の通り、自然界で単体の鉄が存在することはありません。必ず酸化鉄の状態で存在しています。このとき、鉄が酸化されて酸化鉄になるときは以下の3種類があります。
- FeO:黒色
- Fe2O3:赤褐色
- Fe3O4:黒色
酸化鉄は黒または赤褐色になります。
・中性または塩基性で硫化水素H2Sと反応し、黒色の固体となる
金属を分けるとき、硫化水素を利用することは多いです。硫化水素は強力な還元剤であるため、金属イオンと結合することによって固体となります。鉄イオンの場合、中性または塩基性の条件下で硫化水素H2Sを加えるとFeSとなります。
- Fe2+ + S2- → FeS
FeSは黒色の固体です。なお酸性では反応せず、FeSを生じるには中性または塩基性の水溶液である必要があります。
硫酸、塩酸と鉄の反応:硝酸とは不動態を作る
鉄は水素よりもイオン化傾向が高いため、強酸に鉄を加えると水素が発生します。例えば希硫酸に鉄を加える場合、H2を発生すると同時にFeSO4が生成されます。このとき、反応後の溶液を濃縮すると硫酸鉄(Ⅱ)七水和物FeSO4·7H2Oを得られます。
- Fe + H2SO4 + 7H2O → H2 + FeSO4·7H2O
FeSO4·7H2Oは淡緑色の結晶です。
一方、塩酸を加える場合はH2と共にFeCl2が生成されます。この水溶液に対して、Cl2を通しながら濃縮すると塩化鉄(Ⅲ)六水和物FeCl3·6H2Oになります。
- Fe + 2HCl → H2 + FeCl2
- 2FeCl2 +Cl2 + 12H2O→ 2FeCl3·6H2O
FeCl3·6H2Oは黄褐色の固体であり、潮解性があります。空気中の水分を取り込むことによって濡れる性質が潮解性です。
・硝酸と熱濃硫酸には不動態となって溶けない
ただ酸化力のある酸に対して鉄を入れる場合、鉄は溶けません。強酸水溶液に鉄を加えるにも関わらず、水素は発生しないのです。
硝酸や熱濃硫酸は酸化力のある酸で知られています。これらの溶液に鉄を入れると、鉄の表面に酸化被膜が形成されます。これによって鉄と強酸による反応がストップします。この状態を不動態といいます。
鉄イオンの性質:Fe2+とFe3+の違いと見分け方
次に鉄イオンの性質を確認しましょう。鉄イオンにはFe2+とFe3+があります。アンモニア水や水酸化ナトリウムなど、水酸化物を含む化合物を加える場合、鉄イオンは水酸化鉄となって沈殿します。
- Fe2+ + 2OH– → Fe(OH)2
- Fe3+ + 3OH– → Fe(OH)3
なお水酸化鉄(Ⅱ)Fe(OH)2は淡緑色の固体であり、水酸化鉄(Ⅲ)Fe(OH)3は赤褐色の固体です。
重要なのは、鉄イオンに過剰のアンモニア水や水酸化ナトリウムを加えても溶解しないことです。金属元素によっては、過剰のアンモニア水や水酸化ナトリウムを加えることによって、錯イオンを形成して溶解します。
ただ鉄イオンについては、どれだけアンモニア水や水酸化ナトリウムを加えても水酸化鉄が溶解することはありません。つまり少量のOH–を加えると沈殿し、多量のアンモニア水や水酸化ナトリウムを加えても沈殿しない場合、沈殿物は水酸化鉄と推測できます。
・Fe3+の見分け方
それでは、Fe2+とFe3+の見分け方には何があるのでしょうか。試薬を加えるとき、Fe2+とFe3+では反応が異なります。まず、Fe3+から確認していきましょう。
Fe3+にチオシアン酸カリウムKSCNを加えると、血赤色になります。
映画やドラマで流血シーンを撮影する場合、本物の血を使うことは当然ながらありません。その代わり、塩化鉄水溶液 Fe3+とチオシアン酸カリウムKSCNを混ぜ、血赤色の錯イオン[FeSCN]2+を作ります。これにより、ホラー映画やミステリー映画で利用できる偽物の血を得ることができます。

なお血赤色ではなく、Fe3+を濃青色にすることもできます。Fe2+を含む化合物にK4[FeⅡ(CN)6]があります。そこでFe3+にK4[FeⅡ(CN)6]を加えると、濃青色の固体を生じて沈殿します。
一方でFe2+ではなく、Fe3+を含む化合物としてK3[FeⅢ(CN)6]を加える場合、褐色の溶液になります。Fe3+が存在するかどうかを見分けるとき、これら3つの方法があります。
・Fe2+の見分け方
それでは、Fe2+を見分ける方法には何があるのでしょうか。Fe3+とは異なり、Fe2+にチオシアン酸カリウムKSCNを加えても反応は起こりません。
またFe2+を含む水溶液にK4[FeⅡ(CN)6]を加えると、白または青白色の固体となって沈殿を生じます。一方、Fe2+を含む水溶液に対して、Fe3+を含むK3[FeⅢ(CN)6]を加えると濃青色の固体を生じて沈殿します。
| 加える試薬 | Fe2+ | Fe3+ |
| OH– | 淡緑色の固体(沈殿) | 赤褐色の固体(沈殿) |
| KSCN | 反応なし | 血赤色の溶液 |
| K4[FeⅡ(CN)6] | 白または青白色の固体(沈殿) | 濃青色の固体(沈殿) |
| K3[FeⅢ(CN)6] | 濃青色の固体(沈殿) | 褐色の溶液 |
鉄は最も重要な金属元素の一つであるため、無機化学で覚えなければいけない内容も多いです。そこで、試薬と反応することで何の化合物を得ることができるのか整理して覚えましょう。また、Fe2+とFe3+の見分け方も理解しましょう。
銅Cuはさまざまな化合物と反応する
単体の銅は赤褐色です。銅は熱伝導性や電気伝導性が銀の次に高いです。なお、銅像の多くは赤褐色ではなく、青緑色です。銅は空気と反応し、表面に青緑色のサビを生じます。このサビを緑青(ろくしょう)といいます。

なお、銅はさまざまな化合物と反応します。そこで単体の銅と銅イオンについて、化合物との反応を確認していきましょう。
・希硝酸、濃硝酸、熱濃硫酸との反応
銅は水素よりもイオン化傾向が低いため、イオンになりたくないと考えています。そのため塩酸や希硫酸に単体の銅を加えても反応せず、水素は発生しません。しかし硝酸や熱濃硫酸など、酸化作用のある酸とは化学反応を起こして溶けます。
銅は一酸化窒素や二酸化窒素、二酸化硫黄を生成したいときに利用されます。酸化力のある酸に銅が溶けるからです。
- 希硝酸:3Cu + 8HNO3 → 3Cu(NO3)2 + 4H2O + 2NO
- 濃硝酸:Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO2
- 熱濃硫酸:Cu + 2H2SO4 → CuSO4 + 2H2O + SO2
一酸化窒素や二酸化窒素、二酸化硫黄を得たいとき、銅が利用されます。
・銅の酸化物には酸化銅(Ⅱ)CuOと酸化銅(Ⅰ)Cu2Oがある
銅がイオンで存在するとき、通常はCu2+となります。ただ場合によっては、Cu+で存在することもあります。そのため、酸化銅にはCuOとCu2Oの2種類があります。
- 2Cu + O2 → 2CuO(黒色)
- Cu + O2 → Cu2O(赤色)
酸化銅(Ⅱ)CuOと酸化銅(Ⅰ)Cu2Oの色は重要です。有機化学を学ぶとき、フェーリング反応を習います。Cu2+を含む溶液に対して、アルデヒドを加えて加熱すると、Cu2+が還元されてCu2Oを生成するのがフェーリング反応です。
フェーリング反応では酸化銅(Ⅰ)Cu2Oによる赤色沈殿を生じます。そのため、Cu2Oが赤色であることを覚えなければいけません。
・硫酸銅CuSO4は吸湿性がある
銅を含む化合物に硫酸銅CuSO4があります。硫酸銅は白色の固体です。ただ吸湿性があり、空気中に存在するH2Oを取り込み、硫酸銅五水和物CuSO4·5H2Oになります。CuSO4·5H2Oは青色の固体であり、以下が実際の硫酸銅五水和物です。

・銅を含む青色溶液と化合物の反応
なお、銅を含む水溶液は青色です。硫酸銅を溶かすと青色になるのは、銅イオンが青色だからです。
そこで、銅を含む溶液に化合物を加えることによって、どのような反応が起こるのか理解しましょう。重要な反応は以下になります。
- 硫化水素H2Sを加える
- 少量のOH–を加える
- 過剰のアンモニア水を加える
- Cu(OH)2を加熱する
銅はイオン化傾向が低いため、水溶液中でイオンとして存在したくないと考えています。そのためH2Sを加えると、硫酸銅(Ⅱ)CuSによる黒色沈殿を生じます。先に述べた通り、FeSの生成は中性または塩基性溶液である必要がありました。一方で銅の場合、酸性溶液であっても中性・塩基性溶液であってもCuSが生成されます。
- Cu2+ + S2- → CuS
また少量のアンモニア水または水酸化ナトリウムを加える場合、水溶液中にOH–が存在することになります。この場合、水酸化銅(Ⅱ)Cu(OH)2による青白色の沈殿を生じます。
- Cu2+ + 2OH– → Cu(OH)2
また銅の場合、過剰のアンモニアを加えると錯イオンを作ります。少量のアンモニアではOH–によってCu(OH)2が生成されるものの、大量のアンモニアが存在するとNH3と置き換わり、沈殿物が溶けて深青色の溶液となります。このとき、生成される錯イオンは[Cu(NH3)4]2+です。
- Cu(OH)2 + 4NH3 → [Cu(NH3)4]2+ + 2OH–
なお、水酸化銅(Ⅱ)Cu(OH)2を加熱すると酸化銅(Ⅱ)CuOになります。
- Cu(OH)2 → CuO + H2O
先ほど解説した通り、CuOは黒色の固体です。
銀Agの単体は酸化銀で存在し、硝酸や熱濃硫酸に溶ける
遷移元素では銀Agの性質も重要です。単体の銀は銀白色の光沢があり、金属の中で熱伝導性と電気伝導性が最大です。つまり、効率よく熱や電気を伝えることができます。
天然では、銀は主に酸化銀Ag2Oで存在します。酸化銀を加熱すると、銀の単体を得ることができます。
- 2Ag2O → 4Ag + O2
なお、銀は銅と同じようにイオン化傾向が低いです。そのため、水溶液中でイオンとして存在したくないと考えています。イオン化傾向が低いため、銀に塩酸や希硫酸を加えても水素は発生しません。
ただ酸化力のある酸を加えると銀は溶けます。つまり、銅と同じく硝酸や熱濃硫酸と反応します。
- 希硝酸:3Ag + 4HNO3 → 3AgNO3 + 2H2O + NO
- 濃硝酸:Ag + 2HNO3 → AgNO3 + H2O + NO2
- 熱濃硫酸:2Ag + 2H2SO4 → Ag2SO4 + 2H2O + SO2
考え方は銅と同じです。一酸化窒素や二酸化窒素、二酸化硫黄を得たいとき、銀を利用することでこれらの気体を発生させることができます。
銀を含む化合物や銀イオンの性質
それでは、銀を含む化合物や銀イオンの性質には何があるのでしょうか。まず、ハロゲンと銀イオンの反応を確認しましょう。銀イオンとハロゲンが反応すると、ハロゲン化銀(固体)が生成されます。
- Ag+ + Cl– → AgCl(白色)
- Ag+ + Br– → AgBr(淡黄色)
- Ag+ + I– → AgI(黄色)
AgCl、AgBr、AgIは感光性(光によって化学変化を起こす性質)があります。そのため、これらの化合物を保存するときは褐色ビンに入れ、光を遮る必要があります。
また硫化水素H2Sを加えると、銀イオンと反応して硫化銀Ag2Sを生じます。
- 2Ag+ + S2- → Ag2S(黒色)
銀はイオン化傾向が低いため、水溶液が酸性であっても中性・塩基性であっても硫化水素と反応し、黒色の硫化銀が生成されます。
・水酸化ナトリウム、アンモニアとの反応
それでは、塩基との反応を確認しましょう。水酸化ナトリウムや少量のアンモニア水を加える場合、銀イオンとOH–が反応します。このとき、酸化銀Ag2Oが生成されます。
- 2Ag+ + 2OH– → Ag2O + H2O
Ag+とOH–が反応すると、AgOHが生成するのではと多くの人が思います。ただAgOHは不安定な物質であるため、すぐに分解してAg2OとH2Oになります。AgOHを得ることはできないため、その代わりとして褐色の酸化銀を得られるのです。
なお過剰の水酸化ナトリウムを加えても反応に変化はありません。ただ過剰のアンモニア水を加える場合、銀はアンモニアと錯イオンを形成します。
- Ag2O + 4NH3 + H2O → 2[Ag(NH3)2]+ + 2OH–
Zn2+やCu2+と同様に、少量のアンモニア水を加える場合はOH–によって沈殿物を生じるものの、過剰のアンモニア水を加えると銀イオンは錯イオンとなります。酸化銀は無色のジアミン銀(Ⅰ)イオン[Ag(NH3)2]+となって溶解するのです。
クロムCrで重要なクロム酸カリウムと二クロム酸カリウム
鉄や銅、銀に比べると重要度は劣るものの、無機化学で遷移元素を学ぶとき、必ず理解しなければいけないのがクロムとマンガンです。
・クロムを含む化合物の色
クロムを含む化合物は酸化剤として利用されるケースが多いです。無機化学でクロムを学ぶとき、重要な化合物がクロム酸カリウムK2CrO4と二クロム酸カリウムK2Cr2O7です。
クロム酸カリウムは黄色の結晶です。そこでクロム酸カリウムを溶かした水溶液を酸性にすると、二クロム酸カリウムへ変化します。二クロム酸カリウムは赤橙色です。
- 2CrO42- + 2H+ → Cr2O72- + H2O
ちなみに、水溶液を塩基性にすると二クロム酸カリウムはクロム酸カリウムへと戻ります。
- Cr2O72- + 2OH- → 2CrO42- + H2O
なお、二クロム酸カリウムは酸性溶液で強い酸化力を有します。実際に二クロム酸カリウムが酸化剤として働くと、Cr3+が生成されます。
- Cr2O72- + 14H+ + 6e– → 2Cr3- + 7H2O
Cr3+は緑色です。クロムというのは、信号機のように黄色や赤橙色、緑色へ変化する性質があるのです。
マンガンMn:過マンガン酸イオンと酸化マンガンの特徴
マンガンで重要な化合物は過マンガン酸カリウムと酸化マンガンです。過マンガン酸カリウムは強力な酸化剤として知られています。
酸性では、過マンガン酸イオンは赤紫色を示します。相手を酸化すると、過マンガン酸イオンはMn2+になります。Mn2+は透明であるため、過マンガン酸イオンを加えることで赤紫色が消えた場合、酸化反応が進行したと判断できます。
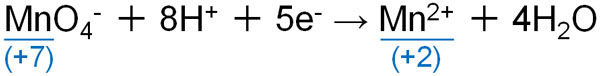
Mnの酸化数は+7(過マンガン酸イオン)から+2(Mn2+)へ減っています。相手に電子を与え、自らの酸化数は減っているため、過マンガン酸イオンは酸化剤として働くのです。
ちなみに中性・塩基性条件で反応させると、過マンガン酸イオンは酸化マンガンMnO2へと変化します。
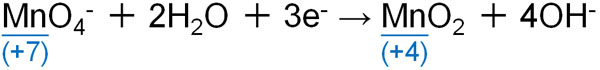
過マンガン酸カリウムを利用して反応させる場合、酸性条件下での反応がほとんどです。一方、中性・塩基性で反応させる場合、酸化還元反応での生成物は黒色の酸化マンガンになることを理解しましょう。
中性・塩基性では水溶液中にH+がほぼ存在しません。水素イオンを利用することができないため、水を利用することで過マンガン酸イオンは酸化マンガンとなるのです。
・酸化マンガンは酸化剤として利用される
なお、過マンガン酸イオンから酸化マンガンになるとき、酸化数は+7(過マンガン酸イオン)から+4(酸化マンガン)へと変化します。前述の通り、Mn2+は酸化数が+2です。つまり酸化マンガンは相手に電子を与え、酸化する能力があります。酸化マンガン(Ⅳ)MnO2は酸化剤でもあるのです。
酸化マンガンは塩酸と反応し、塩素を得るときの酸化剤として利用されます。
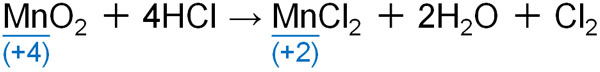
他に重要な反応としては、過酸化水素に酸化マンガンを加えると酸素が発生します。
- 2H2O2 → 2H2O + O2
酸素を発生させるとき、酸化マンガンは触媒として働きます。
鉄、銅、銀、クロム、マンガンの性質を学ぶ
遷移元素には多くの種類があります。その中でも、無機化学で重要な元素は決まっています。遷移元素の特徴を学ぶとき、鉄、銅、銀、クロム、マンガンの性質を学びましょう。無機化学の基礎では、上記以外の遷移元素は重要ではありません。
特に重要な遷移元素が鉄Fe、銅Cu、銀Agです。これらの元素は多くの場面で利用されており、私たちにとって身近です。
またクロムCrとマンガンMnの性質も覚えなければいけません。クロムとマンガンを含む化合物は酸化剤として利用され、酸化還元反応で活躍します。
遷移元素は種類が多いものの、無機化学で学ばなければいけない元素は限られています。そこで鉄、銅、銀、クロム、マンガンの性質を理解しましょう。






