なぜ電流が流れるのかというと、その理由は電子e–が動くからです。電子が動く化学反応には酸化還元反応があります。つまり電池というのは、酸化還元反応を利用しています。
電池には複数の種類があり、化学ではボルタ電池やダニエル電池、鉛蓄電池、燃料電池を学びます。これらの電池は私たちが日常的に利用しており、化学を活用している身近な技術の一つです。
なお一回利用することで使えなくなる電池があれば、充電することによって何度も利用できる電池もあります。クリーンエネルギーを利用することにより、水のみ発生する電池もあります。これらはすべて酸化還元反応が重要になります。
それでは、電池はどのような仕組みになっているのでしょうか。化学で学ぶ電池の仕組みや種類を解説していきます。
もくじ
電池はイオン化傾向を利用している
電気を通す必要があるため、当然ながら電池の利用には金属の存在が必須となります。金属ごとにイオンへのなりやすさに違いがあり、以下のイオン化傾向が知られています。
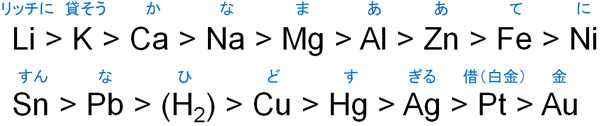
イオン化傾向を理解すれば、電池の仕組みを学ぶことができます。
化学で電池を学ぶとき、ひんぱんに利用される金属が亜鉛(Zn)と銅(Cu)です。亜鉛と銅を比較すると、亜鉛のほうがイオン化傾向は強いです。つまり、銅よりも亜鉛はイオンになりやすいです。そのため希硫酸などに2つの金属を浸し、導線でつなぐと以下の反応が起こります。
- 亜鉛側:Zn → Zn2+ + 2e–
- 銅側:2H+ + 2e– → H2
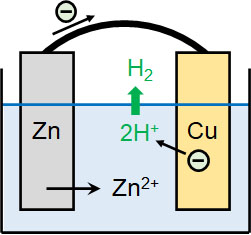
亜鉛はイオンになりやすいため、Zn2+になることで電子を放出します。電子を放出するため、亜鉛の酸化数は増加しており、酸化反応が起きています。また電子はマイナスの電荷をもっており、亜鉛側で電子が発生します。そのため、酸化反応が起きている金属(亜鉛側)を負極といいます。
なお亜鉛側で発生した電子は導線を通り、銅へ移動します。水素は亜鉛よりもイオン化傾向が弱いです。そのため電子が銅へ移動すると、水溶液中に存在する水素イオンが電子を受け取り、H2が生成されるのです。
銅側では、水素イオンが電子を得ています。そのため水素の酸化数が減っており、還元反応が起こっています。また亜鉛側が負極であるため、銅側は正極になります。
電流と電子の向きが逆の理由
なお、電流と電子の向きは逆になります。先ほど、亜鉛で発生した電子は銅へ移動することを解説しました。つまり、電子は負極から正極へ移動します。
一方、電流は正極から負極へ移動します。電流は自由電子の動きによって発生するにも関わらず、電流と電子の向きが逆なのです。
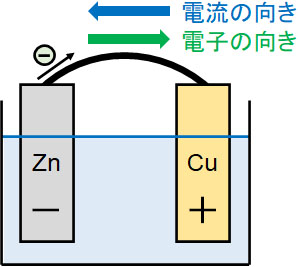
この理由として、大昔の科学者が「電流は正極から負極に流れる」と定義したからです。昔の科学者が決めたルールを私たちが利用しているため、このルールに従っているのです。つまり、電流と電子の向きが逆なのはたまたまなのです。
電流の流れる向きが定義された後、1890年ごろに物理学者トムソンが電子を発見しました。「電子は負極から正極に移動する」と彼は公に報告したのです。自由電子が負極から正極へ流れることによって電流が発生するため、本来であれば「電流は負極から正極へ流れる」と定義しなければいけません。
しかし大昔の人が「電流は正極から負極へ流れる」と定義しており、この定義にしたがって多くの法則が既に開発・利用されていました。一部を記すと以下が該当します。
- 右ねじの法則
- フレミングの左手の法則
- マクスウェルの方程式
電流の向きの定義を変えると、符号がすべて逆になって面倒です。そこで電流の流れる向きの定義を変えず、いまでもこの定義が利用されているのです。そのため電流と電子の向きが逆であることに深い意味はないことを理解しましょう。
電池によって異なる特徴
なお、電池には複数の種類があります。化学で電池を学ぶとき、電池の種類や特徴を覚えるようにしましょう。高校化学で学ぶ電池には以下があります。
- ボルタ電池
- ダニエル電池
- 鉛蓄電池
- 燃料電池
すべて重要な内容であり、特徴を理解しましょう。以下ではそれぞれの電池を解説していきます。
ボルタ電池:分極と減極剤
先ほど解説した「希硫酸水溶液に亜鉛と銅を浸し、電流を得る電池」をボルタ電池といいます。亜鉛がイオンとなり、同時に電子を放出します。その後、電子は銅へ移動して水素イオンと反応し、水素を生成するのです。
ただ、ボルタ電池には大きな欠陥があります。電流を流すと、すぐに電圧が下がってしまうのです。この理由は銅の周辺に水素の気泡を生じるからです。
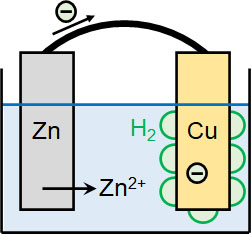
気泡があると、水素イオン(H+)は銅板に近づくことができません。その結果、起電力の低下が起こるのです。このような起電力の低下を分極といいます。分極が起こるため、ボルタ電池が実用化されることはありませんでした。
なお分極を防ぐ方法として、過酸化水素(H2O2)や二クロム酸カリウム(K2Cr2O7)などの酸化剤を加えるやり方があります。こうした酸化剤を減極剤(げんきょくざい)といいます。
酸化剤は酸化力が強く、自身は還元されます。水素イオンよりも優先的に還元されるため、電子は水素イオンではなく、酸化剤が受け取ることになります。その結果、水素(H2)が発生しません。例えば過酸化水素を加える場合、水素イオンではなく過酸化水素が電子を受け取り、H2Oが生成されます。
- H2O2 + 2H+ + 2e– → 2H2O
いずれにしても、ボルタ電池では不都合な現象が発生することを理解しましょう。
ダニエル電池:素焼き板の役割と塩橋
起電力が低下するボルタ電池は利用できないため、そのあとにイギリスの化学者・物理学者であるダニエルがダニエル電池を開発しました。ボルタ電池と同じように、ダニエル電池では亜鉛と銅を利用します。
ボルタ電池と比べて何が違うのかというと、ダニエル電池では硫酸亜鉛水溶液(ZnSO4)に亜鉛を浸し、硫酸銅水溶液(CuSO4)に銅を浸します。また硫酸亜鉛水溶液と硫酸銅水溶液が混ざらないようにするため、容器を素焼き板で区切ります。
この場合、以下の化学反応が起こります。
- 亜鉛側:Zn → Zn2+ + 2e–
- 銅側:Cu2+ + 2e– → Cu
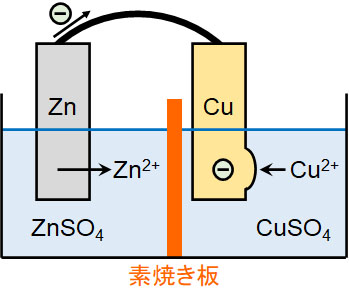
素焼き板が間にあるため、硫酸亜鉛と硫酸銅は混ざりません。このとき亜鉛はイオンになるため、亜鉛版は徐々に薄くなっていきます。
一方、銅イオンは電子を受け取ることによって析出します。そのため、銅板の周りに銅が析出します。水溶液中に水素イオン(H+)はないため、水素は発生しません。その代わり、銅が表れるのです。
なお素焼き板を利用する場合、硫酸イオン(SO42-)は素焼き板を通過できます。反応が進むと硫酸銅水溶液に存在する硫酸イオンの濃度が高くなります。ただ硫酸イオンは素焼き板を通過し、硫酸亜鉛水溶液へ移動できます。そのため、イオンのバランスは崩れません。
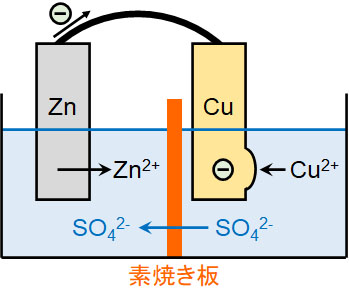
なお電流が流れるとき、亜鉛はイオンとなって溶ける必要があるため、硫酸亜鉛の濃度は薄いほど優れます。一方、電流が流れるためにはCu2+が電子を受け取る必要があるため、硫酸銅の濃度は濃いほうが優れます。
ダニエル電池で水溶液を完全に分離し、塩橋を利用する
なおダニエル電池にも問題点があります。Zn2+とSO42-は水溶液中で移動速度が異なります。そのため放電を続けているとイオン濃度は同じにならず、イオンの偏りを生じてしまいます。こうして、電流の流れが弱くなります。
この問題を解決するために塩橋を利用します。塩橋とは、「KOHやKClなどの電解質を含むゼラチンが入っている管」と理解しましょう。硫酸亜鉛と硫酸銅の容器を完全に分け、以下のように塩橋を利用して2つの水溶液をつなぐのです。
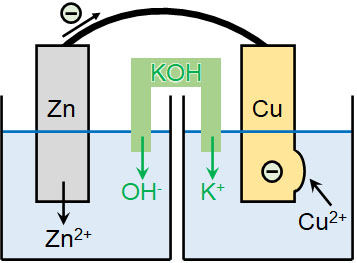
例えばKOHを含む塩橋がある場合、亜鉛側でZn2+が生成すると同時に塩橋からOH–が溶けだします。また銅側では、Cu2+がCuになると同時にK+が溶けだし、K+は硫酸銅にあるSO42-とイオンを形成します。こうして、2つの溶液でイオンの偏りを生じることはなくなります。
ダニエル電池の問題点を解決するために利用されるのが塩橋です。塩橋によってイオンの偏りが生まれなくなり、電流が常に流れるようになります。
鉛蓄電池:充電可能な電池の仕組み
ここまでの内容を学べば、鉛蓄電池の仕組みを理解できるようになります。一般的な電池は放電のみ可能です。これを一次電池といいます。
一方、私たちは多くの日常場面で充電をします。充電可能な電池を二次電池といいます。鉛蓄電池は代表的な二次電池であり、放電だけでなく、充電することができます。
鉛蓄電池では、負極に鉛(Pb)を利用し、正極に酸化鉛(Ⅳ)(PbO2)を利用します。希硫酸水溶液にこれらの金属を浸すことによって電子の移動が起こります。
- 負極側:Pb + SO42- → PbSO4 + 2e–
- 正極側:PbO2 + SO42- + 4H+ + 2e– → PbSO4+ 2H2O

反応前と反応後でどのような化合物が生成するのか覚えましょう。鉛蓄電池の場合、負極でも正極でも硫酸イオンと反応し、硫酸鉛(PbSO4)が生成されます。
酸化鉛(Ⅳ)(PbO2)よりも鉛(Pb)のほうが酸化しやすいです。そのため鉛(Pb)は電子を放出し、酸化鉛(Ⅳ)(PbO2)は電子を受け取るのです。鉛に着目すると、以下のように酸化反応と還元反応が起こっているとわかります。
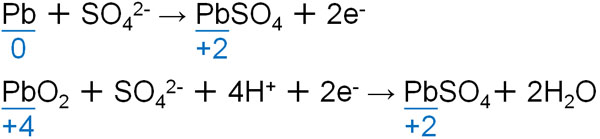
なお正極と負極の反応を合わせると以下のようになります。
- Pb + PbO2 + 2SO42- + 4H+ → 2PbSO4+ 2H2O
ちなみに、「2SO42- + 4H+」は2H2SO4を意味します。
なお鉛蓄電池で重要なのは、充電できることです。逆向きの電流を流すことによって、放電時とは逆の反応が起こります。つまり、以下の反応が起こります。
- 2PbSO4+ 2H2O → Pb + PbO2 + 2H2SO4
ボルタ電池やダニエル電池の場合、逆反応を起こすことはできません。一方で鉛蓄電池の場合、逆反応を起こすことによって充電できるのです。
燃料電池:リン酸型燃料電池とアルカリ型燃料電池
電池の中でも、水素と酸素を利用することによって電気エネルギーを得る電池を燃料電池といいます。水素と酸素が反応すると、水を生成します。水のみ生成されるため、燃料電池はクリーンエネルギーとして知られています。
燃料電池を学ぶとき、ひんぱんに利用される例がリン酸型燃料電池とアルカリ型燃料電池です。
・リン酸型燃料電池の仕組み
リン酸型燃料電池では2つの導線の間にリン酸水溶液(H3PO4)を入れます。その後、負極側で水素H2を通し、正極側で酸素O2を通します。そうすると負極では、触媒による働きによって一部のH2はH+となります。また正極で水素イオンH+は酸素O2と反応し、水になります。
- 負極側:H2 → 2H+ + 2e–
- 正極側:O2 + 4H+ + 4e– → 2H2O
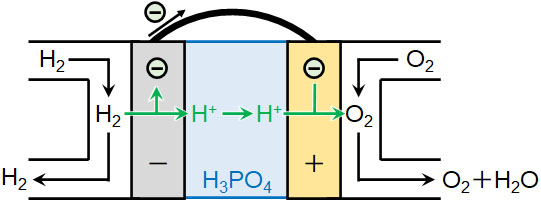
反応しなかったH2やO2は外に排出されます。また負極と正極での反応を合わせると以下のようになります。
- 2H2 + O2 → 2H2O
水素H2が酸化され、酸素O2が還元されることによって電気を得ることができます。これがリン酸型燃料電池です。
・アルカリ型燃料電池の仕組み
リン酸は酸性を示します。つまり、リン酸型燃料電池は酸性水溶液を用いての反応になります。一方、塩基性条件での燃料電池も存在します。これをアルカリ型燃料電池といいます。
アルカリ型燃料電池では、リン酸の代わりに水酸化カリウム水溶液(KOH)を利用します。先ほどと同じように、一部の水素H2は水素イオンH+へと変換されます。塩基性条件の場合、OH–が存在するため、H2とOH–が反応して水H2Oが生成されます。
一方、正極側ではH2OがH+とOH–に分かれます。OH–は水酸化カリウム水溶液に残り、H+は酸素と反応して水になります。
- 負極側:H2 + 2OH– → 2H2O + 2e–
- 正極側:O2 + 2H2O + 4e– → 4OH–

こうして、先ほどと同じように負極側と正極側を合わせると以下の化学反応式を得ることができます。
- 2H2 + O2 → 2H2O
リン酸型燃料電池でもアルカリ型燃料電池でも、水素と酸素を利用することによって水が発生し、このときに電流が流れるのは同じです。ただ酸化反応と還元反応について、それぞれの半反応式が異なります。そこで、2つの違いを理解しましょう。
電池の種類によって仕組みが異なる
電気は多くの場面で利用されており、すべての人が日常生活で電池を利用しています。電池の歴史は古く、長く研究されています。このとき電流の向きと電子の流れる向きが逆になっているものの、「たまたまそのようなルールになっているに過ぎない」と理解しましょう。
なお電池はイオン化傾向を利用します。そこでボルタ電池とダニエル電池の欠点や改善点、原理を理解しましょう。
また電池を学ぶとき、鉛蓄電池や燃料電池も重要です。鉛蓄電池の化学反応式を覚えるのは大変であるものの、覚えれば問題を解けるようになります。同じことは燃料電池での半反応式にもいえます。
電池の仕組みには酸化還元が関わるため、化学反応式は少し複雑です。また、暗記しなければいけないことも多いです。そこで、それぞれの電池の特徴と反応前・反応後の生成物を理解しましょう。