高校化学で学ぶ内容に酵素があります。有機化学・高分子化学・生化学で重要な分野の一つが酵素です。生物ではなく化学で酵素を学ぶ理由として、酵素には化学的性質が存在するからです。
また、酵素阻害剤は医薬品として多くの場面で利用されています。なぜ酵素阻害剤が薬として機能するのか理解するためには、酵素の化学的性質を学ぶ必要があります。生物で酵素の役割を学ぶだけでは不十分なのです。
酵素には触媒作用や基質特異性、最適温度、最適pHなど、独自の性質があります。これらの特徴を学ぶことで、酵素反応を理解できるようになります。
それでは、酵素の化学的性質で重要な内容には何があるのでしょうか。高校化学など、化学の基礎で学ぶ酵素の概要を解説していきます。
もくじ
酵素は活性化エネルギーを減らす触媒作用をもつ
通常、化学反応を起こすためには大きなエネルギーが必要です。熱を与えることで、ようやく反応物を得られます。
ただ、私たちの体温は36℃付近で一定です。体内の熱を上げることはできません。そこで重要になるのが酵素です。
効率よく化学反応を進めるために私たちは触媒を利用します。触媒を加えることによって活性化エネルギーが下がり、反応を進めるために必要なエネルギーが下がります。そのために酵素が存在し、私たちの体内に存在する触媒が酵素と理解しましょう。
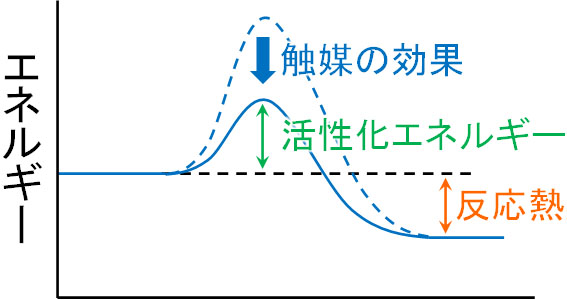
触媒として酵素が存在する場合、体温である36℃付近の熱であっても化学反応が進行します。酵素の働きによって、私たちは体内で糖や脂質を分解することができるのです。
なお、酵素はタンパク質によって構成されています。つまりタンパク質による触媒が酵素です。
・酵素は何度も利用できる
なお触媒を利用して化学反応を起こすとき、加える触媒は少量です。触媒は反応の進行をスムーズにするために用いられるため、少量の触媒を利用することによって必要な活性化エネルギーを下げるのです。
これは酵素も同じです。酵素によって化学反応が進むとき、何度も同じ酵素が利用されます。例えばデンプンの分解に関わる酵素にアミラーゼがあります。アミラーゼがデンプンを分解するとき、一つのアミラーゼが何度もデンプンを分解します。
一つの酵素が何度も同じ働きをするため、少量の酵素(触媒)が存在すれば化学反応が効率よく進行します。
・酵素の処理速度には限界がある
なお一つの酵素は何度も利用されるものの、一つの酵素が処理できる化合物量には限界があります。そのため酵素量が一定であり、反応に関与する化合物(反応物)が大量にある場合、化学反応の速度は一定です。
酵素は一定量の反応物を分解し、生成物(分解物)を作ります。そのため反応スピードを上げたい場合、酵素の量を増やさなければいけません。
酵素の種類:反応物と生成物
それでは、酵素の種類には何があるのでしょうか。生物を学ぶとき、重要な酵素の種類や機能、反応物、生成物をすべて覚える必要があります。
化学の基礎として酵素を学ぶときについても、酵素の種類を覚えるのは重要です。ただ、それよりも重要なのは酵素の化学的性質を理解することです。参考までに、酵素の種類や反応物・生成物には以下があります。
| 酵素 | 反応物(基質) | 生成物 | 場所 |
| アミラーゼ | デンプン | マルトース | 唾液 |
| マルターゼ | マルトース | グルコース | 腸液 |
| スクラーゼ | スクロース | グルコース、フルクトース | 腸液 |
| ラクターゼ | ラクトース | グルコース、ガラクトース | 腸液 |
| セルラーゼ | セルロース | セロビオース | 植物 |
| リパーゼ | 油脂(脂肪) | 高級脂肪酸、グリセリン | 膵液 |
| ペプシン | タンパク質 | ペプチド、アミノ酸 | 胃液 |
| トリプシン | タンパク質 | ペプチド、アミノ酸 | 膵液 |
| カタラーゼ | 過酸化水素 | 水、酸素 | 血液 |
私たちの体内には数千の酵素が存在します。その中でも、表にあるのが特に重要な酵素です。
酵素反応の仕組み:活性部位や基質特異性
それでは、酵素の化学的性質についてより深く確認していきましょう。どのように酵素反応が起こるのでしょうか。
前述の通り、酵素はタンパク質で構成されている触媒です。また、酵素によって化学反応が起こるとき、反応物質を基質といいます。例えばアミラーゼにとって基質はデンプンであり、生成物はマルトースです。
デンプンは多くのα-グルコースが連なっている高分子化合物です。酵素は特定の部分だけを認識する働きがあり、これを基質特異性といいます。例えばアミラーゼはデンプンのみを認識して分解します。アミラーゼが脂質を認識して分解することはありません。
酵素の種類によって、どの基質を分解するのか決まっていると理解しましょう。これが基質特異性の特徴です。
なお酵素には活性化部位が存在し、活性化部位に特定の物質が入り込むと分解されます。例えばアミラーゼには、デンプンを分解する部分(活性化部位)が存在します。イメージとしては、酵素は工場であり、実際に分解作業をするのは工場内の特定の場所(活性化部位)というわけです。
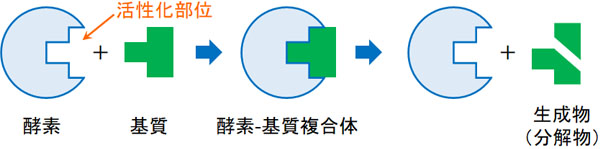
ただ酵素の場合、工場内の作業場でなんでも分解できるわけではありません。基質特異性により、作業場で分解できる化合物が酵素ごとに決められているのです。
活性化部位は酵素ごとに形が決まっています。酵素に存在する活性化部位と基質(反応物)の形が少しでも異なる場合、基質は分解されません。これが、基質特異性を生み出している理由です。
例えば、アミラーゼは多くのデンプンを分解できるものの、アミラーゼはマルトースを分解できません。デンプンはアミラーゼの活性化部位に入ることができるものの、2つのグルコースが結合しているマルトースではアミラーゼの活性化部位に入れないのです。
酵素-基質複合体を作るカギとカギ穴の関係
活性化部位に基質が入り込むことによって、ようやく酵素は触媒作用を発揮できます。基質が酵素の活性化部位に入ることで、酵素-基質複合体となり、その結果として基質が分解されるのです。
活性化部位と基質の関係というのは、カギとカギ穴の関係が例としてひんぱんに利用されます。少しでもカギの形が異なる場合、カギを開けることはできません。カギ穴に対して、完全に合致しているカギでなければドアを開けることができないのです。
なお酵素-基質複合体となった後、基質が分解されると、分解物は酵素から離れます。
基質が分解された場合、別の化合物になります。分解物は分子構造が基質(反応物)と大きく異なるため、酵素の活性化部位に結合することはできません。そのため、分解物は酵素から離脱するのです。その後、酵素は再び基質を分解します。
酵素阻害剤が医薬品になる理由
化学で酵素の特徴を学ぶのが重要な理由として、酵素阻害剤が医薬品として利用されているからです。酵素をターゲットとした薬は非常に種類が多いのです。
例えば糖の分解に関わる酵素を阻害すると、どのような結果が起こるでしょうか。この場合、糖の吸収がゆるやかになることによって、血液中の糖濃度上昇を抑えることができます。そのため、糖分解に関わる酵素を阻害する薬は糖尿病治療薬として利用されています。
また酵素の中には、血圧上昇に関わる物質の生成に関わっている酵素があります。そこで血圧上昇物質の生成に関わる酵素を阻害すれば、高血圧治療薬になります。
基質の代わりとして、活性部位に合致する化学物質(医薬品)を人工的に作り出すのです。これにより、私たちの体に作用する薬となります。
最適温度と最適pHが酵素に存在する
なお酵素はタンパク質であるため、熱や酸・塩基に弱いという性質があります。タンパク質というのは、熱や酸・塩基、重金属の影響によって変性すると機能を失い、元の状態に戻ることはありません。酵素が熱や酸などによって機能を失うことを失活といいます。
通常、温度が高いほど活性化エネルギーを超えやすくなるので反応スピードは速くなります。ただ酵素は高温で変性・失活するため、温度が高すぎると機能を失って反応スピードが急速に遅くなるのです。
一方、温度が低いと活性化エネルギーを超えるのが難しくなり、酵素は基質を効率的に分解することができません。そのため、酵素には最適温度が存在します。通常、酵素の最適温度は私たちの体温に近い35~40℃です。
・酵素の最適pH
また温度だけでなく、酵素には最適pHが存在します。私たちの体内は緩衝液によって一定のpHとなるように調節されており、これによって酵素が効率的に働けるのです。
通常、多くの酵素はpH7.0付近で反応速度が最大になります。例えば、アミラーゼの最適pHは7.0です。
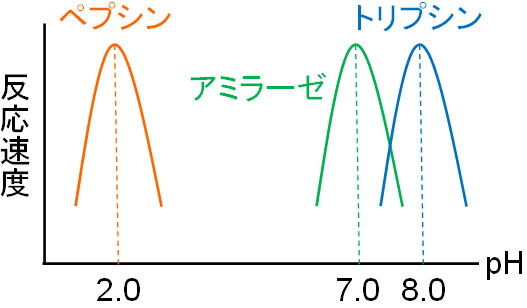
一方、酸性が最適pHの酵素も存在します。代表例がペプシンであり、最適pHは2.0です。胃液には塩酸が含まれており、強酸条件です。強酸条件であっても酵素として働く必要があるため、ペプシンの最適pHは2.0になっているのです。
酵素の化学的性質を学ぶ
生物を学ぶとき、酵素の名前や種類、体内に存在する場所を覚えなければいけません。一方で化学で酵素を学ぶとき、より重要なのは酵素の化学的性質です。
酵素には基質特異性があり、特定の物質のみを認識して分解します。基質が酵素の活性部位に入り、酵素-基質複合体を作ることによって基質が分解されるのです。また、分解された基質は形が変わることによって活性部位に留まることができず、酵素から離れていきます。
なお、酵素には最適温度と最適pHがあります。温度を高め過ぎると変性によって酵素は失活します。また酸性や塩基性では、多くの場合で酵素機能が弱まります。
酵素はタンパク質で構成される触媒であるため、通常の触媒とは異なる働きをします。そこで、酵素の化学的性質を理解しましょう。






