化学結合を学ぶことは重要であり、これによってどのように原子が互いに結合しているのか把握できます。
イオン結合は化学結合の一つです。イオンとして物質が存在していることは多く、プラスとマイナスの力によって溶液中に安定して存在することになります。
なおイオン結合がある場合、配位結合を形成することがあります。共有結合の特殊なケースが配位結合です。配位結合によって、非金属の分子にも関わらず、プラスの電荷を帯びるようになります。こうして、イオン結合を形成します。
イオン結合と配位結合は重要な化学結合です。ここでは、イオン結合と配位結合の性質や特徴を解説していきます。
もくじ
金属元素と非金属元素でイオン結合を作る
イオンを形成する化学物質は多いです。最も身近な例は食塩水です。海水には塩化ナトリウム(NaCl)が溶けており、塩化ナトリウムは水中でイオンとして存在しています。
塩化ナトリウムは固体です。それにも関わらず、水に溶けます。塩化ナトリウムはイオンになるため、水に溶けることができるのです。
原子は8個の電子をもつ状態を好みます。最外殻電子が8個の場合、原子は安定状態となるからです(水素の場合は例外的に2個の最外殻電子で安定となる)。
そこで塩化ナトリウムが水に溶けるとき、以下のようにナトリウム(Na)が一つの電子を塩素(Cl)に渡します。これにより、プラスまたはマイナスの電荷をもつ2つの物質に分かれます。この状態として存在するのがイオンです。
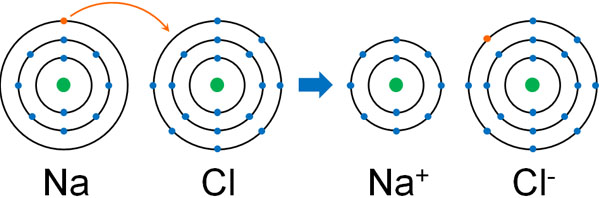
イオンというのは、多くは金属元素と非金属元素によって生成されます。実際、ナトリウムは金属であり、塩素は非金属です。陽イオンや陰イオンになる元素には、例えば以下があります。
- 陽イオン(金属元素):ナトリウム(Na+)、マグネシウム(Mg2+)、カルシウム(Ca2+)など
- 陰イオン(非金属元素):塩素(Cl–)、酸素(O2-)、水酸化物(OH–)など
これらを組み合わせることにより、例えばNaOHやCaCl2などのように表記します。また、水に溶かすことでイオンとして存在できます。
プラスとマイナスで結合するクーロン力(静電気力):共有結合との違い
なおプラスとマイナスは互いに引き合います。そのため水中に存在するイオンというのは、陽イオンと陰イオンが互いに引き合うことによって安定した状態で存在しています。
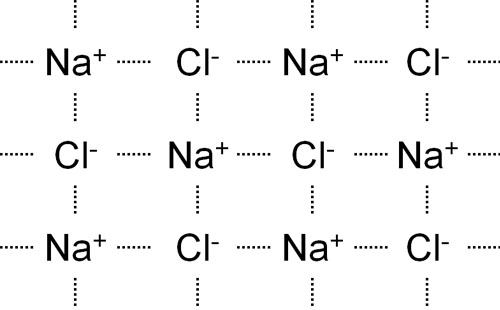
このとき、陽イオンと陰イオンが互いに引き合う力をクーロン力(静電気力)といいます。
クーロン力(静電気力)と共有結合は異なります。共有結合では電子を共有することによって結合を作ります。一方、クーロン力では陽イオンと陰イオンが互いに引き合うことによって結合を作ります。
共有結合の場合、分子を作ります。一方でイオン結合の場合、電子を出しあって結合を作っているわけではありません。イオン結合では、陽イオンと陰イオンが無限に連なっている状態となっています。
またイオン結合している化合物では、固体として存在することも可能です。塩化ナトリウム(食塩)は固体で存在できることから、これについては問題なく理解できると思います。こうしたイオン結合によってできている結晶をイオン結晶といいます。
化学結合の中でも、イオン結合は強い結合に分類されます。そのためクーロン力(静電気力)によって結合している場合、融点や沸点は高い傾向にあります。例えば、塩化ナトリウムの融点は801 ℃です。
なお固体の状態では電気を通さないものの、水に溶けると電気を通すのもイオン結晶の特徴です。溶液中で陽イオンと陰イオンへ分かれることで、電気を通すようになるのです。
イオンは組成式で記載する:分子式と組成式の違い
なおクーロン力でつながっている場合、前述の通り無数の原子が連なることになります。そのため、組成式で記載することになります。
共有結合でつながっている分子では、分子式で記すことになります。どのような原子によって構成されているのか記すのが分子式です。例えば二酸化炭素の分子式はCO2です。
それに対して、塩化ナトリウムでは多くのナトリウム(Na)と塩素(Cl)が無限大(∞)につながっています。そのため、分子式と同じように記すとNa∞Cl∞となります。ただ当然ながら、このように記載することはしません。そうではなく、最も簡単な整数比を利用して表します。これを組成式といいます。
塩化ナトリウムでは一つのナトリウムと一つの塩素がクーロン力(静電気力)によって結合します。そのため、NaClと表します。
一方、水酸化アルミニウムはどのように記せばいいでしょうか。アルミニウムイオンはAl3+であり、水酸化物イオンはOH–です。OH–を3つ集めれば、Al3+と電荷を等しくできるとわかります。そのため、AlOH3と表します。
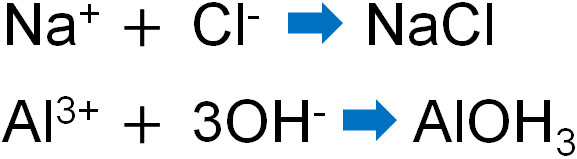
割合を表すのが組成式です。イオン結合では元素が無限に連なっているため、分子式ではなく組成式を利用して表します。
配位結合:アンモニアでひんぱんに起こる結合
なおイオン結合を学ぶと同時に、配位結合についても理解しましょう。配位結合とイオン結合は異なる化学結合であるものの、配位結合を理解していないとイオン結合を正確に把握することができません。
配位結合で最もひんぱんに出される事例がアンモニアです。アンモニアは水中で一つの水素イオン(H+)と結合する性質があります。
共有結合では、電子を出し合うことによって結合を作ります。ただアンモニアの場合、既にオクテット則を満たしており、最外殻電子は8です。つまり、電子を共有する必要はありません。
ただアンモニアが水中に溶けると、そこには多くの水(H2O)が存在します。水があるというのは、水素イオン(H+)が存在することを意味します。水素イオン(H+)には電子がないため、ほかの原子(または分子)と結合することでオクテット則を満たそうとします。
そのためアンモニアが存在する場合、水素イオンはアンモニアの非共有電子対と結合します。アンモニアが非共有電子対を提供し、電子を共有することによって新たな結合を作るのです。これを配位結合といいます。
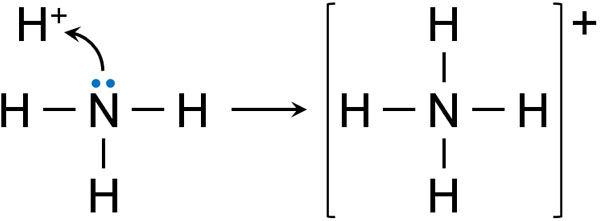
水素イオンは陽イオンです。そのためアンモニア(NH3)と水素イオン(H+)が配位結合すると、アンモニウムイオン(NH4+)として陽イオンが生成されます。
なお、配位結合は窒素原子だけに起こる現象ではありません。酸素原子についても非共有電子対があるため、配位結合を作ります。酸素原子が配位結合を作る有名な例としてはオキソニウムイオンがあります。
私たちが利用する水素イオン(H+)というのは、厳密にはオキソニウムイオン(H3O+)を指します。ただオキソニウムイオン(H3O+)では表記が面倒なので、水素イオン(H+)を利用するというわけです。
水に存在する場合、非共有電子対に対して水素イオン(H+)が結合すると、以下のようにオキソニウムイオンが生成されます。
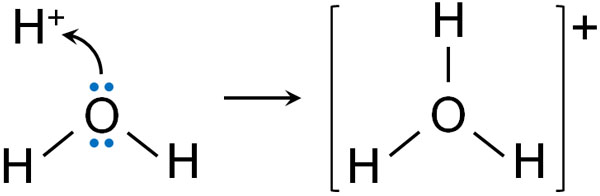
このように非共有電子対を共有することによって形成される結合が配位結合です。配位結合というのは、共有結合とは異なります。また配位結合を作る場合、イオンを作ります。ただ配位結合によって新たな結合を作った後については、共有結合と見分けることができず、性質は共有結合と似ます。
イオン結合の例外がアンモニウムイオンを含むケース
先ほどの例の配位結合では陽イオンを作ることから、水中に溶けている場合、イオン結合を作ることができます。先ほど、イオン結合は金属イオン(陽イオン)と非金属イオン(陰イオン)によって作られると解説しました。ただ、この説明は正確ではなく例外があります。
つまり、非金属イオンと非金属イオンによってイオン結合を作るケースがあるのです。この代表例がアンモニウムイオン(NH4+)です。
例えば塩化アンモニウム(NH4Cl)はイオン結合によって形成されています。アンモニウムイオン(NH4+)は金属ではないものの、陽イオンを作るため、結果的に陰イオンとイオン結合を作るのです。
イオン結合と配位結合は異なる化学結合です。ただ化合物が配位結合を形成した結果、イオン結合を作れるようになります。そこでイオン結合や配位結合、共有結合の違いを理解しましょう。
イオン結合と配位結合を学ぶ
イオンは私たちにとって身近です。日々の生活の中で食塩(塩化ナトリウム)を利用しますし、多くの調味料の中にはイオンが存在します。イオンは多くの場面で利用されているのです。
共有結合とは異なる性質がイオン結合です。陽イオンと陰イオンは互いに引き合います。プラスとマイナスによって結合する力をクーロン力(静電気力)といいます。クーロン力により、イオン結合できるのです。
またイオン結合と同様に電荷を帯びる結合が配位結合です。非共有電子対を提供することで結合を作るとき、生成する結合を配位結合といいます。配位結合を作ると、共有結合と同じ働きをします。またプラスの電荷をもつことにより、イオン結合を作ることもできます。
イオン結合と配位結合にはこうした特徴があります。クーロン力(静電気力)の性質や化学結合の違いを理解し、区別できるようにしましょう。






