原子というのは、8個の電子をもつと安定になる性質があります(水素原子の場合は例外的に2個で安定)。そのため、ほとんどのケースで化学物質は原子ではなく、分子として存在しています。分子であれば、原子は8個の電子をもつ状態になれるからです。
原子が電子を共有するときに生成する結合を共有結合といいます。化学結合の中でも、最も重要な結合が共有結合です。
共有結合を描くとき、私たちは電子式や構造式を利用します。最も利用されるのは構造式であり、必ず構造式を利用できるようになりましょう。
分子を学ぶためには、共有結合の性質を理解する必要があります。そこで電子式や構造式の利用法、不対電子、非共有電子対の意味を含めて解説していきます。
もくじ
電子を共有して作る強固な結合が共有結合
分子というのは、複数の原子が共有結合によってつながっている状態を指します。つまり、すべての分子は共有結合をもちます。酸素分子(O2)や窒素分子(N2)、水(H2O)、二酸化炭素(CO2)には共有結合があります。
それでは、共有結合とはどのような化学結合なのでしょうか。原子には決まった数の電子があります。例えば水素原子(H)には1つの電子があります。酸素原子(O)には8つの電子があります。
ただ原子として存在することはありません。理由としては、非常に不安定な状態だからです。物質というのは、最外殻電子が8個の状態で安定となります(水素の場合は最外殻電子が2個で安定)。これをオクテット則といいます。そこで、オクテット則を満たすように分子を作ります。
例えば酸素原子の最外殻電子は6であるため、2つずつ電子を共有することによって酸素分子(O2)を作ります。窒素原子であれば、最外殻電子が5であるため、3つずつの電子を共有して窒素分子(N2)を作ります。水(H2O)の場合、水素原子と酸素原子がそれぞれ1つずつ電子を共有します。
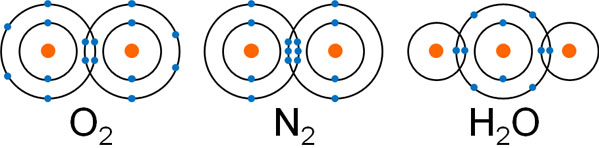
上図の分子では、すべての原子についてオクテット則を満たしています。すべての原子が電子を8個(水素原子の場合は2個)もつことにより、安定状態となるのです。
ほかの化学結合に比べて、共有結合の力は強いです。理由としては、電子を8個もつ状態が安定だからです。オクテット則を満たしている状態から、オクテット則を満たさない状態に変化させるには大きなエネルギーが必要です。そのため、共有結合の力は強いのです。
単結合、二重結合、三重結合の意味
なお、共有結合には単結合、二重結合、三重結合の3つの種類があります。先ほどの図をみてわかる通り、互いの原子が1つずつ電子を出し合うことによって共有結合を作ります。つまり、1つの共有結合を作るためには必ず2つの電子が必要になります。
そこで、水分子(H2O)を確認しましょう。水分子では水素原子と酸素原子がそれぞれ1つずつ電子を出し合い、共有結合を作っています。この場合、それぞれの共有結合には2つの電子が含まれることになり、この状態を単結合といいます。
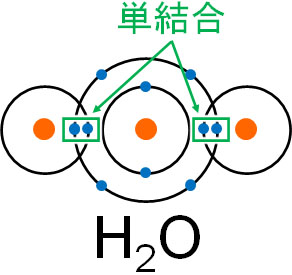
一方、電子をそれぞれ2つずつ出し合い、合計で4個の電子を共有することがあります。前述の通り、1つの共有結合を作るとき、2つの電子が必要です。そのため合計で4個の電子を利用して共有結合を作る場合、2つの共有結合が作られます。これを二重結合といいます。
酸素原子には6つの電子があるため、酸素分子になるためにはそれぞれ2つずつ電子を出し合い、合計で4つの電子を共有することになります。そのため、以下のように二重結合を作ります。
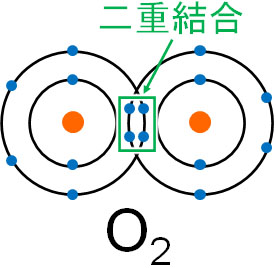
それでは、窒素の場合はどのように共有結合を作るのでしょうか。
窒素の価電子(最外殻電子の数)は5です。そこで、3つずつ電子を出し合うことにより、合計で6個の電子を共有します。そのため、3つの共有結合を作ることができ、この結合を三重結合といいます。

共有結合の種類は単結合、二重結合、三重結合のみです。共有結合に四重結合はありません。また、電子2つを利用して一つの共有結合を作ることを理解すれば、どのようなときに二重結合や三重結合を作るのか理解できます。
電子式を利用し、共有結合の様子を描く
なお共有結合の様子を描くとき、先ほどの電子軌道を描く人はいません。非常に時間がかかるからです。そこで、より簡単な方法によって共有結合の様子を描きましょう。
共有結合を描くとき、一つの方法に電子式があります。電子式では、最外殻電子(価電子)のみを描きます。原子について電子式を描くと以下のようになります。

結合を作るとき、利用されるのは最外殻電子です。そのため最外殻電子のみ描けば、結合の様子を描くことができるのです。
なお原子を利用して電子式を描く場合、最初は必ず四隅に1つの電子を配置しましょう。電子が2つペアになるのは、四隅に最低でも1つの電子を置いた後になります。
不対電子や非共有電子対は何を表すのか
最外殻電子に着目する電子式ですが、どのように分子を描けばいいのでしょうか。電子式を描く場合、希ガスを除き、必ず1つの電子または2つペアの電子が存在することになります。このとき、ペアではない電子を不対電子といいます。
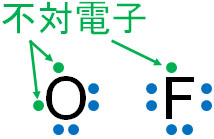
前述の取り、共有結合を作るときは互いに一つの電子を出し合います。つまり、不対電子を出し合うことによって共有結合を作ります。
酸素原子には2つの不対電子があります。そのため、酸素原子は2つの不対電子をそれぞれ出し合い、二重結合を作ります。また、水素原子には1つの不対電子があります。そのため、水素原子と酸素原子はそれぞれ1つの不対電子を出し合い、2つの単結合を作って水(H2O)になります。

共有結合が作られるとき、必ず不対電子を利用することになります。このとき、共有結合に関与しない2つの電子ペアを非共有電子対といいます。言い換えると、共有結合を作らない電子(不対電子以外)が非共有電子対になります。
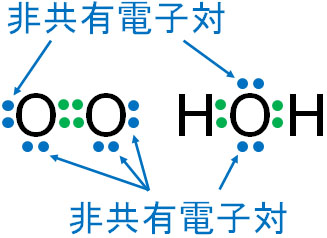
参考までに、電子を共有している部分を共有電子対といいます。
化学で重要なのは不対電子と非共有電子対です。不対電子が共有結合を作り、非共有電子対は共有結合の形成に関与しないことを理解しましょう。
構造式を利用して分子を描く
なお電子式を利用することで結合の様子がわかるものの、すべての最外殻電子を描く必要があるため面倒です。そこでほとんどの場合、化学では構造式を利用します。
構造式を描くとき、共有結合のみを記します。つまり非共有電子対を記しません。また、共有結合を描くときは線を利用します。単結合は一本の線、二重結合は二重線、三重結合は三重線となります。
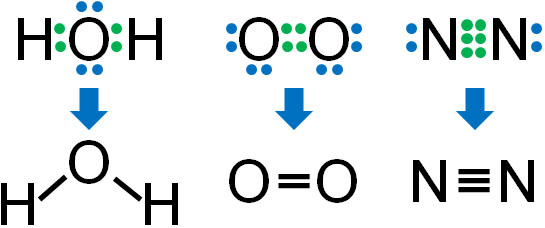
共有結合を作る場合、必ず不対電子の数が合わなければいけません。例えば酸素原子の不対電子は2つであり、水素原子の不対電子は1つです。そのため、酸素原子1つと水素原子2つが結合し、水(H2O)となります。
また酸素原子同士が2つの不対電子を共有すると、酸素分子(O2)となり、二重結合を作ります。不対電子を3つもつ窒素原子2つが不対電子を共有する場合、三重結合を有する窒素分子(N2)になります。
ほとんどの化合物は構造式を利用して描かれます。構造式を理解していない場合、化学の問題を解くことはできないため、必ず構造式を利用できるようになりましょう。
共有結合の性質と描き方を学ぶ
化学結合の中でも最も重要なのが共有結合です。分子として存在する場合、必ず共有結合をもつことになります。
不対電子を共有することにより、強い力で結合を作るのが共有結合です。このとき、いくつの不対電子を共有するのかによって、共有結合の数が変わります。電子2つで1つの共有結合を作ります。そのため、共有結合には単結合、二重結合、三重結合があります。
また結合に関与しない電子ペアを非共有電子対といいます。電子式を描くことにより、非共有電子対を確認しましょう。なお実際に化合物を記すとき、非共有電子対を省く方法として、構造式が多用されます。そこで、構造式の書き方を理解しましょう。
あらゆる化合物で共有結合をもちます。そこで共有結合の性質を学び、構造式を利用して化合物を描けるようになりましょう。






