金属元素の中には、酸にも塩基にも反応する物質があります。これを両性元素といいます。2つの異なる性質があるため、珍しい元素になります。
無機化学で両性元素を学ぶとき、4つの金属元素を覚えましょう。両性元素にはアルミニウムAl、亜鉛Zn、スズSn、鉛Pbがあります。両性元素には共通した特徴があるため、どのような性質があるのか覚えるのです。
また、それぞれの元素に特徴的な性質も学びましょう。両性元素で特に重要なのはアルミニウムと亜鉛であり、特にこの2つの元素の特徴を理解するのは重要です。
無機化学で両性元素を学ぶとき、元素の特徴を一つずつ覚えるのは非効率です。そこで全体の特徴を学んだあと、それぞれの元素の性質を理解しましょう。
もくじ
両性元素の種類:酸性・塩基性の両方と反応する
両性元素の場合、単体や酸化物、水酸化物を含め、酸と塩基の両方とも反応して塩を作ります。要は、酸や塩基と反応しやすい物質と理解すればいいです。両性元素は以下の4つです。
- アルミニウム:Al
- 亜鉛:Zn
- スズ:Sn
- 鉛:Pb
※ベリリウムBeなど、他にも両性元素は存在するものの、無機化学で特に重要な両性元素がこの4つです。
なお酸や塩基と反応するというのは、これらの金属はイオンになることを意味します。このときアルミニウムはAl3+となり、その他の両性元素は2価の陽イオン(Zn2+、Sn2+、Pb2+)になります。
両性元素と酸との反応
まず、両性元素と酸の反応を確認していきましょう。両性元素と酸の反応では、水素または水が発生します。金属単体を反応させる場合、イオン化傾向によって水素を得ることができます。以下がイオン化傾向の順番です。
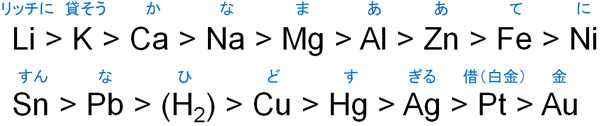
一方、酸化物や水酸化物を反応させる場合、水を得られます。
なお、ここでは2価の陽イオンになる両性元素(Zn、Sn、Pb)はMと表します。以下では、「M=Zn、Sn、Pb」という前提で話を進めていきます。
・単体+酸
金属を強酸に入れると、イオン化傾向によって水素が発生することが広く知られています。両性元素はどれも水素よりもイオン化傾向が高く、強酸水溶液に金属を入れることによってH2が発生します。
- 2Al + 6HCl → 2AlCl3 + 3H2
- M + 2HCl → MCl2 + H2
・酸化物+酸
一方、酸化物にはOが含まれているため、H+を加えることによってOと反応し、H2Oを生じます。
- Al2O3 + 6HCl → 2AlCl3 + 3H2O
- MO + 2HCl → MCl2 + H2O
・水酸化物+酸
水酸化物にもOが含まれているため、H+を加えることによってOH–と反応し、H2Oを生じます。
- Al(OH)3 + 3HCl → AlCl3 + 3H2O
- M(OH)2 + 2HCl → MCl2 + 2H2O
・アルミニウムは硝酸、熱濃硫酸との反応で不動態を生じる
なおアルミニウムと酸が反応するとき、注意点があります。前述の通り、アルミニウムと酸が反応すると水素を得ることができます。ただ例外として、アルミニウムに硝酸または熱濃硫酸を加える場合は反応が進行しません。
硝酸と熱濃硫酸には酸化作用があります。アルミニウムに酸化作用のある酸を加えると、金属表面に酸化被膜が形成されます。これによって酸との反応が止まり、それ以上は酸化されません。この状態を不動態といいます。
塩基と両性元素との反応は2種類ある
酸との反応は理解しやすいです。イオン化傾向学んでいる場合、水素が発生することは既に理解していると思います。一方、塩基と両性元素の反応は少し複雑です。このとき、以下の3パターンに分けて考えましょう。
- 少量の塩基(水酸化物イオン)を加えるときの反応
- 過剰の水酸化ナトリウムを加えるときの反応
- 過剰のアンモニア水を加えるときの反応
それぞれのパターンでどのような反応が起こるのか確認しましょう。
少量の塩基(水酸化物イオン)を加えるときの反応
少量の塩基を加える場面では、少量の水酸化ナトリウムやアンモニア水を加えるときを考えましょう。少量の水酸化ナトリウムやアンモニアを加えるというのは、水酸化物イオンが水溶液中に存在するのと意味が同じです。
つまり、OH–が水溶液中に存在するときの反応を考えましょう。この場合、両性元素では以下の化学反応が起こります。
- Al3+ + 3OH– → Al(OH)3
- M2+ +2OH– → M(OH)2
この場合、すべての両性イオンは水酸化物イオンと反応することで沈殿を生じます。Al(OH)3、Zn(OH)2、Sn(OH)2、Pb(OH)2は水に溶けないため、水溶液中に生じた固体は沈殿します。
過剰の水酸化ナトリウムを加えると錯イオンを形成する
一方、多量の水酸化ナトリウムを加えることで水溶液中に過剰のOH–がある場合はどのような化学反応が起こるのでしょうか。
金属イオンに対して、分子や陰イオンが配位結合することで生じるイオンを錯イオンといいます。両性元素に対して過剰の水酸化ナトリウムを加えると、錯イオンを形成して溶けます。つまり少量のOH–が存在する場合は沈殿するものの、過剰のOH–があると両性元素は水溶液中に溶けます。
- Al3+ + 4OH– → [Al(OH)4]–
- M2+ +3OH– → [M(OH)4]2-
少量のOH–と多量のOH–で化学反応が異なることを理解しましょう。
・両性元素の単体・酸化物・水酸化物は過剰な水酸化ナトリウムに溶ける
なお過剰の水酸化ナトリウムを加える場合、両性元素は単体・水酸化物・酸化物のすべてのパターンで水溶液に溶けます。
注意点として、単体の金属が反応するときは化学反応式にH2Oが加わります。
- 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
- M + 2NaOH + 2H2O → Na2[M(OH)4] + H2
酸化物が反応するときも、同様に化学反応式にH2Oが存在します。
- Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
- MO + 2NaOH + H2O → Na2[M(OH)4]
なお水酸化物の場合、OHが加わることで反応が完了するため、化学反応式にH2Oは存在しません。
- Al(OH)3 + NaOH → Na[Al(OH)4]
- M(OH)2 + 2NaOH → Na2[M(OH)4]
化学反応式を作るとき、H2Oを利用するのか、それとも利用しないのか区別できるようになりましょう。
過剰のアンモニア水を加える場合、亜鉛は錯イオンを形成する
両性元素では過剰のアンモニアを加える場合の化学反応も理解しましょう。過剰のアンモニア水を加えるというのは、少量のOH–と過剰のNH3が存在することを意味しています。アンモニアは弱塩基であり、電離度が低く、水溶液中でわずかしか電離していないのです。
両性元素の中では、亜鉛Znのみアンモニアと反応します。少量のアンモニア水を加える場合、前述の通りOH–の影響によってZn(OH)2が生成します。ただ過剰のアンモニアが存在する場合、OHがNH3に置き換わります。その結果、以下のようになります。
- Zn(OH)2 + 4NH3 → [Zn(NH3)4]2+ + 2OH–
なおAl(OH)3、Sn(OH)2、Pb(OH)はアンモニアと反応しません。そのためアンモニア水を過剰に加えても水溶液中に溶けず、沈殿物を生じたままとなります。
両性元素に特有の特徴を学ぶ
ここまで、両性元素に共通する性質を解説してきました。それでは、それぞれの元素がもつ性質にはどのような特徴があるのでしょうか。無機化学で両性元素を学ぶとき、それぞれの元素の性質も覚えましょう。
なお両性元素で重要になるのはアルミニウムと亜鉛です。この2つの元素は私たちの日常生活でも利用されることが多いです。
一方、スズと鉛は重要度が落ちます。ただ両性元素を学ぶとき、スズと鉛を含めて性質を理解しましょう。
アルミニウムAlは融解塩電解によって得られ、ミョウバンを形成する
アルミニウムはイオン化傾向が強く、水溶液を電気分解してもアルミニウムを単体で得ることはできません。そのため融解塩電解を利用してアルミニウムの単体を得ます。
ボーキサイト(酸化アルミニウムAl2O3を主成分とする原料)を利用し、高温に熱すると酸化アルミニウムが溶けます。この状態で電気分解することによって、単体のアルミニウムが生成されるのです。
・アルミニウムは不動態を作る
前述の通り、硝酸または熱濃硫酸にアルミニウムを加えても反応は進行しません。アルミニウムの表面に酸化被膜が作られ、これによって反応がストップします。これを不動態といいます。
・アルミニウムを利用してミョウバンを作れる
通常、塩(えん)は一種類の化合物で構成されます。ただ場合によっては、二種類の塩(化合物)によって、一つの塩が形成されることがあります。これを複塩といいます。
ミョウバンは複塩であり、硫酸アルミニウムAl2(SO4)3と硫酸カリウムK2SO4を混ぜることで、一つの結晶となって析出します。そのため、ミョウバンの化学式ではAlとKとSO4を利用して以下のように表します。
- AlK(SO4)2·12H2O
なお、ミョウバンは硫酸カリウムアルミニウム十二水和物といいます。
・テルミット反応による激しい燃焼
単体のアルミニウムはイオン化傾向が強いため、できるだけ早くイオンになりたいと考えています。つまり、アルミニウムは酸化されやすいです。
そのため酸化鉄Fe2O3とアルミニウムAlの粉末を混ぜて火をつけると、激しい光と炎と共にアルミニウムが酸化鉄を還元します。
- 2Al + Fe2O3 → Al2O3 + 2Fe
この反応をテルミット反応といいます。少量の酸化鉄とアルミニウムを利用してテルミット反応を起こす場合、激しい光や炎は花火のようでキレイです。ただ酸化鉄とアルミニウムの量を多くしてテルミット反応を起こすと爆発します。
亜鉛Znは塩基性条件で硫化水素を加えると白色固体になる
亜鉛がイオンになると、2価の電荷をもつ陽イオンになります。アルミニムと同じように、イオン化傾向が高いです。
無機化学で亜鉛を学ぶとき、過剰のアンモニアと錯イオンを形成することに加えて、硫化水素H2Sとの反応を覚えましょう。亜鉛を含む塩基性水溶液に硫化水素を通すと、硫化亜鉛ZnSを生じます。ZnSは白色の固体であり、硫化水素によって白色沈殿を起こします。
- Zn2+ + H2S → ZnS + 2H+
注意点として、酸性溶液に硫化水素を通してもZnSによる白色沈殿は起こりません。中性・塩基性の水溶液にH2Sを通すことで、ZnSによる沈殿を生じます。
またイオン化傾向を学ぶとき、トタン(亜鉛Zを利用し、鉄Feの表面を覆った金属)を習います。トタンに傷があって雨水が付着している場合、亜鉛は鉄よりもイオン化傾向が強いため、鉄よりも先に亜鉛が溶け出します。
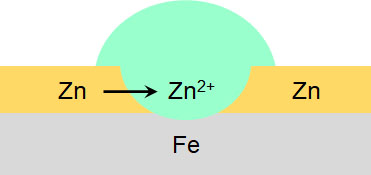
これによって鉄の腐食(サビ付き)を防ぐことができます。そのため、トタンは屋根などの傷付きやすい場所で主に利用されます。
スズSnと鉛Pbの特徴
次にスズSnと鉛Pbの性質を確認しましょう。スズの特徴としては、塩化スズ(Ⅱ)SnCl2に還元作用があることを覚えましょう。塩化スズ(Ⅱ)SnCl2は以下のように、電子を渡すことで塩化スズ(Ⅳ)SnCl4になります。
- SnCl2 + Cl2 → SnCl4 (Sn2+ → Sn4+ + 2e–)
+4の酸化数をもつ塩化スズのほうが安定であるため、塩化スズ(Ⅱ)SnCl2は還元剤として働きます。
なおスズはブリキ(スズSnを利用して鉄Feの表面を覆った金属)として利用されています。鉄に比べて、スズはイオン化傾向が弱いです。そのためブリキに傷があると、鉄のほうが優先的に水の中に溶けだします。
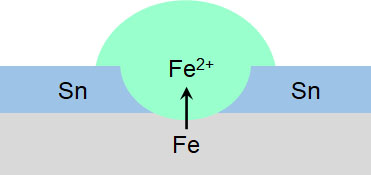
ただ傷がない場面では、スズはイオン化傾向が鉄よりも低いため、金属が溶け出す現象を防げます。そのため缶詰の内側など、傷を生じるリスクの低い場面でブリキが利用されます。
・鉛はさまざまなイオンと反応する
なお鉛はさまざまなイオンと反応し、固体として析出して沈殿する性質があります。以下が代表例です。
- Pb2+ + 2Cl– → PbCl2(白色固体)
- Pb2+ + SO42- → PbSO4(白色固体)
- Pb2+ + S2- → PbS(黒色固体)
- Pb2+ + CrO42- → PbCrO4(黄色固体)
特にPbCl2の性質は重要です。PbCl2は白色の固体を生じて沈殿します。ただPbCl2は冷水だと白色固体であるものの、熱水では水に溶けます。
銀イオンAg+はCl–と反応し、AgClを生じます。AgClは熱水であっても溶けません。そのためPbCl2とAgClが混ざっている場合、熱水を利用することで金属を分けることができます。こうした性質を知っていると、金属の分離が可能になります。
両性元素の種類と性質を学ぶ
無機化学で重要な分野の一つが両性元素です。金属単体、酸化物、水酸化物が酸と塩基の両方と反応する場合、両性元素です。両性元素にはアルミニウムAl、亜鉛Zn、スズSn、鉛Pbがあります。
両性元素と酸の反応は簡単です。一方、塩基との反応では3パターンに分かれます。塩基の種類や加える量によって、生成物が異なるのです。
また、それぞれの両性元素がもつ特徴も覚えましょう。アルミニウムや亜鉛、スズ、鉛に特徴的な性質が存在するのです。
特殊な性質をもつ金属が両性元素です。両性元素を学ぶとき、まずは共通する内容を覚えましょう。その後、それぞれの金属がもつ性質を理解すると効率的です。






