電解質溶液に対して電気を流すことにより、物質を生成させることができます。これを電気分解といいます。
どのような種類の電極を使うのか、またどのような電解質に電気を流すのかによって生成される物質は異なります。同じ電解質に電気を流すにしても、利用する電極が違えば生成する物質が異なるため、なぜこうした違いを生じるのか理解しなければいけません。
また流す電流の大きさや時間によって物質の生成量が変わります。そこで電気量(クーロン)を利用して、どれだけの量の物質が生成されるのか計算できるようになりましょう。
電気分解では複数のパターンに分けて「生成物が何になるのか」を考える必要があり、計算問題も出されます。そこで、電気分解の内容を解説していきます。
もくじ
電気を流すことで化学反応が起こる:陰極と陽極での反応
電気が流れるという意味では、電池と電気分解は同じです。ただ電池と電気分解は異なる化学反応です。
イオン化傾向の違いによって電子が動き、電気を生じる場合、それは電池です。一方で電気を流した結果、電子が動くことで化学反応を起こすのが電気分解です。
- 電池:化学反応(電子の移動) → 電気の発生
- 電気分解:電気の発生 → 化学反応(電子の移動)
このような違いがあります。電池と導線をつなげば、電気が流れることによって電気分解が起こります。電池には負極と正極があります。負極とつないだ電極を陰極、正極とつないだ電極を陽極といいます。陰極と陽極は定義なので覚えるようにしましょう。
電池では負極から正極へと電子が流れます。つまり電子は電池の負極を出発し、陰極を通り、電解質の水溶液を通り、陽極を通って電池の正極へと戻ります。
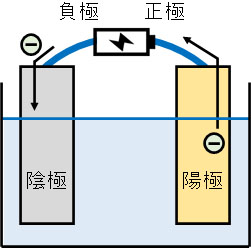
電気分解を理解するとき、まずは電子の流れを覚えましょう。電子の流れる向きがわかれば、陰極や陽極でどのような反応が起こるのかわかります。
陰極では電子が流れてきます。そのため陰極では物質が電子を受け取ることで還元反応が起きています。一方、陽極では物質が電子を失い、電子が放出されることで電子は電池の正極へと戻ります。つまり陽極では、酸化反応が起きています。
- 陰極(還元反応):M+ + e– → M
- 陽極(酸化反応):X– → X + e–(またはX → X+ + e–)
電子の流れる向きを理解すれば、陰極と陽極のどちらで酸化反応(または還元反応)が起こるのか覚える必要はありません。
陰極での還元反応:水素よりイオン化傾向の低い金属に着目する
それでは、電気分解によってどのような物質が生成するのか理解しましょう。まず、陰極での反応(還元反応)を考えます。
陰極での還元反応で確認しなければいけないのは一つだけです。以下のポイントに着目しましょう。
- 水溶液に水素よりもイオン化傾向の弱い金属(銅や銀など)が含まれているか
イオン化傾向が弱いというのは、「金属はイオンではなく金属単体の状態で存在したい」と考えていることを意味しています。
H+よりもイオン化傾向が弱い金属としては、銅(Cu)や銀(Ag)などが存在します。そのためこうした金属が水溶液中に溶けている場合、電子を受け取ることでイオンから金属単体になって析出します。
- Cu2+ + 2e– → Cu
- Ag+ + e– → Ag

・水が反応する場合:水素の発生
一方、水溶液中に水素よりもイオン化傾向の強い金属が溶けている場合、どのような化学反応が起こるのでしょうか。この場合、水素H2が発生します。
水素よりもイオン化傾向の強い金属がイオンとして溶けている場合、水が優先的に電気分解されて水素が生成されます。水に溶けている金属よりも、水素イオンのほうが水素分子H2になりたいと考えているからです。
なお、酸性条件と塩基性条件では反応が異なります。酸性条件では溶液中に多くのH+があるため、H+が電子を受け取ることによってH2が生成されます。
- 2H+ + 2e– → H2
一方、中性や塩基性条件では水溶液中にH+がほとんど存在しません。そこで、水は以下のように水酸化物イオンと水素に変換されます。
- 2H2O + 2e– → 2OH– + H2
水溶液が酸性なのか、それとも中性・塩基性なのかによって反応の様子は異なります。ただ、水素が発生するという意味では同じです。
陽極での酸化反応:電極と電解質(ハロゲンかどうか)に着目する
次に陽極で起こる酸化反応を確認しましょう。陰極では電解質の水溶液にのみ着目すればいいです。それに対して、陽極では電極と電解質の2つを考慮しなければいけません。
陽極での反応では、最初に電極に着目しましょう。
・電極が金(Au)やプラチナ(Pt)、炭素(C)以外の場合
金(Au)やプラチナ(Pt)はイオン化傾向が弱く、電気分解でイオンになることはありません。炭素(C)については、金属ではないのでイオンにはなりません。そのため電極が金(Au)やプラチナ(Pt)、炭素(C)の場合、電極が反応することはありません。
一方で「銀(Ag)または銀よりもイオン化傾向の強い金属」が電極に利用されている場合、金属自身が酸化されることによって溶液中に溶けだします。例えば亜鉛(Zn)や鉄(Fe)、銅(Cu)、銀(Ag)などが電極として利用されている場合、以下のように金属(電極)が酸化されて溶液中に溶けだします。
- Zn → Zn2+ + 2e–
- Cu → Cu2+ + 2e–
- Ag → Ag+ + e–
・電極が金(Au)やプラチナ(Pt)、炭素(C)であり、溶液中にハロゲンが含まれる
一方で電極が金(Au)やプラチナ(Pt)、炭素(C)の場合、前述の通り金属(電極)が溶け出すことはありません。そのため、溶液中に存在する電解質が酸化されます。
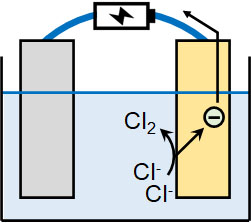
このとき、溶液中に存在するイオンの種類に着目しましょう。溶液中に塩素や臭素などのハロゲンが含まれる場合、ハロゲンが酸化されることでCl2やBr2が生成されます。
- 2Cl– → Cl2 + 2e–
- 2Br–→Br2 + 2e–
・電極が金(Au)やプラチナ(Pt)、炭素(C)で溶液中にハロゲンが含まれない
それでは、電極が金(Au)やプラチナ(Pt)、炭素(C)であり、溶液中にハロゲンが含まれない場合はどのような化学反応になるのでしょうか。この場合、電極は反応せず、水に溶けている電解質も反応しません。そのため、水が酸化されます。
そこで先ほどと同じように、水溶液が酸性なのか、それとも塩基性なのかで分けましょう。水溶液が塩基性の場合、水の中には多くのOH–が存在します。OH–は電子をもっているため、電気分解によって酸化され、水と酸素が生成されます。
- 4OH– → 2H2O + O2 + 4e–
一方、酸性や中性の場合は水溶液中にOH–がほとんどありません。そのため、H2Oが分解されることによって酸素が発生します。
- 2H2O → O2 + 4H+ + 4e–
電気分解によって酸素が発生するのは共通しています。ただ水溶液が酸性・中性なのか、それとも塩基性なのかによって反応の様子が異なります。
電気分解の事例:塩化ナトリウム、硫酸銅、塩化銅、水酸化ナトリウム
それでは、実際に電気分解の事例を確認しましょう。以下の場合、陰極と陽極で起こる反応式は何でしょうか。
| 水溶液 | 電極 |
| HCl水溶液 | 陰極:Ag |
| 陽極:C | |
| CuSO4水溶液 | 陰極:Cu |
| 陽極:Cu | |
| CuCl2水溶液 | 陰極:Pt |
| 陽極:Pt | |
| NaOH水溶液 | 陰極:C |
| 陽極:C |
・陰極での反応式
陰極については、水に溶けている電解質に着目しましょう。水素よりもイオン化傾向が弱い金属が溶けている場合、金属が析出します。それ以外の場合、水素が発生します。そのため、陰極では以下の反応が起こります。
- HCl水溶液:2H+ + 2e– → H2
- CuSO4水溶液:Cu2+ + 2e– → Cu
- CuCl2水溶液:Cu2+ + 2e– → Cu
- NaOH水溶液:2H2O + 2e– → 2OH– + H2
・陽極での反応式
それに対して、陽極では電極と電解質の両方に着目しましょう。ここまで解説した内容をふまえると、以下の反応が起こります。
- HCl水溶液:2Cl– → Cl2 + 2e–
- CuSO4水溶液:Cu → Cu2+ + 2e–
- CuCl2水溶液:2Cl– → Cl2 + 2e–
- NaOH水溶液:4OH– → 2H2O + O2 + 4e–
ファラデー定数を利用し、物質の生成量を計算する
ここまで、電気分解によって得られる生成物について解説してきました。それでは、電気を流すことによってどれだけの量の物質を得ることができるのでしょうか。このとき重要なのが電気量(クーロン)であり、ファラデー定数を利用することで生成する物質の量を計算できます。
電気量の単位はクーロン(C)であり、電流(A:アンペア)と時間(s:秒)を利用することで、以下の式によって計算できます。
- 電気量(C) = 電流(A) × 時間(s)
また電気量を利用すれば、電子の量がわかります。1つの電子e–について、電気量の値は1.602×10-19Cであることがわかっています。そこで電気量を物質量へ変換するため、アボガドロ数をかけましょう。

こうして得られた96500C/molをファラデー定数といいます。なぜファラデー定数が便利かというと、電気量96500Cは電子1molに相当するため、電気量から生成する物質の量を計算できるからです。
例えば、以下の問題の答えは何でしょうか。
- CuCl2水溶液に対して5Aの電流を16分5秒流すとき、陰極で生成されるCuの物質量はいくらでしょうか。なお、ファラデー定数を96500C/molとします。
まず、電気量を求めましょう。16分5秒は965秒なので以下のようになります。
\(5×965=4825\)
前述の通り、電子1molは96500Cになります。そのためファラデー定数を利用して比例式を作ると、4825Cでは電子0.05molに相当するとわかります。
\(96500:1=4825:x\)
\(x=\displaystyle\frac{4825}{96500}\)
\(x=0.05\)
なおCuCl2水溶液を電気分解するとき、陰極では以下の反応式になります。
- Cu2+ + 2e– → Cu
2molの電子によって、1molの銅が生成されます。そのため0.05molの電子では、0.025molの銅が生成されます。こうして、答えは0.025molとわかります。
電気分解の応用法
電気分解を利用することによって、特定の生成物を得ることができます。このとき、電気分解は多くの工業分野で応用されています。実際にどのような応用例があるのか学びましょう。
有名な事例としては以下があります。
- イオン交換樹脂を利用し、NaClからNaOHを得る
- 銅の電解精錬により、純度の高い金属を得る
- 融解塩電解によって金属単体を得る
それぞれの内容について確認していきます。
イオン交換樹脂を利用し、NaClからNaOHを得る:イオン交換膜法
水酸化ナトリウムの工業的製法としてイオン交換膜法が知られています。塩化ナトリウム水溶液を電気分解することによってNaOHを得るのです。
イオン交換膜法で重要なポイントとして、陽イオン交換樹脂を利用することがあげられます。陽イオン交換樹脂を利用する場合、陽イオンは自由に陽イオン交換樹脂を通過できるものの、陰イオンは通過することができません。
そこで陰極側(Fe電極)に純水、陽極側(C電極)にNaCl水溶液を入れます。そうすると、以下の反応が起こります。
- 陰極側:2H2O + 2e– → 2OH– + H2
- 陽極側:2Cl– → Cl2 + 2e–
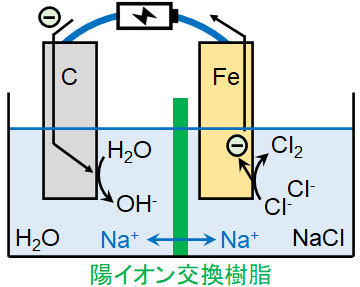
電気分解が進むと、陽極ではCl–がCl2に変わり、陰イオンの数が少なくなります。一方、陰極ではOH–が生成されるため、陰イオンの数が多くなります。そこでバランスを取るため、NaCl水溶液に溶けていたNa+は陽イオン交換樹脂を通過し、陰極側へ移動します。
その結果、陰極側ではNa+とOH–が溶けていることになります。こうして、イオン交換膜法によって大量のNaOH水溶液を作ることができます。
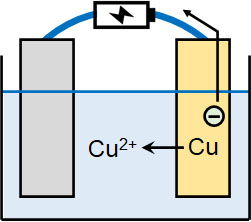
銅の電解精錬により、純度の高い金属を得る
次は、電気分解を利用して金属の純度を高める方法を学びましょう。例えば銅山から採掘した銅には不純物が混ざっており、純度が低いです。そこで電気分解を利用し、金属の精錬を行うことを電解精錬といいます。
銅の電解精錬を行うとき、陰極には純度の高い銅を利用し、陽極には粗銅(不純物を含む銅)を利用します。水溶液として硫酸銅(Ⅱ)CuSO4水溶液を利用する場合、以下の反応が起こります。
- 陰極側:Cu2+ + 2e– → Cu
- 陽極側:Cu → Cu2+ + 2e–
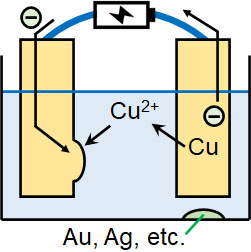
陽極側では粗銅から銅が溶け出し、陰極側では純度の高い銅として新たな銅が析出します。こうして純度の高い銅を得ることができます。
なお粗銅から銅が溶け出すとき、金(Au)や銀(Ag)など、銅よりもイオン化傾向の低い金属については、取り囲んでいる銅が溶け出すことによって単体にて下に沈殿します。この沈殿を陽極泥といいます。
銅イオンが生成され、銅単体が析出するため、全体では陽極から陰極へ銅が移動し、陽極泥が生成されます。これにより、純度の高い銅を得られます。
融解塩電解によって金属単体を得る
電気分解をするとき、陰極では「水素よりもイオン化傾向の弱い金属(銅や銀など)が水溶液に溶けているかどうかに着目する」と解説しました。水素よりもイオン化傾向が強い金属元素が溶けている場合、金属が析出することはありません。
つまり、カリウム(K)やカルシウム(Ca)、ナトリウム(Na)、マグネシウム(Mg)、アルミニウム(Al)などの金属がイオンとして水溶液中に存在しても、金属単体が析出することはありません。金属単体では、イオン化傾向の弱いH2が生成されるからです。
そこで、こうした金属を電気分解によって得る方法に融解塩電解があります。水が存在するため、水素が発生するのです。つまり水が存在しない場合、金属単体を得られることがわかります。
融解塩電解では水溶液を利用せず、金属の塩(えん)や酸化物などを高温にすることで液体にします。その後、この液体を電気分解することで金属単体を得ます。この方法が融解塩電解です。
例えば酸化アルミニウム(Al2O3)を高温で熱し、液体にします。この液体に対して炭素(C)の電極を用いて電気分解します。そうすると、陰極と陽極では以下の化学反応が起こります。
- 陰極:Al3+ + 3e– → Al
- 陽極:C + O2- → CO + 2e– or C + 2O2- → CO2 + 4e–
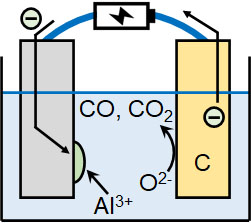
陰極ではアルミニウムが析出し、陽極では電極の炭素が酸化されることで一酸化炭素(CO)または二酸化炭素(CO2)が発生します。反応が進むと電極の炭素は消費され、薄くなっていくため交換が必要になります。
いずれにしても、融解塩電解を利用することによって、イオン化傾向の強い金属元素であっても単体で取り出すことができます。
電気分解で起こる化学反応の種類はさまざま
イオン化傾向を学ぶことによって理解できる内容に電気分解があります。電池と電気分解は似ているものの、異なる内容です。電気を流すことによって、結果として化学反応を生じるのが電気分解です。
電気分解では、陰極と陽極についてどちらで酸化反応が起こり、還元反応が起こるのか理解しましょう。電子の流れを知れば、区別できるようになります。また電気分解による生成物に何があるのか答えられるようになりましょう。
なお、流した電力量(クーロン)によって生成する物質量がわかります。ファラデー定数を利用し、生成物の物質量を計算しましょう。
ここまでの内容を学べば、どのように電気分解を工業化に応用させているのかも理解できます。電気分解というのは、工業において多くの場面で利用されているのです。