高校の有機化学では、芳香族化合物の性質を覚えた後、芳香族化合物の分離方法を学びます。複数の芳香族化合物が混ざっているとき、どのように化合物を分離すればいいのか覚えるのです。
有機化学の研究室にとって、芳香族化合物の分離操作は非常に重要です。また、毎日の実験で行う操作でもあります。ただ高校化学で学ぶ芳香族化合物の分離は内容が難しくありません。理由としては、酸と塩基による中和反応を理解すればいいからです。
芳香族化合物によって酸性、中性、塩基性が異なります。そのため芳香族化合物の性質を覚えていれば、芳香族化合物の分離が可能です。
それでは、どのような器具を用いて芳香族化合物の分離を行うのでしょうか。また、分離するときの理論はどのようになっているのでしょうか。複数の芳香族化合物が混ざっている状態について、どのように分離すればいいのか解説していきます。
もくじ
分液漏斗を用いるエーテル層(油層)と水層の分離
有機化合物を取り扱うとき、多くの場面で利用される実験器具が分液漏斗です。有機化合物を分離・抽出するときに分液漏斗を利用します。
分液漏斗を使うとき、有機溶媒として酢酸エチルやジエチルエーテルを利用します(多くの場合、酢酸エチルを有機溶媒として利用します)。
芳香族化合物は有機溶媒に溶けます。ただ有機化合物であっても、イオン化している場合は有機溶媒に溶けません。有機溶媒に溶けない代わりとして、水に化合物が溶けます。この性質を利用して化合物を分離・抽出する実験器具が分液漏斗です。以下が分液漏斗です。
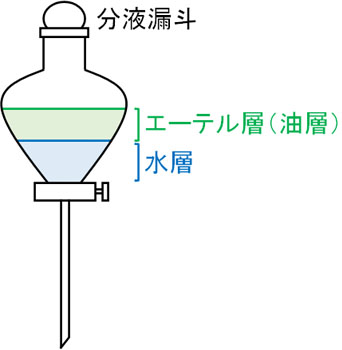
油と水は混ざりません。そのため分液漏斗に有機溶媒と水を加える場合、上層と下層に分かれます。上層は有機溶媒であり、下層は水です。水に油を注ぐと、油は水に上に浮きます。そのため分液漏斗に有機溶媒(油)と水を加えるとき、上層が有機溶媒になると予想するのは簡単です。
このとき上層をエーテル層(油層)、下層を水層といいます。油に溶ける場合はエーテル層に化合物が存在し、水に溶ける場合は水層に化合物が存在します。
有機化合物は油層に溶け、イオンは水層に溶ける
通常、構造式にベンゼン環をもつ化合物は水に溶けません。ただ例外があり、イオン化している場合は水に溶けます。
芳香族化合物によっては、酸または塩基を加えることによってイオン化する化合物があります。例えばアニリンは塩基性を示すことが知られています。
アニリンは油との親和性が強いため、分液漏斗の中ではエーテル層に存在します。ただ塩酸を加える場合、中和反応によってアニリンはイオン(アニリン塩酸塩)となります。イオンの場合、前述の通り水に溶けるため、アニリン塩酸塩はエーテル層から水層へ移動します。
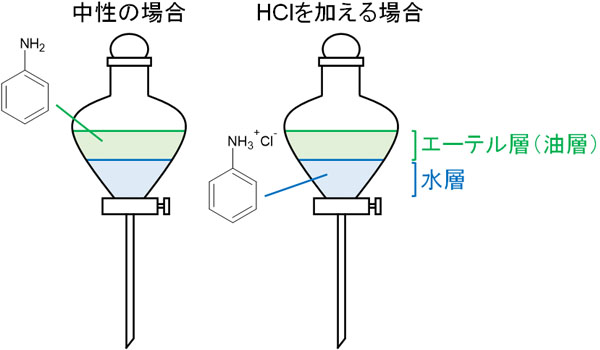
つまり酸性または塩基性をもつ芳香族化合物では、水溶液が酸性または塩基性の場合、水層へ移動するのです。
中和反応を利用して化合物を分離する
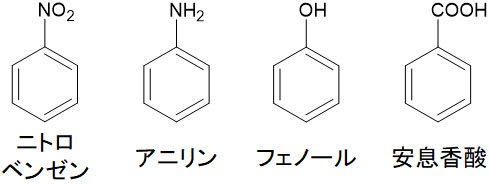
そこで中和反応を利用して化合物を分離しましょう。以下の化合物が有機溶媒に溶けている場合、どのように化合物を分離すればいいのでしょうか。
- ニトロベンゼン
- アニリン
- フェノール
- 安息香酸
芳香族化合物の性質や酸性の強さを理解している場合、芳香族化合物の分離は難しくありません。そこで、順に確認していきましょう。
塩酸を利用し、アニリンをイオンにする
有機化合物を分離するとき、有機溶媒に溶けているのか、それとも水層に溶けているのかを見極めましょう。中性の場合、すべての芳香族化合物は有機溶媒に溶けます。そこで、酸性または塩基性にすることによって化合物を分けるのです。
有機溶媒に溶けている化合物を確認すると、アニリンのみが塩基性物質です。そのため塩酸を加えることによってアニリンはアニリン塩酸塩となり、油層から水層へ移動します。その後、分液漏斗のコックを開き、油層と水層を分けることによって化合物を分離できます。
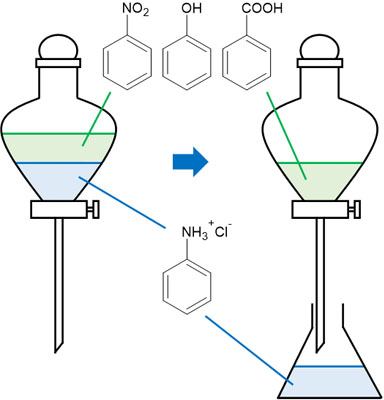
アニリン塩酸塩が溶けている水溶液については、水酸化ナトリウム水溶液を加えることによってアニリン塩酸塩はアニリンとなり、再び有機溶媒に溶けるようになります。アニリンは弱塩基であるため、強塩基を加えることによって弱塩基の遊離が起こります。
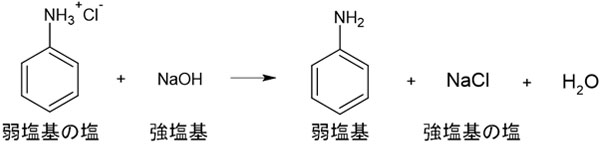
Cl–は強酸由来であり、強い塩基と結合したいと考えています。そのためCl–はアニリンではなく、強塩基由来のNa+とイオン結合を作るのです。水酸化ナトリウムによってアニリン塩酸塩をアニリンに変換し、有機溶媒に溶かすことによってアニリンを得ることができます。
炭酸水素ナトリウムを加えると安息香酸がイオンになる
アニリンを分けることができたら、次はニトロベンゼン、フェノール、安息香酸を分けましょう。フェノールと安息香酸は酸性であるため、塩基性にすることでイオン化すればいいとわかります。
フェノールと安息香酸で重要なのは、酸性の強さに違いがあることです。酸性の強さは以下のようになっています。
- HCl, H2SO4 > R-COOH > H2CO3 > フェノール
カルボン酸は炭酸よりも酸性が強いです。一方、フェノールは炭酸よりも酸性が弱いです。この違いを利用して、フェノールと安息香酸の一方だけをイオン化しましょう。具体的には、炭酸水素ナトリウムを加えます。
炭酸とイオンを作っているNa+は強塩基由来であり、より強い酸とイオン結合を作りたいと考えています。フェノールは炭酸よりも弱い酸であるため、Na+はフェノールと反応しません。しかしカルボン酸は炭酸よりも強い酸であるため、Na+は炭酸ではなくカルボン酸と塩を作ります。
つまり炭酸水素ナトリウムを加える場合、フェノールはイオンにならず、安息香酸のみがイオン化します。こうして、安息香酸をエーテル層から水層へ移すことができます。
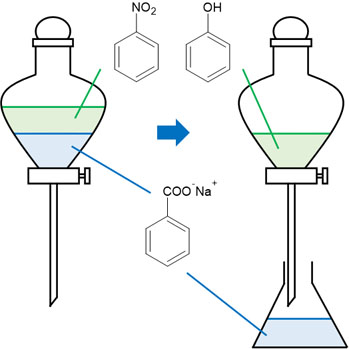
水層に存在する安息香酸ナトリウムに対して、塩酸を加えると安息香酸へ戻すことができます。こうして、安息香酸のみを抽出できます。
水酸化ナトリウムにより、フェノールがイオンになる
次に水酸化ナトリウムを加えましょう。前述の通り、炭酸水素ナトリウムを加えてもフェノールはイオン化しません。そこで強塩基である水酸化ナトリウムを加えます。そうするとフェノールはイオンとなり、ナトリウムフェノキシドとして存在することになります。
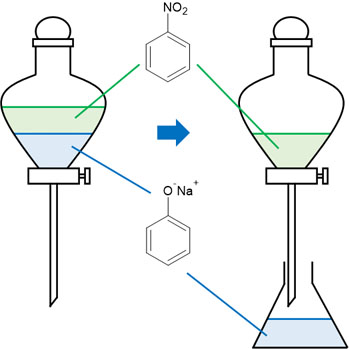
つまり油層にはニトロベンゼンが残り、ナトリウムフェノキシドは水層に移ります。こうして、ニトロベンゼンとフェノールを分けることができます。
水層に存在するナトリウムフェノキシドについては、塩酸や炭酸などの酸を加えることによってフェノールに戻すことができます。酸を加えてエーテル層にフェノールを溶かすことによって、化合物の分離・抽出が完了します。
ニトロベンゼンは酸性でも塩基性でもないため、常に油層に存在します。そこで芳香族化合物の中でも、酸性化合物と塩基性化合物に着目して分離・抽出をしましょう。
なお水とは異なり、有機溶媒は沸点が低く蒸発しやすいです。そこで有機溶媒を蒸発させることにより、ニトロベンゼン、アニリン、フェノール、安息香酸の単体を得ることができます。
芳香族化合物の抽出では酸性と塩基性に着目する
複数の化合物が混ざっている状態から単体の化合物を抽出するとなると、難しいように思います。ただ芳香族化合物の分離・抽出に関する化学の問題は難しくありません。中和反応に着目すればいいからです。
重要なのは、アニリンが塩基性であることです。芳香族化合物の中でも、塩基性を有する化合物は芳香族アミンだけです。そのため塩酸を加えることによってアニリンは水層に溶けます。
またフェノールとカルボン酸、炭酸について、酸性の強さを覚えましょう。カルボン酸のほうが炭酸よりも酸性が強いため、炭酸水素ナトリウム水溶液を加える場合、カルボン酸はイオンになります。一方、フェノールはイオンになりません。そのため、安息香酸のみ水層へ移動させることができます。
こうして酸塩基反応を利用し、油層と水層を分けることによって化合物の分離・抽出が可能になります。化合物の分離は有機化学で重要な分野なので、どのように分離・抽出すればいいのか理解しましょう。