有機化学の合成反応機構を理解するとき、重要な要素としてカルボカチオンの安定性があります。カルボカチオンは不安定な物質なので、すぐに反応を起こします。しかし同じカルボカチオンであっても、どのような分子構造なのかによって安定性に違いが出てきます。
こうした違いを理解するのは非常に重要です。カルボカチオンの安定性が変わると、起こる反応が違ってくるからです。
これには、超共役という現象が関与しています。またこの現象を理解すれば、ラジカルやカルボアニオンの安定性についても予測できるようになります。
カルボカチオンは合成反応の中間体の一つです。ここではカルボカチオンの安定性について学び、そこからラジカルやカルボアニオン、アリルカチオンなど、その他の中間体に関する安定性まで解説していきます。
もくじ
安定性に関わる第三級、第二級、第一級カルボカチオン
中間体として重要なのがカルボカチオンです。有機化学ではカルボカチオンが出てくることが多く、中間体の中では理解するのが容易です。そのため、最初はカルボカチオンの性質について説明していきます。
カルボカチオンは分子の置換基によって安定性が変わります。以下のように、なっています。
- 第三級 > 第二級 > 第一級
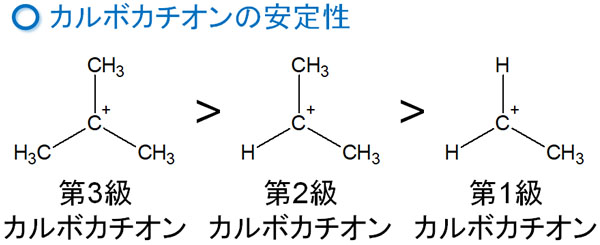
プラスの電荷をもつカルボカチオンに対して、何個のアルキル鎖(または水素原子)が結合しているのかによってカルボカチオンの安定性が変わります。
多くの人はこの順を見て、覚えようと努力します。理由を理解しないまま、次のステップに進みます。
ただ、カルボカチオンについて中間体の性質や共鳴構造を理解することは重要です。SN1反応を含め、主要な有機合成反応にも関与します。そこで、なぜこのような順になるのかについての理由を学ぶようにしましょう。
カルボカチオンはsp2混成軌道で平面となる
なぜ分子構造の違いにより、カルボカチオンの安定性が異なるのでしょうか。これには、超共役という現象が関わっています。カルボカチオンでの超共役とは、分かりやすく考えると次のように表現できます。
- 結合に関与している電子が、プラス電荷の炭素原子に電子を与える現象
カルボカチオンはどのような分子の形をしているでしょうか。カルボカチオンはsp2混成軌道となっています。互いの結合角が120°になっている化合物はすべてsp2混成軌道です。以下のようになります。
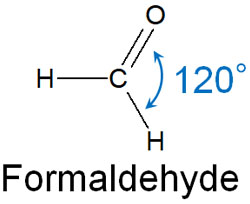
カルボカチオンでは、炭素原子に対して3本の結合があります。これらの結合はそれぞれ、最も離れた場所に位置します。その結果、結合角が120°になります。
同時にsp2混成軌道では、それぞれの原子が同じ平面上に位置するようになります。カルボカチオンでは、カチオン炭素に結合している原子はすべて平面上に存在します。
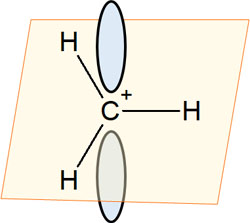
こうした構造をしていることが超共役の理解に大切です。またカルボカチオンには空の軌道があります。電子を2つ入れることのできる空の軌道(p軌道)があるため、超共役を説明するとき、プラス電荷の炭素原子の上下に軌道を描くのが一般的です。
超共役によって電子が非局在化する
このとき、炭素原子に結合しているのが水素原子ではなく、メチル基(CH3)であればどうでしょうか。この場合、以下のようになります。
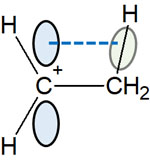
カルボカチオンからは、前述の通り垂直に空のp軌道が伸びています。このp軌道と、隣にあるメチル基のC-H結合が相互作用します。これが超共役です。
電子を共有することで、炭素と水素は結合しています。このときの単結合をσ結合(シグマ結合)といいます。ただカルボカチオンのように電子が不足している原子があると、σ結合を形成している電子はカルボカチオンと電子を共有するようになります。
カルボカチオンのp軌道とメチル基のC-H結合は平行です。その結果、σ結合(C-H結合)を形成している電子は、プラス電荷をもつ炭素原子と電子を共有します。
炭素原子は電子を押し出す働きがあります。電子供与基として機能するのがアルキル鎖です。そのため力は弱いながらも、カルボカチオンの隣にある炭素原子の影響により、カチオンが安定化します。
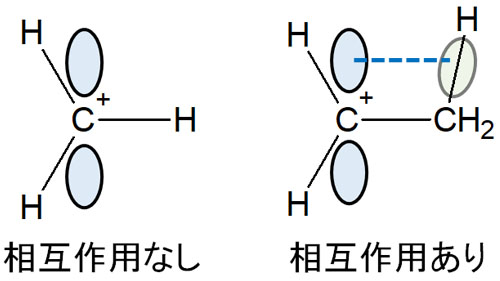
一方で隣にアルキル鎖(メチル基など)がない場合、どうでしょうか。炭素原子に水素原子が直接結合しているカルボカチオンでは、p軌道と平行に重なる軌道が存在しません。そのため超共役がなく、カチオンは安定化しません。
また隣にアルキル鎖があるほど、C-H結合を形成している電子(σ結合の電子)はカルボカチオンの炭素原子と電子を共有します。その結果、カルボカチオンはより安定化します。これが、第三級カルボカチオンで最も安定性が高くなる理由です。
電子は広い範囲に存在するほど安定しやすいです。これを電子の非局在化といいます。超共役によってC-H結合の電子がカルボカチオンと相互作用するほど、電子が非局在化して安定構造となります。
実際のところ、メチルカチオンは存在しません。また、第一級カルボカチオンも自然には生成しません。一方で第二級カルボカチオンなら、少し生成します。第三級カルボカチオンになると、安定性が高くなるためより生成する確率が高くなります。
有機化学の合成反応で重要なものの一つにSN1反応があります。SN1反応はカルボカチオンが最初に生成し、化学反応を起こします。SN1反応では第三級カルボカチオン(または第二級カルボカチオン)の生成がメインです。この理由は、第三級カルボカチオンの安定性が高いからです。
平面で空のp軌道と相互作用する
このようにカルボカチオンが超共役するため、カルボカチオンにアルキル鎖が結合しているほどカチオンは安定化します。ただこれには条件があります。それは、空のp軌道と相互作用できる場合です。
カルボカチオンでは必ず空のp軌道が生まれます。アルキル鎖が結合している場合、カルボカチオンのp軌道とC-H結合が平行に重なることができるため、結果として超共役が生まれます。それに対して、平行にて空のp軌道と電子が相互作用できない場合、第三級カルボカチオンであっても安定ではありません。
例えば、以下のような化合物でカルボカチオンは生成しません。
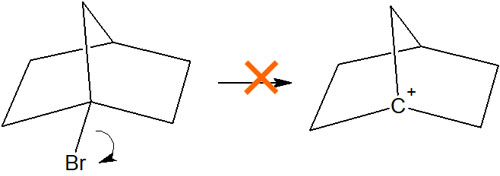
なぜ第三級カルボカチオンにも関わらず、こうした化合物は生成しないのでしょうか。この化合物の場合、カルボカチオンになったとしても、空のp軌道と隣のC-H結合が平行になりません。そのためカルボカチオンが安定しません。
メチルカチオンが生成されないのと同じように、第三級カルボカチオンであっても超共役が起こらない場合はカチオンが生まれません。カルボカチオンが安定化する理由としては、単結合(σ結合)の電子とカルボカチオンが電子を弱く共有することを理解しましょう。
ラジカルの安定性はカルボカチオンと同じ
同じように考えると、他の中間体についても安定性を理解できるようになります。有機化学反応では、ラジカルを生成することがあります。ラジカルはどのような立体構造になっているのでしょうか。ラジカルでは、カルボカチオンと同じように3つの結合があり、sp2混成軌道となります。
カルボカチオンとは異なり、ラジカルでは1つの不対電子をもちます。そのためカルボカチオンとは性質が異なるものの、安定性を考えるときの考え方は同じです。ラジカルの安定性は以下のようになっています。
- 第三級 > 第二級 > 第一級
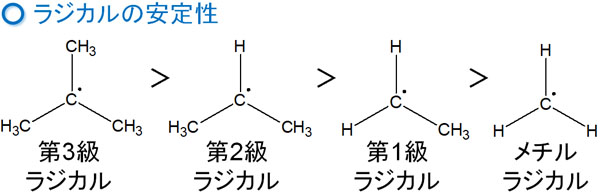
ラジカルの安定性がこのような順になるのは超共役による影響です。つまり、カルボカチオンの安定性とまったく同じ理由によって、ラジカルの安定性を説明できます。
ラジカルについても、カルボカチオンと同様に電子が不足しています。その結果、安定性の順がカルボカチオンと同じになります。
カルボアニオン(カルバニオン)の安定性は逆になる
このように電子の非局在化を考慮すれば、カルボカチオンやラジカルの安定性を理解できるようになります。一方で、カルボアニオン(カルバニオン)の安定性はどうなっているのでしょうか。
カルボアニオンはマイナスの電荷を有します。そのためカルボカチオンやラジカルとは性質がまったく異なり、超共役をすることはありません。またカルボカチオンやラジカルと比べて、カルボアニオンの安定性は以下のように逆になります。
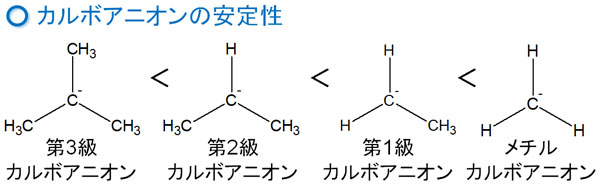
この理由としては、同じように電子の非局在化で考えれば説明できます。
前述の通り、炭素は電子供与基として働きます。カルボアニオンの電子を分散させるとき、隣に炭素原子が結合していると、アニオンの電子を分散させることができません。隣の炭素原子によって電子が押し出されるようになり、むしろ電子密度が高くなります。その結果、分子は不安定な状態になります。
メチルアニオンと第三級カルボアニオンを比べると、メチルアニオンのほうが電子は広く分布できて非局在化が可能です。一方、第三級カルボアニオンは電子密度が高いのです。
・電気陰性度によって誘起効果が起こると安定化する
参考までに、メチルアニオンの水素原子がハロゲンであればどうでしょうか。この場合、電気陰性度の強いハロゲンによって、メチルアニオンの電子はより広い範囲に分散します。こうして非局在化することにより、メチルアニオンはより安定化します。
電気陰性度によって、同じ分子の中で電荷の違いを生じることを誘起効果といいます。誘起効果によって、アニオン中間体の安定性が異なるようになります。
超共役による安定化とは原理が異なります。しかし、電子の非局在化によって安定性が変わるのは、カルボカチオンと原理が同じです。
二重結合(アリルカチオン)や芳香環(ベンジルカチオン)での安定性
これら中間体の安定性について学んだら、次に共役構造を有する化合物の安定性を理解するようにしましょう。「中間体が安定になるためには電子の非局在化が重要である」ということを学べば、アリルカチオンやベンジルカチオンの安定性について理解しやすいです。
アリルカチオンには二重結合があります。ベンジルカチオンではベンゼン環があります。以下のような構造を有する化合物がアリルカチオンやベンジルカチオンです。
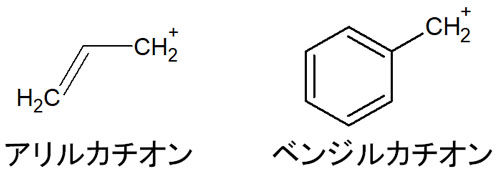
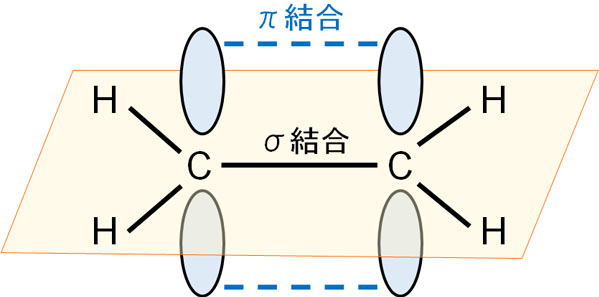
二重結合や三重結合には、π結合が関与しています。π結合では、上下に軌道が伸びていることが知られています。最初の単結合は必ずσ結合です。そこからさらに二重結合や三重結合を作るとなると、電子軌道を上下に伸ばし、この状態で頑張って結合を作ります。
無理に結合を作ろうとしているため、π結合は結合力が弱いです。
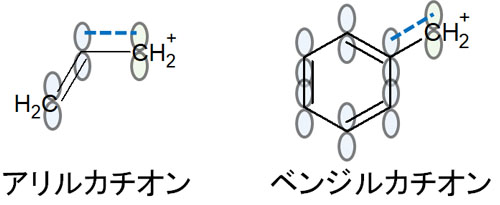
ただこのように上下にπ軌道が存在することから、カルボカチオンの空軌道と電子を共有することができます。
また、アリル化合物やベンジル化合物では共鳴構造を書くことができます。例えばベンジルカチオンでは以下のようになります。
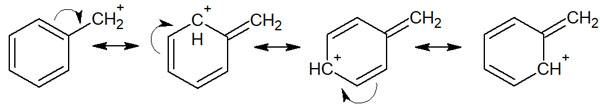
二重結合(アルケン)や芳香環(ベンゼン環)があると、共鳴構造を書くことができます。その結果、アリルカチオンでもベンジルカチオンでも安定化します。一ヵ所だけでカチオンが存在するわけではなく、電子が非局在化することで多くの場所でプラスの電荷を負担するのです。その結果、共鳴によって分子が安定化します。
第一級カルボカチオンが自然に生成することはありません。しかし第一級カルボカチオンであったとしても、共鳴構造を書ける場合は例外的に安定です。そのため、アリルカチオンやベンジルカチオンが生成されます。
例えば第二級カルボカチオンと第一級アリルカチオンを比べたとき、第一級アリルカチオンのほうが安定です。
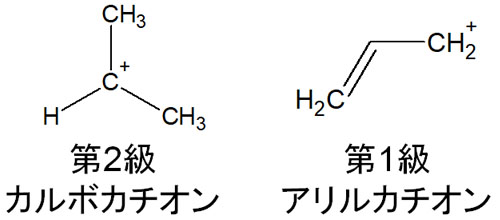
結合しているアルキル鎖が少ないため、第一級アリルカチオンのほうが超共役による影響は少ないです。しかし共鳴の作用があるため、構造は安定化しやすいです。
アリルラジカルやベンジルラジカルも同じく安定
まったく同じことはラジカルにもいえます。アリルラジカルやベンジルラジカルだと、安定性が高くなります。以下がアリルラジカルとベンジルラジカルの構造式です。
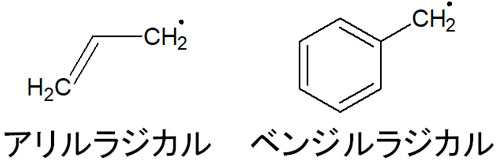
アリルラジカルやベンジルラジカルでは共鳴します。例えば、以下はベンジルラジカルの共鳴構造です。
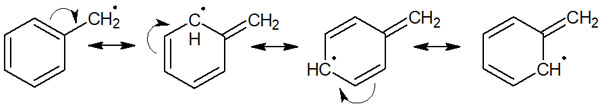
二重結合による共役構造が存在することで共鳴し、安定構造をとることができます。その結果、電子の非局在化によってアリルラジカルとベンジルラジカルは安定します。
もちろん安定とはいっても、カルボカチオンやラジカルは非常に不安定であり、反応性が高い中間体であることには変わりありません。ただ中間体の生成のしやすさを考えたとき、安定性を理解することは重要です。
いずれにしても、ラジカルはカルボカチオンと同じ理由により、安定性に順番があると理解しましょう。
なおラジカルの場合、安定性の順番は以下のようになります。
- ベンジルラジカル>アリルラジカル>第三級ラジカル>第二級ラジカル>第一級ラジカル
ラジカルの場合、共鳴による電子の非局在化が強く関わります。またアリルラジカルよりも、芳香環をもつベンジルラジカルのほうが、より多くの共鳴構造を書けます。その分だけ電子は非局在化し、安定性が上昇します。
注意点として、カルボカチオンではこの順になりません。ただラジカルでは、この順番によって安定性が変わってくることを理解しましょう。
・アリルアニオンやベンジルアニオンも安定
参考までに、アリル化合物やベンジル化合物については、アニオンも安定です。マイナスの電荷をもつ炭素を生じたとき、隣に二重結合(アルケン)やベンゼン環があると安定になりやすいのです。
理由はカチオンやラジカルと同じであり、共鳴するからです。共鳴構造によって電子がいろんな場所に存在できることにより、安定性は大きくなると理解しましょう。
中間体の安定性が有機化学の合成反応に関与する
どのように化合物が反応するのか予測するとき、中間体生成物の安定性がどうなっているのかについて理解する必要があります。中間体が安定であるほど、中間体を生成しやすくなります。これは、有機合成反応が進みやすいことを意味しています。
中間体としてはいくつかありますが、代表的な中間体がカルボカチオンやカルボアニオン、ラジカルです。特にカルボカチオンはSN1反応という、重要な合成反応に関与します。
カルボカチオンとラジカルの安定性を理解するとき、以下のことを理解しましょう。
- 第三級は安定
- アリル化合物(隣に二重結合がある)は安定
- ベンジル化合物(隣にベンゼン環がある)は安定
カルボアニオン(カルバニオン)では、第三級は不安定です。そのため安定性の順序を反対にしなければいけません。しかしカルボアニオンでは、アルケンであるアリル化合物や、芳香環が隣にあるベンジル化合物だと安定になりやすいのは共通しています。
なぜこれらの中間体が特定の順番で安定性を示すのか、できるだけ分かりやすく解説してきました。これらの理由を学び、有機合成の反応機構を理解していきましょう。






