有機化学では多くの場合、酸と塩基によって合成反応が進みます。ルイス酸とルイス塩基が反応することで、新たな結合を作るのです。
それでは化合物が化学反応するとき、どの種類の原子同士が結合するのでしょうか。この点について、化合物がどの場所で化学反応するのか予想しやすくなる法則にHSAB則があります。酸と塩基について、HSAB則では硬い酸や柔らかい塩基などと表現します。
どの原子が硬く、どの原子が柔らかいのか厳密に覚える必要はありません。表を確認すればいいからです。ただHSAB則の概念を理解することで、どのように合成反応が進行するのか理解するのは重要です。
HSAB則は無機化学で重要な経験則ですが、研究室での実験では、有機化学のほうが頻繁にHSAB則を利用します。そこで、どう考えてHSAB則を利用するのかを含めて解説していきます。
もくじ
原子を硬さ・柔らかさで判断する意味
酸と塩基の定義はいくつかあります。これら酸と塩基としては、ブレンステッド・ローリーの定義が分かりやすいです。相手にH+(水素原子)を与える分子がブレンステッド酸であり、H+(水素原子)を受け取る分子がブレンステッド塩基です。
ただ有機化学では、ブレンステッド・ローリーの定義だけで考えることはありません。酸と塩基の反応では、必ずしもH+(プロトン)が動くとは限らないからです。
そこで、ルイス酸とルイス塩基によって考えます。ルイス酸とルイス塩基が反応するとき、反応のしやすさを予測する方法がHSAB則です。
・同じ性質の酸と塩基で結合を作る経験則がHSAB則
それでは、なぜHSAB則を学ぶことが重要なのでしょうか。前述の通り、どのように化学反応するのか予測できる法則がHSAB則です。
HSAB則では以下のようになります。
- 硬い酸は硬い塩基と強い結合を作る
- 柔らかい酸は柔らかい塩基と強い結合を作る
強い結合を作るとは、つまり反応が進行しやすいことを意味しています。例えば硬い酸を加えた場合、柔らかい塩基ではなく硬い塩基と反応が進行しやすいです。こうした性質がHSAB則であり、分子同士の反応のしやすさに関与しています。
原子(イオン)の硬い、柔らかいの概念
それでは、原子が硬い・柔らかいとはどういう意味なのでしょうか。これにはいくつかの要素があるものの、特に分極のしやすさが影響しています。
硬い酸(Hard acid)や硬い塩基(Hard base)では、分極しにくくなっています。一方で柔らかい酸(Soft acid)や柔らかい塩基(Soft base)では分極しやすいです。
どのようなとき、分極のしやすさが関与するのでしょうか。これには、原子半径が影響しています。原子半径が小さければ、電子は原子核に強く引き寄せられています。原子核にはプラスの電荷をもつ陽子が存在するため、マイナスの電荷をもつ電子は原子核に引き寄せられ、結果として分極しにくくなっています。
一方で原子半径が大きい場合、電子は原子核から離れます。そのため原子核による影響が弱く、分極しやすいです。
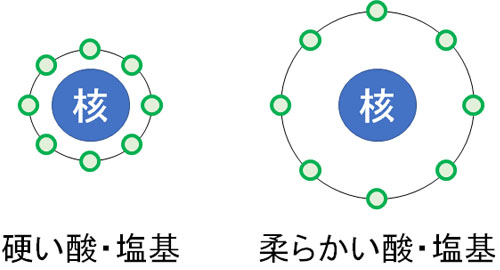
柔らかい原子の場合、プラスまたはマイナスの電荷を有する化合物が近くにあると分極しやすくなります。硬い原子と柔らかい原子では、このような違いがあります。
HSAB則の覚え方はどうする?
これらHSAB則によると、イオンの硬い・柔らかいは以下のように分類されます。
・酸の分類
| 硬い酸 | H+、Li+、Na+、Mg2+、Ca2+、Al3+、Fe3+、Si4+、BF3、AlCl3など |
| 中間の酸 | Fe2+、Cu2+、Zn2+、R3C+など |
| 柔らかい酸 | Cu+、Ag+、Au+、Hg+、Hg2+、BH3、RS+、I2、Br2など |
・塩基の分類
| 硬い塩基 | H2O、OH–、F–、Cl–、NO3–、ROH、RO–、NH3、RNH2など |
| 中間の塩基 | Br–、N3–、NO2–、aniline、pyridineなど |
| 柔らかい塩基 | H–、CN–、R2S、RSH、RS–、I–、R–、R3P、CO、benzeneなど |
これらの一覧をすべて正確に覚えるのは意味がありません。ただ大まかな覚え方を学び、区別できるようにしておく必要があります。
原子半径が小さく、負の電荷が小さい場合は硬い酸・塩基になりやすいです。一方、原子半径が大きく、負の電荷が大きい場合は柔らかい酸・塩基になりやすいです。またHSAB則では、以下の傾向があります。
・原子周期表の下にいくほど原子(イオン)は柔らかい
原子周期表の上にある原子は半径が小さいです。それに対して、原子周期表の下にある原子であるほど、原子半径が大きくなって柔らかい酸・塩基になります。
例えば、原子周期表の上にあるH+やアルカリ金属、アルカリ土類金属は硬い酸です。また塩基を見ても、F–やCl–は硬い塩基です。ただBr–は中間の塩基であり、I–は柔らかい塩基です。これには、イオン半径が大きく関与しています。
・硬い原子に結合するとイオンは硬く、炭素に結合すると柔らかい
電気陰性度の高い原子(F、O、Nなど)は硬い原子です。これら硬い原子が結合している場合、イオンは硬くなりやすいです。NO3–、NH3などがこれに該当します。それに対して、炭素に結合している分子の場合は柔らかいイオンになりやすいです。
もちろん、この判断基準だけでは見分けがつかないことは多いです。HSAB則はあくまでも、経験則にすぎません。
・価数の大きい金属イオンは硬い
また、価数の大きい金属イオンは硬い傾向があります。Al3+、Fe3+、Si4+などが該当します。
それに対して、同じ鉄イオンであってもFe2+は中間の酸です。価数が変われば、イオンの硬さ・柔らかさが異なります。
静電相互作用と軌道相互作用で反応性が異なる
ルイス酸とルイス塩基では、それぞれの分子ごとに硬いまたは柔らかいという違いがあることは理解できました。それでは、なぜこのような違いを生じるのでしょうか。また、なぜ硬いイオン同士や柔らかいイオン同士で結合を作りやすいのでしょうか。
これには、静電相互作用と軌道相互作用の2つが関与しています。
プラスとマイナスの電荷が引き合う力を静電相互作用といいます。原子半径が小さく、硬い酸・塩基の場合は静電相互作用が化学反応に大きく関与します。硬い酸と硬い塩基が互いに反応しやすいのは、酸・塩基による化学反応が起こりやすいからです。
一方で原子半径が大きい場合、分極の度合いによって化学反応が起こるというよりも、分子軌道が重なることで合成反応が進行することが多いです。分子軌道にはHOMO(結合性軌道)とLUMO(反結合性軌道)があり、分子に存在する軌道が影響し合うことで電子が移動するのです。
原子半径が大きいと、プラスとマイナスの電荷による影響よりも、分子軌道が重なって結合を作ることのほうが重要です。そのため、柔らかい酸・塩基は反応しやすいです。
有機化学の反応予測に役立つのがHSAB則
それでは、HSAB則を学ぶことが何に役立つのでしょうか。前述の通り、無機化学の分野の一つがHSAB則です。錯体化学などでHSAB則を学びます。
ただ実際のところ、HSAB則は無機化学よりも有機化学で頻繁に利用されます。反応させる試薬同士が硬いのか、それとも柔らかいのかによって、起こる反応を予測できるからです。そこで分子について、硬い・柔らかいを把握するようにしましょう。
例えば、以下の求核置換反応(SN2反応)が起こる場面を考えましょう。
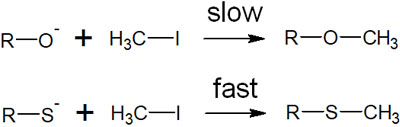
アルコキシド(RO–)とチオラート(RS–)を比較すると、アルコキシドのほうが塩基性は高いです。そのため、アルコキシドとヨードメタンのほうが素早く反応するように思えてしまいます。しかし実際には、チオラートとヨードメタンのほうが反応速度は速いです。
なぜ、そのようになるのでしょうか。これはHSAB則で説明できます。硫黄原子は酸素原子に比べて、原子半径が大きいです。またヨウ素イオンも原子半径が大きいです。そのため柔らかい酸と塩基が軌道相互作用し、素早く化学反応して新たな結合を作ります。
グリニャール試薬でのHSAB則の反応例
またHSAB則を学ぶことで、位置選択性を理解することもできます。有機化学では、試薬がどの位置で反応するのか予測することは非常に重要です。HSAB則で頻繁に用いられる有機反応としては、グリニャール反応があります。
分子内にマグネシウム金属をもつ化合物がグリニャール試薬です。マグネシウムを含むグリニャール試薬は硬い求核剤であり、強塩基です。グリニャール試薬はマイナスの電荷を帯びており、プラスに分極しているカルボニル炭素を攻撃します。
つまり、硬い酸と硬い塩基が反応することで化学反応が起こります。酸と塩基による反応が起こるのです。グリニャール試薬で1,2付加が起こるのは、HSAB則によって説明できます。
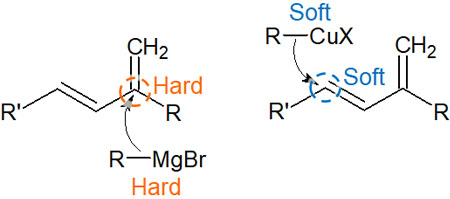
一方で同じ有機金属化合物であったとしても、有機銅試薬では反応性が変わります。有機銅試薬をギルマン試薬と呼びます。ギルマン試薬では分子内に銅が存在し、銅は原子のサイズが大きく柔らかい金属です。
そのため、柔らかい部分である二重結合の炭素を攻撃します。酸と塩基による影響よりも、分子軌道の重なりによる影響のほうが強いため、カルボニル炭素ではなく二重結合を攻撃します。その結果、1,4付加(マイケル付加)が起こります。
有機金属化合物での1,2反応と1,4反応(マイケル付加)の違いは、HSAB則の反応例として頻繁に利用されます。ただもちろん、その他の有機反応についても、HSAB則によって反応の進行を予測できます。
合成反応をHSAB則で予測する
どのように化学反応が起こるのかについて、すべて覚えるという方法があります。ただ、頑張って覚えるのは大変です。そこで、どのように化学反応が起こるのかについての法則を理解するようにしましょう。そうすれば、覚えなくても反応機構を推測できるようになります。
これらの法則の一つがHSAB則です。原子やイオンについて、それぞれ硬い・柔らかいといった種類があります。酸と塩基について、それぞれ性質が異なるのです。
酸と塩基について、硬い分子と柔らかい分子をすべて覚える必要はありません。ただ、どのような性質を有する化合物だと、硬い(または柔らかい)のかを学ぶようにしましょう。
これにより、化学反応の速度や位置選択性を予測できます。無機化学での錯体よりも、有機化学で頻繁に利用されるのがHSAB則です。有機化学の反応でHSAB則を利用し、どのような反応が起こるのか予測できるようにしましょう。






