6員環の化合物を合成するとき、最初に考慮するべき合成反応があります。それがペリ環状反応です。ペリ環状反応の中でも、最も有名な反応がディールス・アルダー反応です。
有機化学反応では、ルイス酸とルイス塩基が反応に関与するのが一般的です。ただペリ環状反応では、合成反応に酸と塩基は関与しません。アニオン中間体やカチオン中間体は存在せず、電子が一度に動くことで環状化合物が合成されます。
化合物の形が大きく変わるため、ペリ環状反応の反応機構は複雑です。また立体化学を考慮して生成物を予測する必要があります。
そのため、複雑になりやすいのがペリ環状反応です。そこでペリ環状反応の中でも、最も重要なディールス・アルダー反応について確認していきます。
もくじ
最も有名なペリ環状反応がディールス・アルダー反応
「ペリ環状反応といえば、ディールス・アルダー反応」というほど、代表的な反応がディールス・アルダー反応です。ペリ環状反応を学ぶとき、全員が最初にディールス・アルダー反応を勉強しなければいけません。
例えば、以下の反応はディールス・アルダー反応です。
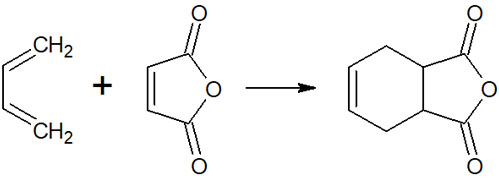
化合物を加熱するだけで上図の反応が進行します。ルイス酸やルイス塩基は存在せず、触媒を加える必要もありません。中間体なしに、6員環の化合物を合成できます。
ドイツの化学者であるオットー・ディールス(Otto Diels)とクルト・アルダー (Kurt Alder)によって発見された合成反応がディールス・アルダー反応です。この発見により、彼らは1950年のノーベル化学賞を受賞しています。
共役ジエンと求ジエン体(アルケン)による反応機構
それでは、ディールス・アルダー反応の反応機構はどのようになっているのでしょうか。どのようにして、環状化合物が合成されるのでしょうか。
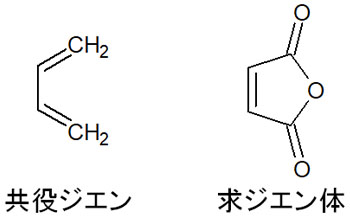
ディールス・アルダー反応では必ず2つの化合物が必要です。一つは共役ジエンです。2つの二重結合が共役して存在する化合物を利用します。また、もう一つの化合物としてアルケンを利用します。アルケンであれば何でもいいわけではなく、求ジエン体(ジエノフィル)と呼ばれる分子を利用します。
先ほどの合成反応では、共役ジエンと求ジエン体はそれぞれ以下のようになります。
2つの化合物の電子が動くことで6員環の遷移状態となり、6員環の化合物が合成されます。反応機構は以下のようになります。
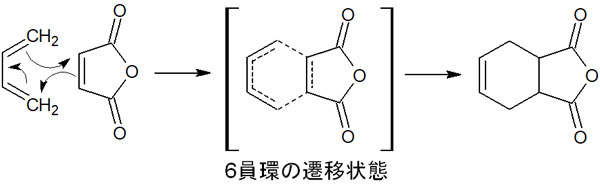
ディールス・アルダー反応が進行する理由の一つとして、遷移状態の電子の非局在化があります。遷移状態では、6員環の状態で電子の非局在化が起きています。電子が6員環のあらゆる場所に存在しているため、芳香環と同じように安定した状態となります。
なお、2つの化合物が付加することで環状化合物を得られるため、ディールス・アルダー反応を付加環化といいます。ペリ環状反応には主に3つの種類があります。その中の一つが付加環化です。
電子豊富な共役ジエンと電子吸引基のあるアルケン(ジエノフィル)で反応する
それでは、共役ジエンとアルケンを混ぜて加熱すれば、ディールス・アルダー反応が起こるのでしょうか。もちろん、必ずしもペリ環状反応が進行するとは限りません。
ディールス・アルダー反応が進行するとき、共役ジエンは電子抱負の状態が好ましいです。
また、アルケンは電子不足の状態が好ましいです。より詳しくいうと、求ジエン体(ジエノフィル)は電子吸引基が結合している必要があります。一般的なジエノフィルとしては、例えば以下の官能基をもつ分子や化合物があります。
- アルデヒド(ホルミル基)
- ケトン(カルボニル基)
- カルボン酸
- エステル
- ニトリル(シアノ基)
- 無水マレイン酸
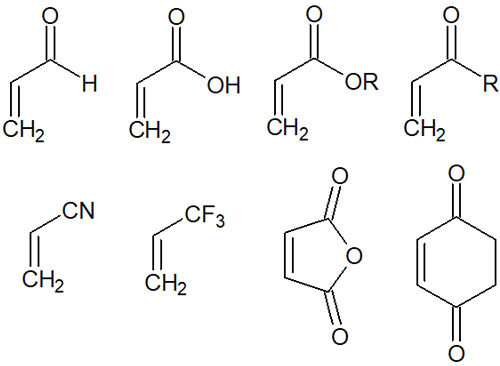
このように、アルケンに電子吸引基が結合している場合、ディールス・アルダー反応が起こりやすくなっています。
電子吸引基としてはカルボニル基やホルミル基のほかにも、ニトロ基などたくさんあります。これら電子吸引性のある置換基がある場合、ジエノフィルとして最適です。
付加環化はs-トランス体でなく、s-シス体で起こる
一方で共役ジエンとしては、シクロペンタジエンやフラン、シクロヘキサ-1,3-ジエンなどがあります。これらの共役ジエンとアルケンが反応することでディールス・アルダー反応が進みます。
ただ、共役ジエンにはs-シスとs-トランスの2種類があります。以下のようになります。
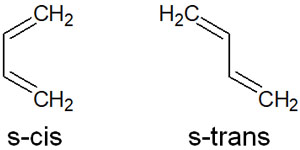
このうち、ディールス・アルダー反応に関与するのはs-シス体のみです。共役ジエンであったとしても、s-トランスの化合物はディールス・アルダー反応に関与できません。6員環の遷移状態になれないからです。
そのため単結合で二重結合がつながっている場合、必ずs-シスの形にならなければいけません。
また中には、s-シスやs-トランスの形が固定されている分子もあります。例えば、以下の化合物がこれに該当します。
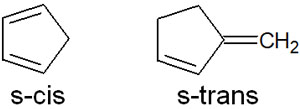
この場合、s-トランスの化合物はディールス・アルダー反応することはできません。共役ジエンがs-シスの形だからこそ、付加環化が起こります。
ディールス・アルダー反応の立体化学:立体選択性
なお有機化学の中では、ペリ環状反応は複雑な化学反応となります。なぜ、ペリ環状反応が複雑になりやすいのでしょうか。それは、立体化学を考慮する必要があるからです。
分子は平面ではなく立体です。そのため、立体選択性や合成後の化合物の立体配座がどうなっているのか理解しなければいけません。
重要なのは、ディールス・アルダー反応では立体が保持されたまま合成が進行する事実です。前述の通り、ディールス・アルダー反応では中間体が存在しません。6員環の遷移状態となった後、一度に電子が移動して付加環化します。これが、立体が維持されたまま合成が進行する理由です。
具体的には、以下の化合物を合成できます。
- ジエノフィルがシス体:生成物はシス体
- ジエノフィルがトランス体:生成物はトランス体
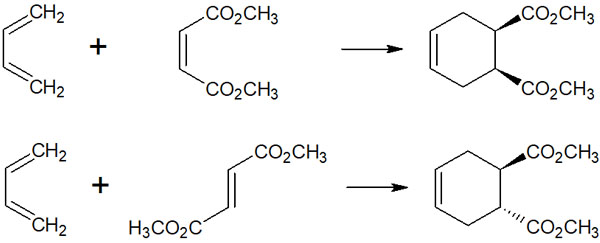
求ジエン体(ジエノフィル)がシス体なのであれば、シスの立体が保持されます。つまり、生成物はシス体です。一方で求ジエン体がトランス体なのであれば、生成物はトランス体です。
ディールス・アルダー反応が進行するとき、ジエノフィルの上側から、共役ジエンが攻撃します。例えば、以下はトランスのジエノフィルに共役ジエンが攻撃している様子です。
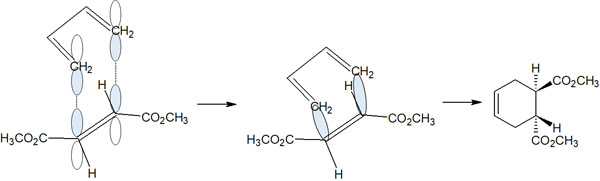
立体が保持されたまま反応が進行するため、反応後に得られる生成物では、エステルと水素原子は同じ位置に存在します。そのため、トランスのジエノフィルではトランス体の生成物を得られます。
共役ジエンの立体化学をアルキン(三重結合)で理解する
一方で、共役ジエンの立体化学はどのように考えればいいのでしょうか。共役ジエンの場合、以下の2種類の異性体が存在します。
- シス・シス
- シス・トランス
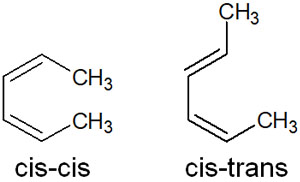
非対称の共役ジエンの場合、さらにトランス・シス、トランス・トランスの異性体も加わります。そのため、立体化学はより複雑になります。
共役ジエンの異性体を学ぶとき、ジエノフィルとしてアルキン(三重結合)を利用すると理解しやすいです。アルキンでは異性体が存在しないからです。例えばシクロペンタジエンとアルキンを反応させるとき、以下のような反応機構になります。
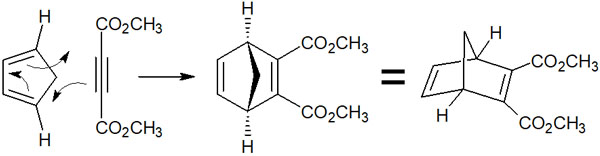
ジエンには、内側と外側に置換基が存在します。上図の場合、2つの置換基があります。一つはメチレン基であり、内側で炭素結合を作っています。もう一つは水素原子であり、ジエンの外側に位置しています。
この分子がアルキンとディールス・アルダー反応すると、分子の上側にメチレン基、分子の下側(外側)に水素原子が位置するようになります。
同じように考えると、シス・シスまたはシス・トランスの共役ジエンは以下のように反応します。
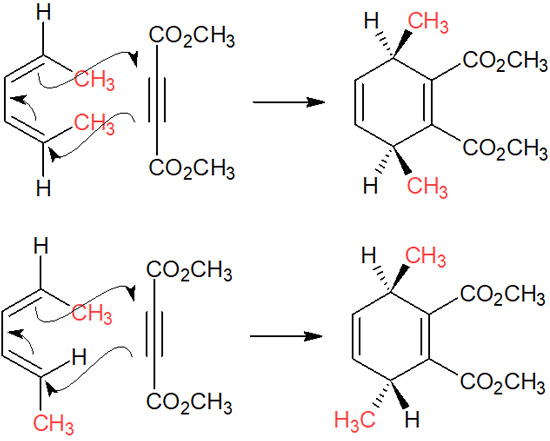
共役ジエンの置換基について、内側に位置する官能基は生成物の上側にきます。一方で外側にある官能基は生成物の下側にきます。
なお実際には、E,Zジエンの合成は非常に難しいため、シス・トランス(またはトランス・シス)の化合物は稀です。E,Zジエンを用いた報告例は少ないです。ただいずれにしても、このような立体選択性によってディールス・アルダー反応が進行します。
エンド付加とエキソ付加の異性体
それでは、共役ジエンと求ジエン体(ジエノフィル)の両方に異性体がある場合、どのような化合物を得られるのでしょうか。2つの化合物の立体化学を考慮する必要があるため、反応機構はより複雑になります。
例えばシクロペンタジエンとアルケン(二重結合)を反応させる場合、以下の2種類の化合物が生成される可能性があります。
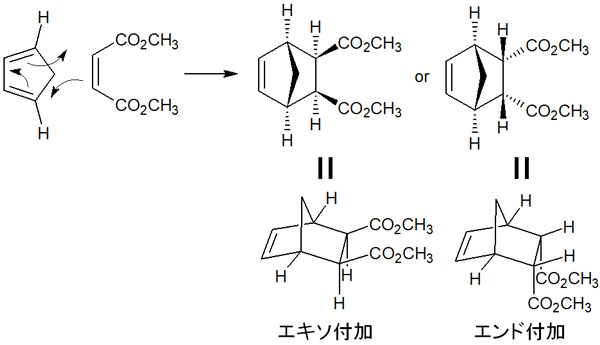
ディールス・アルダー反応によって新たに作られた結合に対して、ジエンとジエノフィルの置換基が反対側に位置する場合、エキソ異性体といいます。このときの付加反応がエキソ付加です。
それに対して、ジエンとジエノフィルの置換基が同じ側に位置する場合、エンド異性体といいます。このときの付加反応がエンド付加です。エキソ異性体とエンド異性体は以下のようになります。
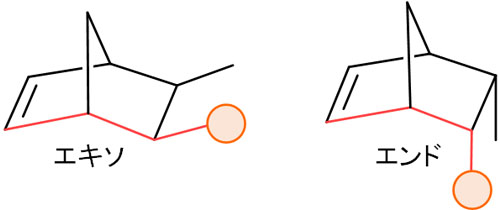
エキソ異性体とエンド異性体では、どちらが合成されるのでしょうか。ディールス・アルダー反応では、一般的にエンド異性体が合成されます。これをエンド則といいます。
エンド則が優先して起こる理由:二次軌道相互作用
なぜ、エンド則が優先されるのでしょうか。エキソ異性体とエンド異性体を比較したとき、エキソ異性体のほうが安定です。
エキソ異性体では、大きい置換基はエクアトリアルの位置にあります。一方でエンド異性体では、大きい置換基がアキシアルの位置にあります。環状化合物では、アキシアルの位置に置換基があると立体障害が大きくなることが知られています。これが、エキソ異性体のほうが安定な理由です。
エキソ異性体のほうが構造は安定にも関わらず、なぜエンド体が優先的に合成されるのでしょうか。エンド則になる理由として、二次軌道相互作用が関係しています。
ジエノフィルでは、電子吸引基が結合しています。電子吸引基としては、C=O(カルボニル基)やC≡N(シアノ基)などが知られており、二重結合や三重結合を有しています。このようにπ電子をもつ官能基がジエノフィルに存在する場合、エンド則になりやすいです。
ディールス・アルダー反応では、共役ジエンとジエノフィルのπ軌道が重なります。その後、電子が移動することでπ結合が消え、σ結合が作られます。エキソ付加するとき、共役ジエンと求ジエン体(ジエノフィル)は2ヵ所でπ軌道が重なります。
以下の図では、シクロペンタジエンと無水マレイン酸の軌道が2ヵ所でつながることで、エキソ付加しています。
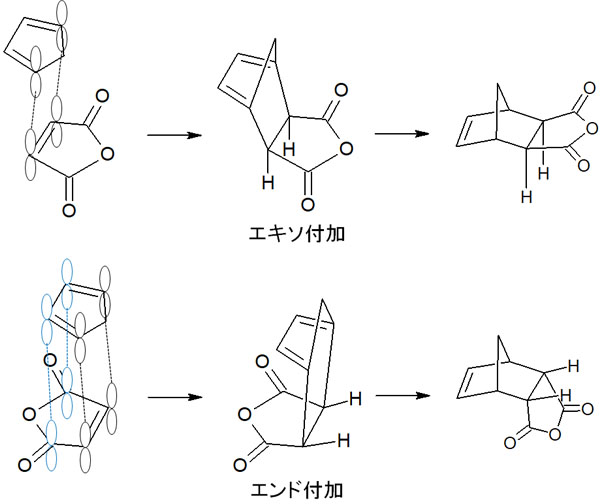
一方でエンド付加ではどうでしょうか。共役ジエンには二重結合が2つあるため、π軌道が4つあります。またジエノフィルにC=O結合などπ結合がある場合、エンド付加では、共役ジエンとジエノフィルは4ヵ所(または3ヵ所)で軌道が重なります。これを二次軌道相互作用といいます。
二次軌道相互作用による影響によって、エキソ付加よりもエンド付加のほうが優先的に起こります。エンド付加のほうが生成物の安定性は低いものの、より少ない活性化エネルギーで反応が起こるため、エンド異性体が生成されます。
生成物の構造が不安定であったとしても、活性化エネルギーが低く素早く反応するため、結果として化合物が合成されることを速度論的支配といいます。ディールス・アルダー反応のエンド則は速度論的支配であり、反応は不可逆なのでエンド異性体が合成されます。
熱力学的支配や立体障害、分子内反応でエキソ付加になる
それでは、すべてのディールス・アルダー反応でエンド則が適用されるかというと、そういうわけではありません。二次軌道相互作用による速度論的支配が多いだけであり、エキソ付加が優位になることもあります。
エキソ付加になる一つの理由として、反応が可逆反応のときがあげられます。不可逆反応の場合は先ほど説明した通り、速度論的支配によってエンド則になります。ただ可逆反応であれば、最初はエンド異性体が生成されるにしても、時間経過と共に構造がより安定なエキソ異性体に形を変えます。
安定な化合物が合成される場合、熱力学的支配といいます。先ほど、共役ジエンとしてシクロペンタジエンを用いて説明しました。そこでシクロペンタジエンではなく、フランを用いる場合、可逆反応によってエキソ異性体を得られます。
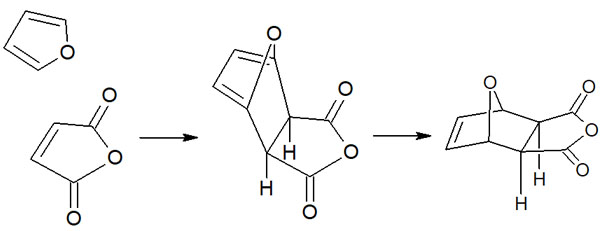
20℃以上で反応させるなど、温度が高い条件では逆ディールス・アルダー反応が起こります。その結果、エンド体からエキソ体へと徐々に配座が変わります。
または、立体障害の発生や分子内ディールス・アルダー反応のときもエキソ付加になることがあります。合成させる化合物の立体障害が大きい場合、エンド則に従わず、エキソ異性体が合成されます。
また分子内ディールス・アルダー反応では、アルキル鎖は自由に動き回れるわけではありません。動きに制限があるため、エキソ付加が優先されることはよくあります。エンド則になることは多いものの、エキソ異性体を得られることもあります。
立体でディールス・アルダー反応を考える
有機化学で最も難しい分野の一つがペリ環状反応です。内容が難しくなりやすい理由としては、立体化学を考える必要があるからです。また酸・塩基反応ではなく、軌道を考慮して反応の起こりやすさを考えなければいけません。分子の形が大きく変わるのも、複雑になりやすい理由です。
ペリ環状反応にはいくつか種類があり、代表的な反応がディールス・アルダー反応です。共役ジエンとジエノフィルが反応することで、6員環化合物を得られます。
- 共役ジエンがs-シスの形だと付加環化が起こる
- 立体が保持されて合成反応が進行する
- エンド則の化合物を得られることが多い
これらの特徴や理由、反応機構を学びましょう。分子を立体で捉えることで、ディールス・アルダー反応を理解できるようになります。