カルボン酸は有機化学で重要な化合物です。-COOHの構造を有する化合物がカルボン酸であり、例えば酢酸はカルボン酸の一種です。酢酸は料理にひんぱんに利用されており、私たちにとってカルボン酸は身近です。
またカルボン酸は飽和脂肪酸や不飽和脂肪酸にも関わります。有機化学でカルボン酸を学べば、脂肪酸の分類を理解することもできます。
なおカルボン酸で重要な化合物にはギ酸や酢酸、フマル酸、マレイン酸があります。これらの性質を学びましょう。
それでは、カルボン酸の製法や具体的な特徴には何があるのでしょうか。高校有機化学で学ぶカルボン酸の性質を解説していきます。
もくじ
カルボン酸(カルボキシ基)の性質
高校化学では有機化学の基礎を学び、その中で重要な化合物の一つがカルボン酸です。分子内にカルボキシ基-COOHをもつ化合物をカルボン酸といいます。
化合物がカルボキシ基をもつ場合、酸性を示します。また酸素が2つ結合していることからわかる通り、カルボキシ基には親水性があります。そのためカルボキシ基に結合している炭素鎖の数が少ない場合、カルボン酸は水に溶けます。
またほかの化合物に比べて、カルボン酸は沸点・融点が高いです。この理由として、カルボキシ基を利用して水素結合を作り、二量体を形成するからです。
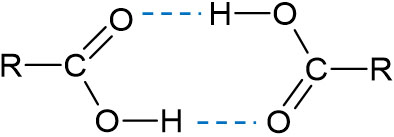
水素結合によって分子同士が互いに引き合う場合、沸点や融点は高くなります。
酸としてのカルボン酸の強さと弱酸の遊離
前述の通り、カルボン酸は酸性を示します。そのため塩基を加えると中和反応が起こります。例えば水酸化ナトリウムを加えると以下のような反応が起こります。
- R-COOH + NaOH → R-COONa + H2O
カルボン酸は弱酸であり、酸性の強さを表すと以下のようになります。
- HCl, H2SO4 > R-COOH > H2CO3
HClやH2SO4は強酸です。そのため当然ながら、カルボン酸よりも強い酸性です。一方でカルボン酸R-COOHと炭酸H2CO3を比べると、カルボン酸は炭酸よりも酸性が強いです。有機化学では、この性質を利用することがひんぱんにあるため、酸性の強さは必ず覚えるようにしましょう。
・炭酸水素ナトリウムと弱酸の遊離
高校化学で学ぶ内容に弱酸の遊離があります。弱酸を含む塩(えん)に対して、強酸を加えると、弱酸が遊離します。例えば酢酸ナトリウムに塩酸を加えると、酢酸(弱酸)が生成されます。
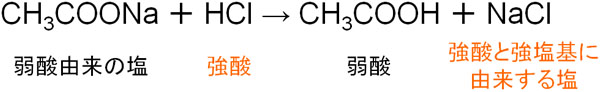
この理由として、強塩基由来のイオン(Na+)と強酸由来のイオン(Cl–)がイオン結合するからです。また、逆の反応は起こりません。そのため塩化ナトリウムNaClにカルボン酸を加えても反応は進行しません。
一方、炭酸水素ナトリウムNaHCO3にカルボン酸を加える場合、弱酸の遊離が起こります。先に解説した通り、カルボン酸は炭酸よりも強い酸性です。そのため炭酸水素ナトリウムにカルボン酸を加えると、強塩基由来のイオン(Na+)はカルボン酸とイオン結合を作ります。
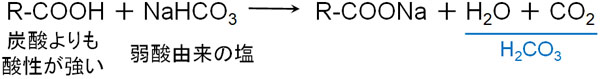
Na+はより酸性の強い化合物とイオン結合を作りたいと考えています。そのため炭酸ではなく、Na+はカルボン酸とイオン結合を作るのです。この性質を理解すれば、なぜ炭酸水素ナトリウムとカルボン酸が反応するのか理解できます。
アルコールの酸化によってカルボン酸を得られる
なおカルボン酸の合成では、アルコールの酸化反応を利用します。有機化学でアルコールを学ぶとき、酸化反応によって得られる化合物を覚えなければいけません。
アルコールを酸化するとき、得られる化合物は以下になります。

つまり、第一級アルコールを酸化することによってカルボン酸を得ることができます。
カルボン酸の分類:飽和脂肪酸と不飽和脂肪酸
次にカルボン酸を分類しましょう。ギ酸を含めて、鎖状の炭化水素に-COOHが一つ結合している場合、脂肪酸と呼ばれます。環状の炭化水素ではなく、脂肪酸は鎖状の炭化水素にカルボキシ基が一つ結合している必要があります。
このとき炭素数の少ない脂肪酸を低級脂肪酸といいます。ギ酸や酢酸は低級脂肪酸です。それに対して、炭素数の多い脂肪酸を高級脂肪酸といいます。有機化学で低級や高級というのは、分子内の炭素数が多いのか少ないのかを表します。
なお脂肪酸の分類に飽和脂肪酸と不飽和脂肪酸があります。それぞれの違いは以下になります。
- 飽和脂肪酸:炭化水素が単結合のみの脂肪酸
- 不飽和脂肪酸:炭化水素に二重結合を含む脂肪酸
炭化水素について、単結合のみの場合は飽和炭化水素です。また二重結合または三重結合を含む炭化水素は不飽和炭化水素です。飽和脂肪酸と不飽和脂肪酸の違いを覚えましょう。
ただ有機化学を学ぶとき、カルボン酸の分類は重要ではありません。そのため、知識として知っておく程度でいいです。
・脂肪酸の化学式
なお脂肪酸の一般式はCnH2n+1COOHです。この化学式を覚える必要はありません。酢酸CH3COOHの化学式を利用すれば、脂肪酸の一般式を導き出せます。n=1のとき、CH3COOHとなる一般式を作ればいいです。
また脂肪酸の構造式に二重結合を1つ含む場合、分子内の水素Hは2つ減ります。そのため、二重結合を一つもつ不飽和脂肪酸の一般式はCnH2n-1COOHです。また二重結合を2つ含む場合、分子内の水素Hは4つ減ります。そのため、二重結合を二つもつ不飽和脂肪酸の一般式はCnH2n-3COOHです。
脂肪酸の一般式を覚える必要はなく、作ることができます。そこで、どのように考えて脂肪酸の化学式を作ればいいのか理解しましょう。
カルボキシ基を含む重要な化合物
それでは、カルボキシ基を含む化合物としては何があるのでしょうか。高校化学でカルボン酸を学ぶとき、必ず以下の化合物の性質を理解しましょう。
- ギ酸
- 酢酸
- フマル酸、マレイン酸
それぞれの化合物の性質を確認していきます。
ギ酸は酸性と還元性の両方をもつ化合物
前述の通り、第一級アルコールを酸化することでカルボン酸を得ることができます。そのため、ギ酸を得るためにはメタノールを酸化すればいいとわかります。
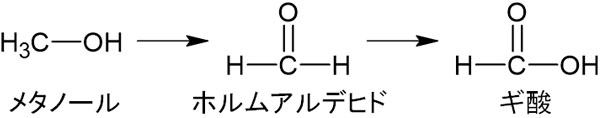
ギ酸の特徴は酸性と還元性の両方をもつことです。酸性と還元性をもつ化合物はギ酸だけです。ギ酸にはカルボキシ基があるため酸性を示します。また、ギ酸にはホルミル基もあります。
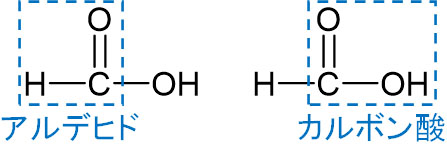
構造式の中にアルデヒドとカルボン酸があるため、ギ酸には酸性と還元性があるのです。
水に溶けて弱酸性を示す酢酸
カルボン酸の中でも、私たちにとって最も身近な化合物が酢酸です。食酢に含まれている成分が酢酸であり、私たちは酢酸を含む料理を食べたことが何度もあります。
酢酸の合成では、エタノールを酸化しましょう。エタノールは第一級アルコールであるため、酸化することによって酢酸になります。
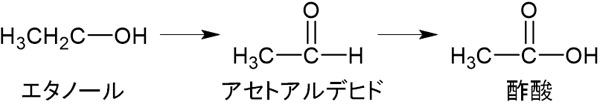
酢酸は水に溶けやすく、水溶液中で弱酸になります。弱酸であるため、ほとんどはイオンではなく、酢酸として水溶液中に存在します。このとき、酢酸は水溶液中で二量体にて存在しています。
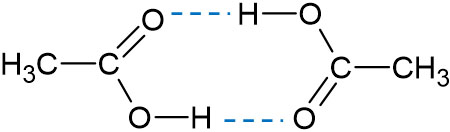
なお、純度の高い酢酸は温度を低くすると凍ります。そのため、純度の高い酢酸は氷酢酸と呼ばれます。
2つのカルボン酸が存在するフマル酸とマレイン酸
次にフマル酸とマレイン酸を確認しましょう。フマル酸とマレイン酸では、2つのカルボン酸が結合しています。
フマル酸とマレイン酸は幾何異性体の関係にあります。二重結合を介して、フマル酸がトランス型、マレイン酸がシス型となっています。
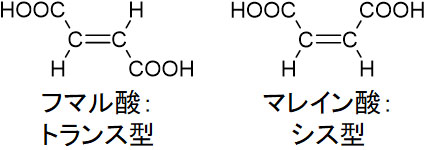
フマル酸とマレイン酸では、マレイン酸のみ加熱によって分子内脱水を起こします。マレイン酸はシス型であるため、2つのカルボキシ基が近くに存在します。そのため加熱によってH2Oがなくなり、無水マレイン酸になるのです。
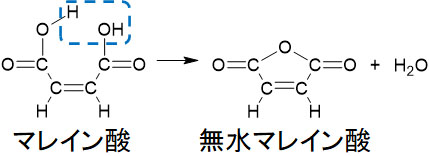
無水マレイン酸の存在を覚えれば、フマル酸とマレイン酸の構造も覚えることができます。トランス型のフマル酸では2つのカルボキシ基が離れており、脱水反応は起こりません。シス型のマレイン酸のみ、分子内脱水反応が起こります。
フマル酸とマレイン酸を区別するとき、脱水反応を起こすかどうかを確認しましょう。脱水反応を示す場合、元の化合物はマレイン酸です。また脱水反応を示さない場合、化合物はフマル酸です。
カルボン酸の性質と化合物を学ぶ
カルボン酸は有機化学で重要です。弱酸性を示す化合物として、私たちはひんぱんにカルボン酸を有する化合物を利用します。
高校有機化学を学ぶとき、カルボン酸に共通する性質を理解しましょう。カルボン酸は弱酸であるものの、炭酸より酸性は強いです。そのため炭酸水素ナトリウムとカルボン酸を加えると、弱酸の遊離が起こります。また、カルボン酸が一つ結合している化合物を脂肪酸といいます。
さらに、カルボキシ基を有する化合物の性質を覚えましょう。ギ酸、酢酸、フマル酸、マレイン酸はカルボン酸を有する重要な化合物です。
酸性を示すのがカルボン酸の特徴です。そこで、酸の強さやカルボキシ基を有する化合物の特徴を理解して有機化学の問題を解けるようにしましょう。






