化学を学ぶとき、必ず理解しなければいけないのが化学反応式です。化学では、分子が化学反応を起こすことによって新たな化合物が生成される過程を学習します。このとき利用するのが化学反応式です。
化学反応式を利用することによって、どのような分子が化学反応を起こし、どのような分子が生成されるのかわかります。このとき、原子の数を合わせるようにしましょう。
また化学反応式を作ることができれば、物質量(mol)を利用することによって化合物の量や質量、体積を計算できるようになります。
化学反応式を利用し、物質量を用いて計算できるようになるのは化学で必須です。そこで、化学で基本的な内容である化学反応式の作り方や計算方法を解説していきます。
もくじ
化学反応の過程を表すのが化学反応式
どのように化学反応が起こるのかについて、過程を表すのが化学反応式です。例えば水素と酸素が反応すると、爆発を起こして水(H2O)になります。一方で炭素と酸素が反応すると、二酸化炭素(CO2)が発生します。

石炭や石油を燃やすと二酸化炭素が発生するのは、これらの化合物は炭素を含んでいるからです。
一方で水素エネルギーはクリーンエネルギーといわれています。この理由として、化学反応した後に生成されるのは水のみであり、二酸化炭素が発生しないからです。このように化学反応の過程を確認すると、どのような物質が反応し、どのような化合物が生まれるのかわかります。
このとき、化学反応式では反応物(化学反応する前の物質)を必ず左側に記します。また、生成物(化学反応によって生まれる物質)を右側に記します。
反応物と生成物で原子の数が同じでないといけない
なお、化学反応式を作るときは必ず反応物と生成物で原子の数を合わせるようにしましょう。つまり、左辺と右辺で原子の数を合わせるのです。そこで、具体的な例を用いて確認していきましょう。
・水が生成する化学反応
水素分子(H2)と酸素分子(O2)が反応することで水分子(H2O)が生成されます。このときの化学反応式について、以下は間違いです。
- H2 + O2 → H2O
化学反応式を作るとき、前述の通り必ず左辺と右辺の原子の数が合っていなければいけません。上に記した化学反応式の場合、左辺では酸素原子の数が2つにも関わらず、右辺では酸素原子の数が1つです。そのため、間違っている化学反応式です。
そこで、左辺と右辺の原子の数を合わせましょう。そうすると、正しい化学反応式は以下のようになります。
- 2H2 + O2 → 2H2O
こうして、化学反応式を作ることができました。
化学反応式というのは、反応物と生成物の種類がわかればいいのではなく、どれだけの量の化合物が反応し、どれだけの量の生成物が生まれるのかも重要です。先ほどの化学反応式を見れば、水素分子2つに対して酸素分子1つが反応することで、水が生成されるとわかります。
多くの原子を保有する分子(反応物)に着目して化学反応式を作る
先ほど、水素と酸素の反応という非常に単純な化学反応を確認しました。それでは少し複雑なケースの場合、どのように化学反応式を作ればいいのでしょうか。化学反応式を作るとき、正しい手順があるのでやり方を理解しましょう。
例として、エタン(C2H6)と酸素分子(O2)が反応し、水と二酸化炭素が生成する化学反応式を作りましょう。
・係数のない化学反応式を作る
化学反応式を作るとき、最初に行わなければいけないのが「係数のない化学反応式を作る」ことです。そこで、最初は以下の化学反応式を作りましょう。
- C2H6 + O2 → CO2 + H2O
・分子の中でも、多くの原子をもつ反応物に着目する
ただ、この化学反応式では原子の数が合っていません。化学反応式を作るときの重要な考え方として、多くの原子を保有する反応物に着目することがあげられます。生成物ではなく、あくまでも反応物を確認しましょう。
エタンと酸素分子を比較すると、エタンで多くの原子をもちます。そこで、エタンを基準にしましょう。言い換えると、エタンに着目することで右辺にある生成物の係数を変え、つじつまを合わせるのです。
エタンは2つの炭素原子をもちます。そこで、二酸化炭素の係数を2にしましょう。そうすれば、右辺の炭素原子の合計数は2になります。また、エタンは6つの水素原子をもちます。そこで、水の係数を3にして水素原子の数を合わせましょう。
- C2H6 + O2 → 2CO2 + 3H2O
・係数を調節し、全体のつじつまを合わせる
こうして、炭素原子と水素原子の数を合わせることができました。ただ、酸素原子の数が合っていません。そこで、これまで着目していなかった酸素原子の数を合わせましょう。
右辺を確認すると、合計で7つの酸素原子が存在します。酸素分子は2つの酸素原子があるため、\(\displaystyle\frac{7}{2}\)倍することによって、左辺と右辺の酸素原子の数が合います。そのため、以下のようになります。
- C2H6 + \(\displaystyle\frac{7}{2}\)O2 → 2CO2 + 3H2O
ただ、化学反応式で分数を利用することはありません。必ず係数は自然数(正の整数)である必要があります。そこで左辺と右辺に対して同じ数をかけ、分数を消しましょう。今回は左辺と右辺に2をかけます。
- 2C2H6 + 7O2 → 4CO2 + 6H2O
こうして、化学反応式を作ることができました。係数を見つけるとき、複雑な分子(多くの原子をもつ反応物)に着目する方法であればミスを少なくできます。
物質量を利用する化学反応の量的関係
化学反応式を利用すれば、どれだけの量の試薬を用意すればいいのかわかります。化学実験だけでなく、物理実験や生物実験などあらゆる場面で試薬が利用されます。例えば病院では多くの検査試薬が利用され、さまざまな診断に役立っています。
それでは、いくらの量の試薬を用意すればいいのでしょうか。これを知るために化学反応式が役に立ちます。
化学反応式は物質量(mol)に対応しています。1molは6.0×1023個です。つまり、どのような原子や分子であっても、1molの数は同じです。そのため化学反応式を確認すれば、物質量での反応割合がわかります。
例として、エタンの化学反応式を確認しましょう。
- 2C2H6 + 7O2 → 4CO2 + 6H2O
この化学反応式より、2つのエタンと7つの酸素分子が反応し、4つの二酸化炭素と6つの水が生成するとわかります。これはつまり、2molのエタンと7molの酸素分子が反応し、4molの二酸化炭素と6molの水が生成することを意味します。
私たちが住んでいる現実世界において、2つのエタン分子と7つの酸素分子をぴったり用意するのは不可能です。分子は非常に小さいため、少数の分子を集めることは現実的にできません。
そこで、mgやgを利用して試薬の量を測ります。この場合であれば私たちであっても行うことができます。物質量を利用すれば、mgやgなどの単位を利用できます。そのため、試薬の量を計算するときは物質量を使うのです。
個数、質量、体積は必ず物質量を考慮する
化学反応式では、物質量の比率が必ず同じになります。エタンと酸素分子が化学反応を起こす場合、必ず以下の物質量の割合で反応が起こります。
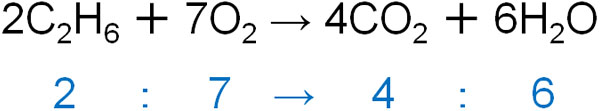
なお物質量がわかれば、反応物や生成物の分子数、質量、体積(気体の場合)がわかります。例えばエタンを2mol反応させる場合、以下のようになります。
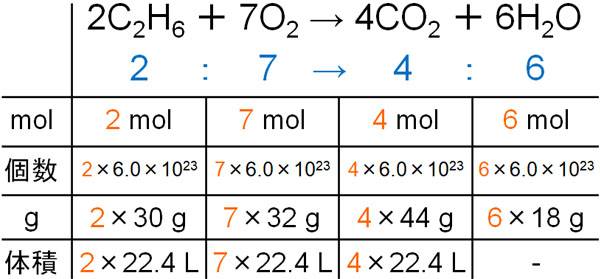
物質量を利用すれば、このように反応物と生成物の個数、分子量に応じた重さ、体積(気体の場合)を計算できます。化学反応式の割合に応じて反応物が化学反応を起こし、生成物が生まれるのです。
練習問題:化学反応式を利用して計算する
それでは、実際に練習問題を解いてみましょう。小学算数の比の計算をすることができる場合、化学反応式を利用しての計算が可能です。
例えば、メタンが空気中の酸素と反応して二酸化炭素と水ができるとき、以下の問題の答えは何でしょうか。
- 酸素分子が2.1×1023個反応するとき、生成する二酸化炭素の分子数はいくらでしょうか。ただし、アボガドロ数を6.0×1023とします。
- 水を216g生成させるためには、エタンは何g必要でしょうか。ただし原子量をH=1、C=12、O=16とします。
- 標準状態でメタンが11.2L反応したとき、反応する酸素分子の体積はいくらでしょうか。
これまで説明した通り、メタンと酸素分子の化学反応式は以下になります。
- 2C2H6 + 7O2 → 4CO2 + 6H2O
そこで、この割合を用いて問題を解きましょう。
1)
1molには6.0×1023個の分子が存在します。そのため酸素分子が2.1×1023個ある場合、0.35molの酸素分子があることになります。
\(\displaystyle\frac{2.1×10^{23}}{6.0×10^{23}}=0.35\)
また化学反応式より、酸素分子と二酸化炭素の割合は7:4です。そのため0.35molの酸素分子が反応する場合、0.2molの二酸化炭素が生成されます。
\(7:4=0.35:x\)
\(7x=4×0.35\)
\(x=0.2\)
二酸化炭素が0.2mol生成するため、二酸化炭素の個数は1.2×1023個です。
\(0.2×6.0×10^{23}=1.2×10^{23}\)
b)
216gの水(H2O)は\(\displaystyle\frac{216}{18}=12\)molです。エタンと水は2:6の割合で反応します。そのため、12molの水を生成させるために必要なエタンの物質量は4molです。
\(2:6=x:12\)
\(6x=2×12\)
\(x=4\)
エタン(C2H6)の分子量は30なので、反応に必要なエタンの重さは120gです。
\(4×30=120\)
c)
標準状態(0℃、1.0×105Pa)で1molは22.4Lです。そのため標準状態でメタンが11.2L反応するとき、\(\displaystyle\frac{11.2}{22.4}=\)0.5molが存在します。
メタンと酸素分子は2:7の割合で反応します。そのため、0.5molのメタンを反応させるには1.75molの酸素分子が必要になります。
\(2:7=0.5:x\)
\(2x=7×0.5\)
\(x=1.75\)
前述の通り1molは標準状態で22.4Lであるため、反応する酸素分子の体積は39.2Lです。
\(1.75×22.4=39.2\)
化学反応式の作り方を学び、反応物と生成物の計算を行う
化学を学ぶとき、化学反応式を作れることは必須です。化学で最も基本的な内容の一つが化学反応式です。
化学反応式を作るとき、「最も複雑と思われる構造式をもつ分子」に着目しましょう。原子の多い反応物を基準にして、化学反応式の左辺と右辺の原子の数を合わせるのです。その後、すべての分子についてつじつまを合わせれば化学反応式を作れます。
また化学反応式を利用することによって、反応物と生成物の計算が可能になります。化学反応式の割合に応じて物質量が変化します。化学反応式を用いて、反応物や生成物の個数や重さ、体積を計算できるのです。
実際に科学実験をするとき、試薬の量の計算をする場面は非常に多いです。そこで化学反応式を作れるようになり、化合物の量を計算できるようになりましょう。






