無機化学で16元素を学ぶとき、酸素Oと硫黄Sの性質を理解しましょう。16元素には酸素O、硫黄S、セレンSe、テルルTeなどがあります。ただセレンやテルルは重要ではないため、無機化学では酸素と硫黄のみ学べば問題ありません。
酸素がなければ私たちは生きていくことができません。また酸素は地表や大気圏で地球上に最も存在する元素です。
それに対して、硫黄を含む化合物は有毒であることが多いです。ただ硫黄を含む化合物は利用用途が多く、重要な元素となっています。
それでは、酸素と硫黄の性質はどのようになっているのでしょうか。無機化学で重要な酸素と硫黄の性質や化合物の特徴を解説していきます。
もくじ
酸素の性質と実験的製法
無機化学を学ぶとき、元素周期表のどこに位置しているのかを知ることは重要です。酸素と硫黄は16族元素と呼ばれており、以下の位置に酸素と硫黄があります。

最も重要な元素の一つが酸素です。既に知っている通り、空気を構成する分子の一つが酸素です。空気は以下の割合になっています。
- 窒素(N2):約78%
- 酸素(O2):約21%
- アルゴン(Ar):0.93%
なお酸素は空気中だけでなく、地表にも多く存在しています。例えば、岩石の主成分は二酸化ケイ素(SiO2)であり、酸素原子を含んでいます。また、水(H2O)も酸素原子を含んでいます。
このとき、地表付近や大気圏内にどれだけ元素が存在するのかを質量比で表す指標にクラーク数があります。酸素はクラーク数が最も大きいです。つまり、質量比で酸素は地球上に最も多く存在する元素です。
酸素の実験的製法としては、過酸化水素(H2O2)に触媒として酸化マンガン(Ⅳ)(MnO2)を加えることによって作ることができます。
- 2H2O2 → 2H2O + O2
過酸化水素は酸化還元反応を起こす物質として知られています。このとき過酸化水素に触媒を加えることにより、分解反応が進んで酸素を発生させるのです。
参考までに、工業的に酸素を大量生産する場合、空気を冷やして液体空気(液体窒素と液体酸素の混合物)を作った後、分留によって酸素を取り出します。
オゾンは酸素の同素体で毒性が強い
無機化学で酸素を学ぶとき、必ず一緒に学ぶのがオゾンです。同じ元素で構成されているものの、性質が異なる物質を同素体といいます。酸素は酸素原子2つ、オゾンは酸素原子3つで構成されています。
- 酸素:O2
- オゾン:O3
酸素に対して紫外線を当てたり、無声放電(ガラス管の中で電圧をかけることで生じる、火花や音を伴わない静かな放電)をしたりすることによって、O2はO3になります。
- 3O2 → 2O3
O2は無色・無臭です。一方でオゾンは特異臭があり、淡青色の気体です。
地球上では、大気圏にオゾンがたくさん存在します。具体的には成層圏(約10~50kmの上空)に約90%のオゾンが存在しており、これをオゾン層といいます。上空では太陽による紫外線の影響を受けやすく、成層圏で効率的にオゾンが発生するのです。
またオゾン層があるからこそ、オゾンが紫外線を吸収してくれるため、私たちは紫外線による害を最小限に抑えることができているのです。
なおオゾンは不安定な物質であり、酸化力が強いです。O2は酸化力をもつ分子で知られています。ただO2はオゾンのように反応性が強いわけではありません。一方でオゾンは酸化力が強く、Cl2と同じように漂白・殺菌作用があります。
またオゾンは酸化力が強いことから、湿ったヨウ化カリウムデンプン紙にオゾンを当てると青色になります。
- 2KI + H2O + O3 → 2KOH + I2 + O2
ヨウ素は黒紫色の固体です。そのためオゾンによってヨウ素が析出した結果、ヨウ化カリウムデンプン紙は青色になるのです。
硫黄の性質:同素体と硫化物
一方、硫黄Sにはどのような特徴があるのでしょうか。酸素Oと同じように、硫黄Sにも同素体があります。単体の硫黄には以下の3種類があります。
- 斜方硫黄:正八面体の安定した黄色の結晶であり、S8で表されます。
- 単斜硫黄:黄色い針状の結晶であり、S8で表されます。
- ゴム状硫黄:褐色のゴム状固体であり、Sxで表されます。
化学を学ぶとき、同素体は多くの人が習います。同素体は化学の基本であり、単体の硫黄には3つの種類があることを理解しましょう。
なお無機化学で硫黄を学ぶ場合、単体の硫黄の性質よりも、硫黄を含む化合物の性質を学ぶほうが重要です。分子の中に硫黄を含む化合物を硫化物といいます。硫化物には硫化水素(H2S)や二酸化硫黄(SO2)、硫酸(H2SO4)などがあります。
硫黄を含む化合物は人体にとって有毒であるケースが多いです。事実、硫化水素や二酸化硫黄、硫酸は私たちの体にとって毒です。
また高温にすると、硫黄Sは多くの物質と反応します(金、プラチナを除く)。例えば鉄Feと硫黄Sが反応すると、硫化鉄が生成されます。
- Fe + S → FeS
硫黄は多くの物質と反応する性質があります。それでは、次に硫化物の特徴を確認していきましょう。
硫化水素(H2S):極力な還元剤
腐乱臭をもつ無色の気体が硫化水素です。温泉が湧き出る地域へ行くと、卵が腐った臭いを体験することになります。この理由は、火山ガスに硫化水素が含まれているからです。

なお硫化水素が水に溶けると、一部が電離することで弱酸性を示します。以下のように電離します。
- H2S ⇆ HS– + H+
- HS– ⇆ S2- + H+
硫化水素は弱酸であるため、2段階で電離する性質があります。
なお硫化水素の実験的製法については、硫化鉄(Ⅱ)に希硫酸(または希塩酸)を加えることによって硫化水素が発生します。
前述の通り、H2Sは弱酸です。そのため弱酸由来のSと結合するよりも、Feは強酸由来のSO4と結合したいと考えます。そのため希硫酸(または希塩酸)を加えると、弱酸であるH2Sが遊離します。
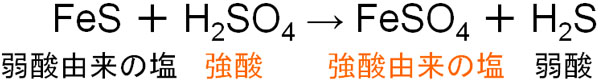
中和反応を学ぶとき、「弱酸を含む塩と強酸を混ぜると、強酸を含む塩と弱酸が生成する」と学んでいるはずです。この反応を利用して、硫化水素を発生させるのです。
・硫化水素は還元剤として働く
硫化水素で重要な性質は、強力な還元剤であることです。硫化水素は電子を放出することで、Sへ戻る性質があります。
- H2S → S + 2H+ + 2e–
還元作用があるため、金属イオンを含む溶液に硫化水素を通じると、金属は硫化物となって沈殿します。
なお注意点として、溶液の性質(酸性または中性・塩基性)によって沈殿を生じるかどうかが異なります。硫化水素を通じるとき、沈殿を生じるかどうかは金属の種類によって以下の違いがあります。
| 必ず沈殿を生じる | SnS, PbS, CuS, HgS, Ag2S, CdS |
| 中性・塩基性で沈殿を生じる | ZnS, FeS, NiS, MnS |
| 沈殿しない | K+, Ca2+, Na+, Mg2+, Al3+, Ba2+ |
このような違いを生じる理由にイオン化傾向があります。以下がイオン化傾向になります。
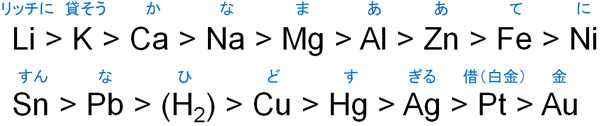
例えばカリウム(K)やカルシウム(Ca)はイオン化傾向が強く、これらの金属は水溶液中では可能な限りイオンで存在したいと考えています。そのため硫化水素を通じても硫化物は生成されません。
一方で銅や銀はイオン化傾向が弱く、水溶液中に存在したくないと考えています。そのため、硫化水素を通じると硫化物となります。イオン化傾向で覚えなければいけない金属以外についても表に記しています。ただ、沈殿するかどうかはイオン化傾向を確認することで大まかに把握できます。
この性質を利用すれば、金属イオンの分離が可能です。特定のイオンを硫化物にすることによって、金属イオンを分けることができるのです。

なお多くの場合、硫化物は黒色です。ただ、一部の硫化物は黒色ではないケースがあります。以下の硫化物は黒色ではありません。
- ZnS:白色
- CdS:黄色
- MnS:淡赤色
- SnS:褐色
色については覚えるしかありません。ただ溶液の性質(酸性・中性・塩基性)での沈殿については、イオン化傾向に着目すればいいことを理解しましょう。
二酸化硫黄(SO2)は有毒な気体
硫化水素と同様に有毒なガスとして二酸化硫黄(SO2)が知られています。無色・刺激臭のある気体であり、還元性があります。以下のように、二酸化硫黄が反応すると硫黄の酸化数は+4から+6になります。
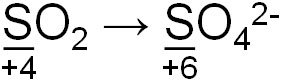
相手に電子を与えることにより、還元剤として機能するのです。そのため、二酸化硫黄は漂白剤として利用されます。
なお二酸化硫黄は還元剤であるものの、硫化水素と反応するときは酸化剤となります。硫化水素のほうが還元剤としての働きが強いため、二酸化硫黄は還元されて硫黄Sになるのです。
- SO2 + 2H2S → 2H2O + 3S
それでは、二酸化硫黄を作るにはどうすればいいのでしょうか。二酸化硫黄の実験的製法としては、銅に濃硫酸を加えて加熱します。
- Cu + 2H2SO4 → CuSO4 + 2H2O + SO2
銅には、熱濃硫酸など酸化性のある酸に溶ける性質があります。また銅は水素よりもイオン化傾向が弱いため、銅イオンが生成されるときにH2は発生しません。この性質を利用して二酸化硫黄を作るのです。
硫酸の工業的製法(接触法)と濃硫酸・希硫酸の性質
次に、硫黄を含む化合物として硫酸を学びましょう。硫酸は強酸で知られており、多くの場面で利用されます。
硫酸の工業的製法では、先ほど解説した二酸化硫黄を利用します。酸化バナジウム(Ⅴ)(V2O5)を触媒として、二酸化硫黄(SO2)と酸素(O2)を反応させることで三酸化硫黄(SO3)にします。
- 2SO2 + O2 → 2SO3
その後、H2Oと反応させることによって硫酸を得ます。
- SO3 + H2O → H2SO4
なお三酸化硫黄と水を直接反応させると、激しい発熱を生じるので危険性が高いです。そのため実際には、濃硫酸に三酸化硫黄を吸収させます。濃硫酸に過剰の三酸化硫黄を吸収させた液体を発煙硫酸といいます。
その後、希硫酸を発煙硫酸に加えます。希硫酸には大量のH2Oが含まれているため、発煙硫酸に存在する三酸化硫黄(SO3)と反応することによって、硫酸が生成されるのです。このような方法(二酸化硫黄→三酸化硫黄→硫酸)によって硫酸を作る工業的製法を接触法といいます。
濃硫酸の特徴:脱水性、吸湿性、不揮発性、酸化作用
なお硫酸には濃硫酸と希硫酸があります。どちらも主成分は硫酸であるものの、特徴が異なるため、明確に分けて性質を理解しなければいけません。
・脱水性と吸湿性
濃度が90%以上の場合、濃硫酸と呼ばれます。濃硫酸は粘性が高く、密度が大きいです。また水を吸収する働きがあり、脱水性や吸湿性があります。例えば糖(グルコース)に濃硫酸を加えると黒く焦げます。糖が焦げる理由は、グルコースからH2Oがなくなって炭素が残るからです。
- C6H12O6 → 6C + 6H2O
また濃硫酸には吸湿性があるため、乾燥剤としても有効です。ただ硫酸は酸であるため、アンモニアなど塩基性物質の乾燥には不向きです。
・不揮発性
無機化学で学ぶ酸の多くは揮発性です。つまり、蒸発します。揮発性の酸としてはHClやHNO3、HFが有名です。一方、硫酸は不揮発性物質であるため蒸発しません。
・過熱によって酸化作用を示す
硫酸は酸としての働きに着目しがちですが、酸化剤としての役割もあります。加熱することによって濃硫酸は酸化作用を示すようになるのです。
先ほど、二酸化硫黄の製法を解説しました。銅に濃硫酸を加え、加熱することによって二酸化硫黄が発生します。
- Cu + 2H2SO4 → CuSO4 + 2H2O + SO2
熱濃硫酸は酸化剤として機能するため、銅をイオンにすることができるのです。また前述の通り、銅は水素よりもイオン化傾向が弱いため、水素は発生しません。その代わり、二酸化硫黄が発生します。
通常、水素よりもイオン化傾向が弱い場合、金属は酸に溶けません。ただ熱濃硫酸のように酸化力のある酸を利用する場合、金属が溶けることによってイオンになります。
希硫酸の特徴:代表的な強酸
硫酸は強酸として知られています。ただ濃硫酸の場合、水がほとんど存在していないため、濃硫酸ではH+がほとんどありません。そのため、強酸の水溶液とは異なる性質を示します。
一方で水を多く含む希硫酸の場合、硫酸はイオンで存在しています。希硫酸には大量のH2Oがあるため、濃硫酸のような脱水性や吸湿性はありません。また、酸化作用もありません。その代わり、イオンとして存在しているため強い酸性を示します。
酸化力はないものの、強酸であるため、水素よりもイオン化傾向が強い金属を希硫酸に加えると、金属はイオンになり、H2が発生します。
- Zn + H2SO4 → ZnSO4 + H2
なお、強酸を示す化合物としてはHCl、H2SO4、HNO3が有名です。
・希硫酸を作るときの注意点
水と濃硫酸を混ぜることによって希硫酸を作ります。ただ、希硫酸を作るときは注意点があります。それは、水に濃硫酸を入れることです。濃硫酸に水を入れることで希硫酸を作ってはいけません。

なぜ、水に濃硫酸を入れる必要があるのでしょうか。前述の通り、濃硫酸は粘性が高く、密度が濃いです。そのため濃硫酸に水を入れる場合、水は濃硫酸の表面に浮きます。
また水が濃硫酸に溶けるとき、溶解熱を発します。発熱によって水が沸騰し、急激な沸騰による勢いによって濃硫酸が飛び散る危険性があります。
一方、水に濃硫酸を入れる場合、濃硫酸は水よりも比重が重いため、濃硫酸を加えると水の底へ沈んでいきます。溶解熱は発するものの、液体の表面で突沸することはありません。ただ大量の濃硫酸を一度に加えると突沸するリスクがあるため、濃硫酸を少しずつ加える必要があります。
酸素と硫黄の性質を学ぶ
無機化学で16族元素を学ぶとき、特に重要なのが酸素と硫黄です。酸素は生きていくうえで不可欠な元素ですし、硫黄を含む化合物はたくさんあります。
酸素については、O2とO3の性質を覚えましょう。O2とO3は同素体であり、酸化力や毒性に違いがあります。
一方、硫黄では化合物が重要です。硫化水素(H2S)、二酸化硫黄(SO2)、硫酸(H2SO4)は利用場面が多く、性質や製法を覚える必要があります。これらの化合物の反応には酸化還元反応やイオン化傾向が関わるため、それぞれの関係性を理解しましょう。
無機化学では、性質を暗記しても意味がありません。なぜ、そのような反応が起こるのか理解することで酸素と硫黄の性質を学んでいきましょう。