物質を分離する実験操作がクロマトグラフィーです。クロマトグラフィーの中でも、最も多く行われる実験操作の一つがHPLC(高速液体クロマトグラフィー)です。
物理化学や有機化学、生化学など、ほぼすべての実験室で高速液体クロマトグラフィーが利用されます。研究室によって行われる実験内容はバラバラですが、どの実験であっても利用する可能性の高い分析手法がHPLCです。
それでは、HPLCの測定原理はどのようになっているのでしょうか。高速液体クロマトグラフィーでは固定相や移動相、検出器について理解する必要があります。その後、化合物を分離したり、含まれている化合物の濃度を測定したりすることができます。
クロマトグラフィーで最も利用されるのがHPLCです。「HPLCを活用して、どのように化合物を測定するのか」についての原理や概念を解説していきます。
もくじ
物質を分離するのがクロマトグラフィー
複数の物質が溶液中に混じっていることはよくあります。単一の化合物だけ存在すればいいですが、そうではないことが多いのです。
いくつもの化合物が存在する状況では、科学実験をしたとしても正しいデータを得られることはありません。そこで、物質を分離しなければいけません。科学実験の中でも、複数の物質を分離する技術がクロマトグラフィーです。
HPLCは液体クロマトグラフィーと呼ばれています。クロマトグラフィーには、主にガスクロマトグラフィーと液体クロマトグラフィーがあります。HPLCでは溶媒として液体を利用し、物質を分離させます。
液体クロマトグラフィーにはいくつか種類があり、最も簡単な操作技術に薄層クロマトグラフィー(TLC)があります。TLCという薄い板に化合物をスポットし、溶液の上昇に伴って化合物を分ける技術です。
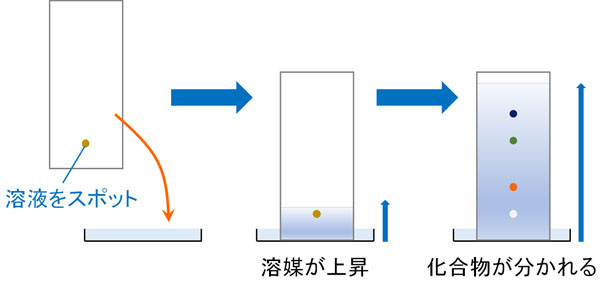
同じように、HPLCでも液体の移動によって物質を分けます。
圧力ポンプにて高速で物質を移動させ、時間短縮する
これら液体クロマトグラフィーの中でも、HPLCでは圧力ポンプを利用します。自然の力によって液体が移動するのを気長に待ってもいいですが、それでは非常に多くの時間がかかります。そこで圧力ポンプを使って素早く液体を移動させ、時間短縮を図ります。
圧力ポンプを利用して時間短縮することから、高速液体クロマトグラフィーと呼ばれています。以下がHPLCの機器です。

一定の圧力をかけることで物質を分離するだけでなく、物質の検出をしてくれるのが高速液体クロマトグラフィーです。そのため、こうした機器を利用して物質を分けます。
固定相のカラムは逆相クロマトグラフィーが一般的
それでは、HPLCの原理はどのようになっているのでしょうか。原理を理解するからこそ、どのようにすれば効率的に物質を分けることができるのかを理解できるようになります。
このとき、HPLCでは固定相を必ず用意しなければいけません。カラムという、小さい筒が固定相です。カラムの中を溶液が通過することで、物質が分かれるようになります。化合物によってカラムの中を移動する速度が異なるからです。
なぜ、固定相(カラム)の移動速度が物質によって異なるのでしょうか。これは、固定相の極性に特徴があるからです。
固定相には順相クロマトグラフィーと逆相クロマトグラフィーの2種類があります。それぞれ、以下のようになっています。
- 順相クロマトグラフィー:固定相に極性の高い物質を使う
- 逆相クロマトグラフィー:固定相に疎水性の高い物質を使う
HPLCでどのカラムを利用するのかによって、分けられる物質が異なります。ただ一般的には、高速液体クロマトグラフィーでは逆相クロマトグラフィーを利用します。
ODSカラムによる逆相クロマトグラフィー
順相クロマトグラフィーではシリカゲルを固定相として利用します。シリカゲルは以下のような構造をしており、非常に極性が高くなっています。
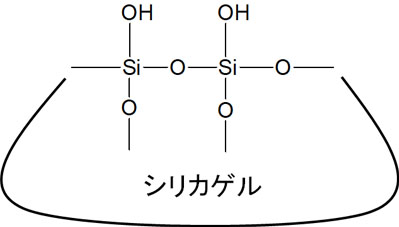
このシリカゲルのヒドロキシ基(-OH)について、オクタデシルシリル基(ODS:C18H37Si)を結合させます。ODS(オクタデシルシリル基)が結合するため、このカラムをODSカラムといいます。
構造式から分かる通り、オクタデシルシリル基は疎水性が高いです。そのためODSカラムは脂溶性の高い化合物と親和性が強いです。これらODSカラムを含め、疎水性の高い固定相を利用するクロマトグラフィーが逆相クロマトグラフィーです。
・極性の高い化合物は素早く流れる
水と油は混じりあいません。これは、性質がまったく異なるからです。この性質の違いをクロマトグラフィーで利用します。
ODSカラムを利用する場合、疎水性の高い化合物であるほど固定相と相互作用します。疎水性の高い物質は互いに引き合うため、疎水性が高い物質(極性の低い物質)であるほどODSカラムに吸着されます。
一方で、極性が高く水に溶けやすい化合物は固定相に吸着されにくいです。固定相とは相互作用せず、カラムの中を素早く通過します。溶媒を流すことで、早い段階でカラムの先から化合物が出てくるようになります。
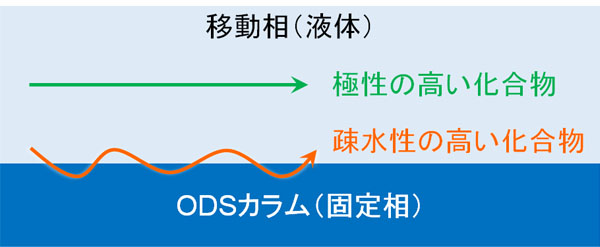
化合物の脂溶性がどうなのかによって、ODSカラムの中を進むスピードが異なります。それら極性の高さや脂溶性の高さに着目するのが逆相クロマトグラフィーです。
・タンパク質など、分子量の大きい物質は分離が難しい
参考までに、クロマトグラフィーは分子量が比較的小さい化合物を分けるときに利用されます。タンパク質のように、分子量が大きい物質を分けるのは難しいです。
一般的なODSカラムにタンパク質を流したとしても、目詰まりするだけです。タンパク質が検出されることはありません。そのためタンパク質をHPLCで測定したい場合、特殊なカラムを利用する必要があります。
アセトニトリルやメタノール、水の移動相の溶媒で保持時間を変える
逆相クロマトグラフィーの固定相はODSカラムでほぼ決まります。一方、移動相の溶媒はあなたが自由に決めることができます。逆相クロマトグラフィーの移動相では、アセトニトリルまたはメタノールが最も頻繁に用いられます。
これらの溶媒に水を加えることで、移動相を作ります。
- アセトニトリル / 水
- メタノール / 水
水に対して、アセトニトリルまたはメタノールを混ぜます。水と有機溶媒の割合は実験の内容によって異なります。
水の割合が高ければ、有機物質は移動相に溶けにくいです。その結果、カラムの中を移動するスピードは遅くなります。一方でアセトニトリルやメタノールの濃度を高くすれば、ODSカラムに吸着されている化合物が溶媒に溶けやすくなり、前に進みやすくなります。
物質が検出されるまでの時間を保持時間といいます。どのような移動相を作成するのかによって、HPLCでターゲット化合物が観察されるまでの保持時間が大きく異なると理解しましょう。
・保持時間が長いと分離能力が高くなる
実際に移動相を作成し、HPLCをしてみなければ保持時間は分かりません。このとき移動速度が速く、保持時間が短いと分離能力が低くなります。複数の化合物が溶液にある場合、検出される化合物のピークが重なるのです。
その場合、有機溶媒(アセトニトリルやメタノール)の割合を低くして保持時間を長くしましょう。多くの実験に時間はかかりますが、化合物は分かれやすくなります。
例えば100m走で何も障害物がない場合、タイム差は小さいです。一方で100mの間に池や迷路があり、障害がいくつもある場合、タイム差は大きいです。これと同じように、障害物が多い(保持時間が長い)ほど分離能力は高くなります。
または、利用する有機溶媒を変えてもいいです。アセトニトリルからメタノールに変更することで、分離能力が高くなるケースがあります。
検出器で化合物を測定する:吸光光度検出器での検出
他にHPLCの特徴として、検出器を用いることがあります。水と有機溶媒を混ぜて移動相を作り、溶媒を流すのですが、溶媒が出てくる最後の部分に検出器があります。
どのような化合物を測定したいのかによって利用する検出器は異なります。ただ一般的には、吸光光度検出器を利用します。紫外線や可視光を吸収する化合物を検出するのが吸光光度検出器です。190~900nmの光を吸収する化合物を検出できます。
構造式に共役構造をもつ場合、紫外線を吸収します。共役構造で有名なのはベンゼン環です。多くの有機化合物はベンゼン環をもつため、これらの物質がHPLCの検出器を通った場合、紫外線が吸収されることでスペクトルのピークが観察されます。
例えば、以下のようにピークが表れます。
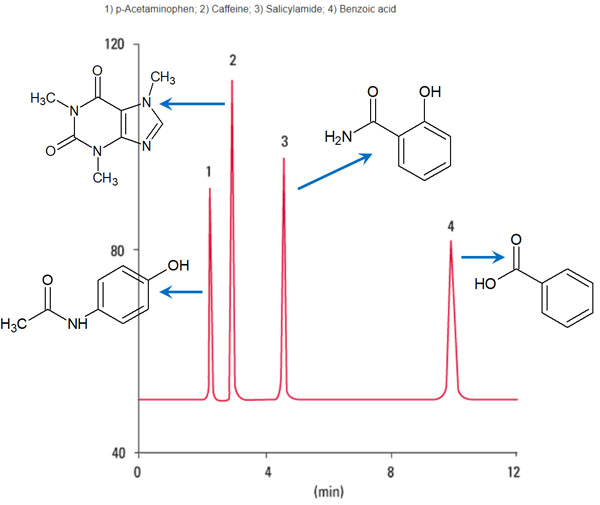
ポンプ圧力や温度、移動相の溶媒によって保持時間は異なりますが、紫外線が吸収されることで、このようにピークが観測されます。
また上図にある化合物の構造式を見れば、極性の高い化合物ほど保持時間が短く、素早くピークが観察されることが分かります。一方、脂溶性の高い化合物ほど保持時間が長くなり、ODSカラムを進むスピードは遅くなります。
なお化合物のピークが観察されたとき、出てくる溶媒を集めれば目的の化合物だけを分離できます。
・固定相は使い捨てではなく、カラム洗浄が必要
なお固定相は使い捨てではないため、実験が終わった後はカラム洗浄が必要です。ターゲット化合物のピークが検出された後、すぐにHPLCをストップさせると、カラムの中にその他の不純物が残留したままとなります。
汚染を防ぐため、例えば「メタノール:水=50:50」の移動相を20分流すなど、カラムの中を空にします。こうして有機物や酸を除去してキレイな状態にします。
なお、タンパク質によって目詰まりを起こしているなど、カラム内が汚染されている場合は新品のカラムを利用するほうがいいです。
HPLCで分離後、含まれる量が検量線から分かる
ここまで説明したことがHPLCの原理です。こうした性質があるため、含まれている物質を分けることができます。
移動相の溶媒や温度など条件が同じ場合、保持時間は同一です。そこで事前に基準物質のHPLCを流すことで、どれだけの保持時間になるのか確認しておきます。その後、複数の物質が混じっている溶液を流します。このとき基準物質と同じ保持時間にピークが検出された化合物は、基準物質と同じ物質であると分かります。
場合によっては既知化合物ではなく、未知化合物を測定することもあります。その場合、ピークが検出されたとしても、どのピークがターゲット化合物かどうか分かりません。そのためピークごとに化合物を集め、さらに詳しい分析をしていく必要があります。
ただ既知化合物を調べる場合であれば、保持時間を比較するだけでターゲット化合物のピークを予測でき、分離できるようになります。
また溶液中に多くの量の化合物が含まれているほど、ピークは大きくなります。もっと正確にいうと、面積値(積分値)が大きくなります。
基準物質を利用して事前に濃度を変えた溶液を流し、どれだけの積分値が検出されるのかを確認し、検量線を引いておきます。こうした検量線を利用することで、観察されたターゲット化合物のピーク面積から、含まれる化合物の量を測定できます。
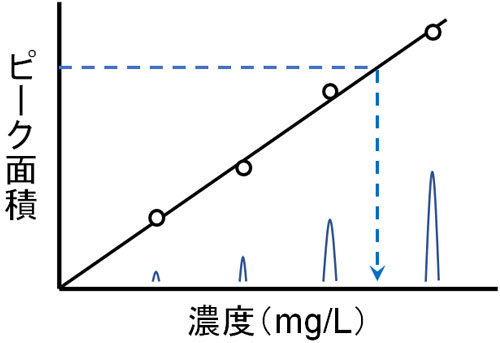
つまりHPLCでは、以下のことが可能です。
- 定性:保持時間の比較から、ターゲット化合物が含まれているか確認する
- 定量:面積値(積分値)から、化合物の量を測定する
これらの分析が可能であり、化合物の分離能力が優れているため、科学実験でのクロマトグラフィーではHPLCが最も頻繁に利用されています。
純度の測定や未知物質の単離など、利用場面は多い
あらゆる研究室でHPLCが利用されます。これは、利用場面が非常に多いからです。
例えば化合物の純度を測定したいとき、高速液体クロマトグラフィーが利用されます。化合物を溶かしてHPLCをすれば、そこに含まれている化合物を測定できるようになります。純度が高いほど、基準物質のピークだけが観察されるようになります。
一方で純度が低い場合、基準物質だけでなくその他のピークが観察されます。またその他の物質のピーク面積を測定することで、化合物の純度を測定できます。
他には、未知物質の単離で利用されます。例えば化合物をマウスに投与した後、化合物は元の状態のまま体内に存在するわけではなく、体内で反応して化合物の形を変えます。これを代謝といいます。マウスの血液を採取してHPLCを流すことで、代謝化合物を分離できます。
その後、化合物の分子量測定や構造式解析をすることで、どのような物質へ代謝されたのかを調べれば、研究データを得られるようになります。
純度測定や未知物質の単離など、これらはまったく異なる研究です。しかし、利用するクロマトグラフィーの機器はHPLCです。HPLCの利用範囲は非常に広いため、結果として最も高頻度で利用されるクロマトグラフィーとなっています。
HPLCの利点を理解し、実験操作で利用する
クロマトグラフィーの中では利点が多く、多くの用途で利用されるのがHPLCです。その結果、医療や食品、環境とあらゆる分野に応用され、高速液体クロマトグラフィーが利用されています。
ターゲット化合物の定性だけでなく、定量まで可能です。HPLCによって含まれている物質の濃度を測定でき、さらには化合物の分離まで可能です。
ただHPLCを利用するには、事前に原理を理解する必要があります。HPLCの性質を理解しているからこそ、移動相の溶媒を決定できます。また検量線を引くことで、面積値から化合物の濃度を算出できます。機器を利用するには利点や欠点だけでなく、特徴を学ばなければいけません。
幅広い研究室で利用されるからこそ、HPLCの概念を学ぶことは重要です。ここではHPLCの原理について、できるだけ分かりやすく簡単に記しました。これらの特徴を把握したうえで、高速液体クロマトグラフィーを利用しましょう。






