無機化学で重要な内容の一つに錯イオンがあります。金属イオンに対して、配位結合によってイオンを形成する場合は錯イオンと呼ばれます。
金属イオンによる沈殿を生じていても、過剰のアンモニア水や水酸化ナトリウムを加えることによって、水溶液に溶けることがあります。これは、錯イオンを生成することによって金属イオンが溶けたからです。
また金属元素によって、配位結合できる分子の数が異なります。それに伴い、錯イオンの形も変わります。
それでは、錯イオンの性質には何があるのでしょうか。錯イオンの特徴や形、命名法を含めて解説していきます。
もくじ
配位結合によって生成する錯イオン
まず、錯イオンとは何なのでしょうか。原子が結合してイオンを形成するとき、価電子の数に応じて結合を作ります。
ただ場合によっては、価電子の数を超えて結合を作ることがあります。特に金属元素の場合、価電子の数に関係なく、複数の分子またはイオンが金属に結合するケースがよくあります。金属イオンに対して、分子またはイオンが配位結合することで生じるイオンを錯イオンといいます。
例えばアンモニア(NH3)には非共有電子対があります。そのため銀イオン(Ag+)が存在する水溶液に対してアンモニアを過剰に加えると、アンモニアの非共有電子対が銀イオンへ配位結合し、錯イオンを形成します。

こうして、銀イオンは[Ag(NH3)2]+となります。
錯イオンを形成する金属元素はたくさんあります。ただ無機化学を学ぶとき、覚えなければいけない金属元素は主に6種類です(鉄イオンにはFe2+とFe3+があるため、鉄イオンを2種類とする場合は7種類です)。
金属によって配位数が異なる
なお、金属によって配位数が異なります。配位数とは、いくつの分子(またはイオン)が金属に結合できるのかを表します。例えば銀イオン(Ag+)には2つの分子が配位結合できます。そのため、銀イオンに2つのアンモニアが結合でき、[Ag(NH3)2]+となるのです。
錯イオンで重要な金属元素と配位数を表にすると以下のようになります。
| 金属イオン | 配位数 |
| 銀イオン:Ag+ | 2 |
| 亜鉛イオン:Zn2+ | 4 |
| 銅イオン:Cu2+ | 4 |
| ニッケルイオン:Ni2+ | 6 |
| 鉄イオン(Ⅱ):Fe2+ | 6 |
| 鉄イオン(Ⅲ):Fe3+ | 6 |
| アルミニウムイオン:Al3+ | 6 |
どれだけの数の分子またはイオンが金属に結合できるのかについては、金属の種類によって決まっていると理解しましょう。
配位数が決まると錯イオンの形が決まる
なお「配位数が既に決まっている」というのは、錯イオンの形が決まっていることを意味しています。以下のようになります。
- 配位数2(Ag+):直線形
- 配位数4(Cu2+):正方形
- 配位数4(Zn2+):正四面体形
- 配位数6(Fe2+、Fe3+、Al3+):正八面体形
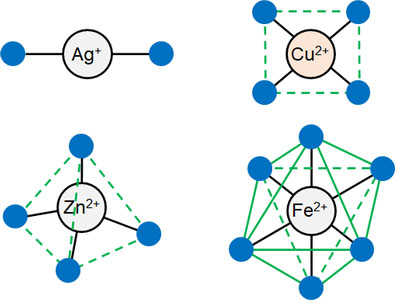
このように、形が決まっています。なお配位数が4つの場合、ほとんどのケースで正四面体形になります。ただ銅は正方形になるので注意しましょう。
錯イオンの例を学ぶ
それでは、実際の錯イオンにはどのような例があるのでしょうか。代表的な錯イオンとしては、例えば以下があります。
| 錯イオン | 名前 |
| [Ag(NH3)2]+ | ジアンミン銀(Ⅰ)イオン |
| [Ag(CN)2]– | ジシアニド銀(Ⅰ)酸イオン |
| [Cu(NH3)4]2+ | テトラアンミン銅(Ⅱ)イオン |
| [Zn(NH3)4]2+ | テトラアンミン亜鉛(Ⅱ)酸イオン |
| [Zn(OH)4]2- | テトラヒドロキソ亜鉛(Ⅱ)酸イオン |
| [Al(OH)4]– | テトラヒドロキソアルミン酸イオン |
| [Fe(CN)6]3- | ヘキサシアニド鉄(Ⅲ)酸イオン |
| [Fe(CN)6]4- | ヘキサシアニド鉄(Ⅱ)酸イオン |
両性元素を学んでいる場合、[Zn(NH3)4]2+や[Zn(OH)4]2-、[Al(OH)4]–については既に理解していると思います。ZnとAlは両性元素であり、過剰の水酸化ナトリウムを加えると錯イオンを形成して溶液中に溶けます。
また両性元素の中では、多量のアンモニア水を加えて錯イオンを作るのは亜鉛のみです。そのため両性元素を分けるとき、「亜鉛とアンモニアが錯イオンを作ることで水溶液中に溶ける」ことを知っているのは重要です。
なお先ほど、アルミニウムの配位数は6と解説しました。[Al(OH)4]–を正確に記載すると、[Al(OH)4(H2O)2]–となります。つまり配位数は6であり、アルミニウムに対して水酸化物イオンと水が配位しています。ただ通常、水は省きます。そのため、[Al(OH)4]–と記載しましょう。
前述のように、アルミニウムの配位数は6です。それにも関わらず、両性元素で学ぶ錯イオンは[Al(OH)6]–ではなく[Al(OH)4]–です。なぜ配位数が6なのに[Al(OH)4]–と記すのか理解していれば、混乱することがありません。
錯イオンの命名法
それでは、錯イオンの命名法を学びましょう。錯イオンの名前を付けるときはルールがあります。まず、配位している分子(またはイオン)の数に着目しましょう。配位数によって、以下のように呼び方が変化します。
- 配位数1:モノ
- 配位数2:ジ
- 配位数3:トリ
- 配位数4:テトラ
- 配位数5:ペンタ
- 配位数6:ヘキサ
数え方はギリシャ語になっています。この数え方は有機化学でも重要であるため、必ず数字と呼び方を一致できるようにしましょう。例えば[Ag(NH3)2]+には、2つのアンモニアが配位結合しているため、配位数は2です。そこで「ジ」を使います。
次に、配位している分子やイオンが何か確認しましょう。結合している分子やイオンを配位子といいます。配位子によって、以下のように名前が決まっています。
| 配位子 | 名前 |
| NH3 | アンミン |
| OH– | ヒドロキソ |
| H2O | アクア |
| CN– | シアノ |
| Cl– | クロロ |
配位子の名前についても有機化学で重要なので覚えておく必要があります。
また金属イオンを決定した後、陰イオンの場合は「酸」を加えましょう。陽イオンの場合、「酸」を加える必要はありません。例えば、以下のようになります。

錯イオンの名前を付けるとき、「配位数 → 配位子 → 金属イオン」の順番になります。また錯イオンが陰イオンの場合、前述の通り「酸」を加えましょう。
イオンであるため、錯イオンは電荷のない化学式を作れる
なお錯イオンはイオンであるため、電荷のない化学式を作ることができます。例えば塩化ナトリウムは水溶液中でNa+とCl–で存在しているものの、NaClと記すことができます。
例えば水酸化銅Cu(OH)2にアンモニア水を過剰に加える場合、テトラアンミン銅(Ⅱ)イオンを生じます。イオン反応式は以下のようになります。
- Cu(OH)2 + 4NH3 → [Cu(NH3)4]2+ + 2OH–
それでは、電荷を記載せずに化学反応式を記す場合はどのようになるのでしょうか。この場合、以下の化学反応式を作りましょう。
- Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
このように、錯イオンと金属(または配位子)に由来するイオンを利用することによって化学反応式を作ります。
それでは練習問題として、水酸化アルミニウムに水酸化ナトリウムを加え、錯イオンを得るときの化学反応式を記しましょう。以下のようになります。
- Al(OH)3 + NaOH → Na[Al(OH)4]
Na+と[Al(OH)4]–を組み合わせるとNa[Al(OH)4]になります。こうして、化学反応式を作りましょう。
錯イオンの性質を学ぶ
一般的なイオンとは性質が異なるのが錯イオンです。金属イオンに対して分子やイオンが配位結合することによって、錯イオンが形成されます。
錯イオンを作る金属の種類は決まっており、無機化学で特に重要な金属は6種類です。また金属ごとに配位数や錯イオンの形は決まっています。配位数が決まると、自動的に錯イオンの形も決まります。
また錯イオンの名前を付けられるようにしましょう。配位数や配位子、金属、陰イオンかどうかを確認することによって名前を付けることができます。それに加えて、錯イオンを用いて、電荷のない化学式を記せるようにしましょう。
特殊なイオンが錯イオンです。錯イオンを利用すれば、沈殿していた金属化合物を溶解させることができます。そこで、錯イオンの種類や特徴を理解しましょう。






