化学で必ず学ぶ内容がイオンです。私たちの身の回りには多くのイオンが存在します。わかりやすい例であれば、食塩が水に溶けるとイオンとして存在することになります。固体であっても、イオンとして存在することによって水の中に溶けることができるのです。
イオンには陽イオンと陰イオンがあります。元素によって、陽イオンになるのか、それとも陰イオンになるのか異なります。周期表の左側にある元素は陽イオンになりやすく、周期表の右側にある元素は陰イオンになりやすいです。
なお原子がイオンになるとき、エネルギーを与える必要があったり、エネルギーを放出したりします。こうしたエネルギーを表すのがイオン化エネルギーと電子親和力です。
これらの内容を暗記してはいけません。そうではなく、理由を理解して答えを導き出せるようになりましょう。そこで、イオンの生成やイオン半径、イオン化エネルギー、電子親和力の内容を解説していきます。
もくじ
原子はオクテット則を満たすようにイオンを作る
固体であるにも関わらず、なぜ液体に溶けることができるかというと、物質はイオンとして存在することができるからです。
例えば塩化ナトリウム(NaCl:食塩)の場合、水中でNa+とCl–という形で存在しています。また塩化カルシウム(CaCl2)であれば、水中でCa2+とCl–という形で存在しています。このように、電荷を帯びた状態であれば水に溶けることができます。
それでは、どのようにイオンが生成されるのでしょうか。イオンが作られるとき、オクテット則(最外殻電子が8になる法則)を満たすようになります。
例えば酸素の価電子は6であり、2つの電子を加えると最外殻電子が8になります。また電子はマイナスの電荷を帯びているため、酸素原子に2つのマイナス(2つの電子分)を加え、以下のように表記します。

言い換えると、希ガスと同じ電子配置を取るのがイオンです。電子を与える、または電子を受け取ることによってイオンとなり、同時にオクテット則を満たすのです。
陽イオンと陰イオン:元素周期表の利用
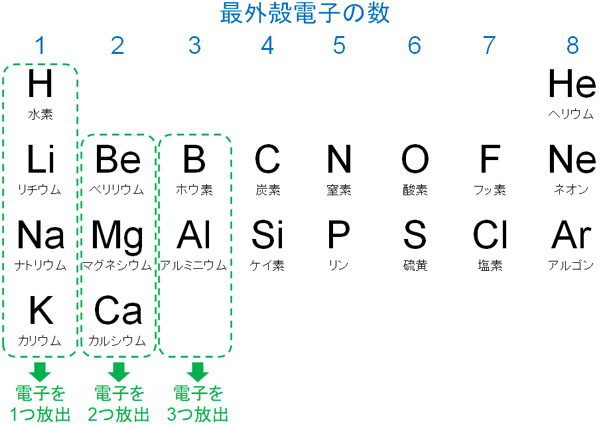
それでは、どのように考えて陽イオンと陰イオンを作ればいいのでしょうか。イオンの生成では、電子を与える、または受け取る必要があります。このとき、周期表の左側にある元素の場合、価電子が少ないです。そのため、電子を放出するほうが楽です。
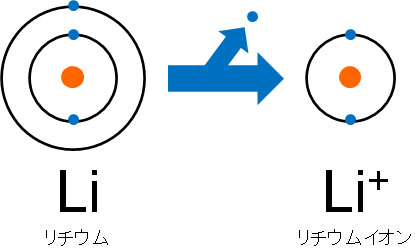
電子はマイナスの電荷を帯びているため、電子を放出すると陽イオンとなります。また、電子の与えた数に応じてプラスの電荷を帯びるようになります。
例えばナトリウム(Na)の価電子は1であるため、イオンになるとNa+になります。またアルミニウム(Al)の価電子は3であるため、3つの電子を放出することによってAl3+になります。また陽イオンになることで希ガスと同じ電子配置となり、水中で安定した状態で存在することになります。
次に、陰イオンを確認しましょう。周期表の右側に存在する元素の場合、電子を放出するよりも、電子を受け取るほうが楽です。価電子が多いため、電子を受け取ることによって最外殻電子を8個にするのです。
例えばフッ素(F)の場合、価電子は7です。そこで1つの電子を受け取ってイオンになります。電子はマイナスの電荷を帯びているため、フッ素がイオンになるとはF–となります。
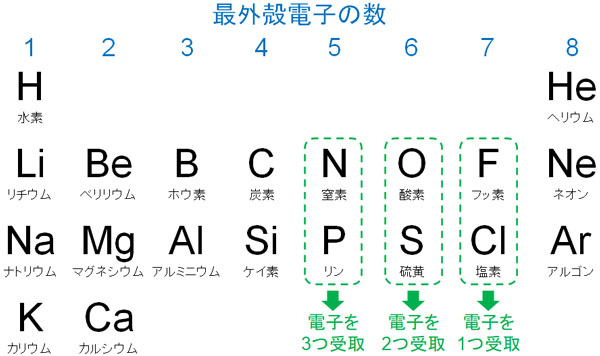
陽イオンになるのか、それとも陰イオンになるのかについては周期表を確認しましょう。また周期表を見れば、いくつの電子を放出する(または電子を受け取る)のかわかります。
原子半径と周期表の関係
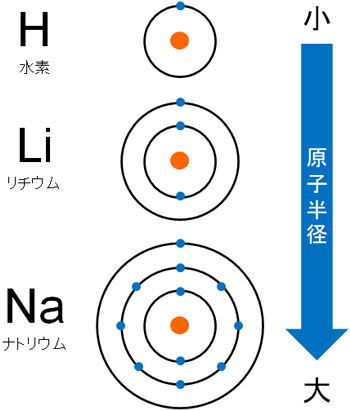
なおイオンを学ぶとき、必ずイオン半径を習います。ただ、イオン半径を学ぶ前に原子半径を理解しましょう。原子によって半径(直径)が異なります。このとき、原子半径はどのように見極めればいいのでしょうか。
原子半径では、周期表の下に行くほど半径が大きくなります。これについては容易に理解できます。電子殻にはK殻、L殻、M殻があり、周期表の下に行くほど電子殻が大きくなります。そのため、必然的に原子半径は大きくなります。
一方、同じ周期の元素(横並びの元素)では、原子半径はどうなるのでしょうか。この場合、周期表の右へ行くほど原子半径は小さくなります。理由としては、周期表の右側であるほど陽子の数が多く、強くプラスの電荷を帯びているからです。そのため、電子を引っ張ることによって半径が小さくなるのです。

例えば、互いに引っ張り合う物質として磁石があります。N極とS極の磁石が一つずつある場合では引き合う力は弱いです。一方、N極とS極の磁石が大量にある場合、互いに引き合う力は強くなります。
同じように、3つの陽子をもつリチウム(Li)に対して、9つの陽子をもつフッ素のほうが電子を強く引きつけます。

このように理解すれば、原子に存在する陽子の数が多くなると、なぜ原子半径が小さくなるのか理解できると思います。
そのため、以下のように周期表の左下では原子半径が大きく、周期表の右上では原子半径が小さくなります。
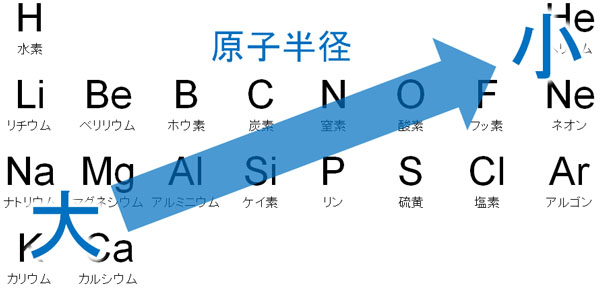
なお原子半径の大小を覚えるのではなく、内容を理解しましょう。なぜ周期表の左下で原子半径が大きくなるのか理由を理解すれば、覚えなくても答えを出すことができます。
イオン半径は陽子の数が重要になる
それでは、イオン半径はどのように考えればいいのでしょうか。原子半径の大きさを理解すれば、イオン半径についても解答できるようになります。
まず、周期表の下に行くほどイオン半径は大きくなります。K殻、L殻、M殻の順にイオン半径が大きくなるのは当然です。また陽子の数が多くなるほど、多くの電子をひきつけます。そのため最外殻電子の数が同じイオンについて、陽子の数を確認してイオン半径の大小を確認しましょう。
より詳しく解説すると、最外殻電子の数が同じ場合、原子番号が大きいほどイオン半径は小さくなります。原子番号が大きいというのは、陽子の数が多いことを意味するからです。例えばネオンと同じ数の電子をもつイオンの半径を比べると以下のようになります。
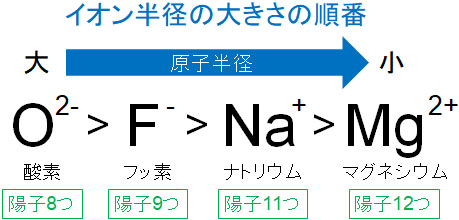
イオンでは、同じ数の最外殻電子をもつケースが多いです。そこで、原子が保有する陽子の数に着目してイオン半径の大きさを考えましょう。
イオン化エネルギー:陽イオンになるために必要なエネルギー
ここまでの内容を学んだら、次にイオン化エネルギーを理解しましょう。イオンになるためにはエネルギーが必要です。このとき、原子から一つの電子を奪い取るために必要なエネルギーをイオン化エネルギーといいます。
元素周期表の左側にある原子では、電子を放出することによってイオンになりやすいと容易に想像できます。そのため、アルカリ金属やアルカリ土類金属はイオン化エネルギーが低いです。
一方で元素周期表の右にある原子は電子を放出するのではなく、電子を受け取ることによって陰イオンになりやすいです。そのため、電子を一つ奪うときに大きなエネルギーが必要になると予想できます。
より詳しくいうと、陽子を多くもつ原子は電子を強く引き付けます。そのためハロゲンなど、元素周期表の右側にある元素であるほどイオン化エネルギーが大きくなります。つまり、陽イオンになりにくいです。
これは希ガスも同様です。希ガスは非常に安定な物質であり、一つの電子を奪うときのエネルギーは非常に大きくなります。
周期表でのイオン化エネルギーの違い
それでは、同じ族(元素周期表の上下)ではどのように考えればいいでしょうか。陽子から近いほど、電子が引き付けられる力は強いです。
一方、陽子から遠いと電子が原子核に引き付けられる力は弱くなります。そのため原子半径が大きい原子であるほど、低いエネルギーで電子を奪うことができます。これはつまり、元素周期表の下にある元素であるほど、イオン化エネルギーが低くなることを意味しています。
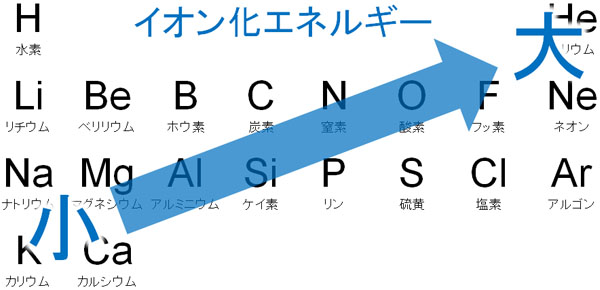
このように、イオン化エネルギーの大小は原子半径と逆のパターンになります。
ここまでの内容について、暗記してもすぐに忘れるので意味がありません。そうではなく、なぜ元素周期表の右側ではイオン化エネルギーが大きくなり、元素周期表の下側ではイオン化エネルギーが小さくなるのか理由を理解しましょう。そうすれば、暗記しなくても答えを出すことができます。
陰イオンになって放出するエネルギーが電子親和力
一方、原子が一つの電子を得ることによって陰イオンになるとき、放出するエネルギーを電子親和力といいます。先ほどのイオン化エネルギーとは逆だと考えましょう。
なぜ、電子を受け取ることによってエネルギーを放出するのでしょうか。イメージとしては、隕石が惑星に衝突する場面を考えましょう。衝突時、隕石は熱や光などのエネルギーを放出します。

電子も同様であり、電子を小さい隕石と考えることができます。電子が原子(惑星)に衝突し、原子が陰イオンになるとき、エネルギーを放出するのです。
例えば窒素原子や酸素原子、フッ素原子など、元素周期表の右側にある原子は陰イオンになりやすいと容易に想像できます。陽子が多いため、積極的に電子を引き付け、陰イオンになるのです。電子を受け取って多くのエネルギーを放出するため、これらの原子は陰イオンになりやすいです。
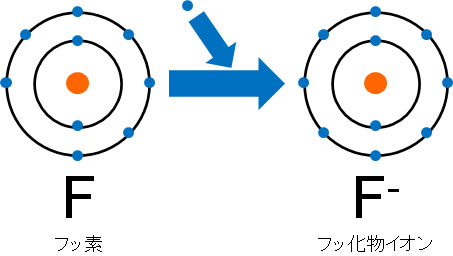
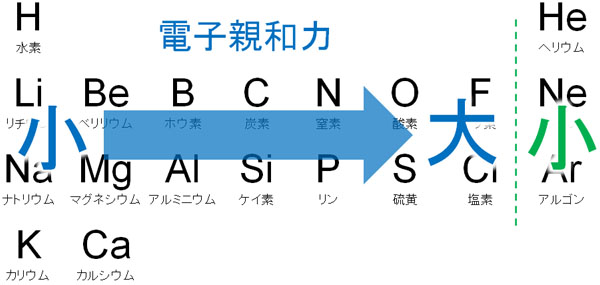
一方、アルカリ金属やアルカリ土類金属の場合、電子を受け取ることは基本的にありません。むしろ、電子を放出するほうを好みます。そのため、電子親和力が非常に低いと予想できます。つまり、元素周期表の左側は電子親和力が小さく、元素周期表の右側は電子親和力が大きいです。
電子親和力の考え方はイオン化エネルギーと似ています。電子親和力について、イオン化エネルギーのように「族(元素周期表の上下)で異なる」ことはないものの、元素周期表の右側では電子親和力が大きくなると理解すればいいです。
電子親和力はハロゲンが最大であり、希ガスが最小
ただイオン化エネルギーと電子親和力では大きく異なる点があります。それは、ハロゲンで電子親和力が最大になり、希ガスで電子親和力が最小になることです。なぜ、希ガスで電子親和力が最小になるのでしょうか。
電子を引き寄せる力はフッ素(F)や塩素(Cl)などのハロゲンが最も強いことで知られています。これは、多くの陽子を保有しており、電子を受け取ることで安定になりやすいからです。
ただネオン(Ne)はフッ素(F)よりも多くの陽子を保有しています。アルゴン(Ar)は塩素(Cl)よりも多くの陽子を保有しています。それにも関わらず電子親和力が弱いのは、希ガスは最外殻電子が8であり、オクテット則を満たしているからです。
希ガスは非常に安定な物質であり、分子ではなく原子で存在しています。最外殻電子が8にも関わらず、ネオン(Ne)に一つの電子がくっつく場合、ナトリウム(Na)と同じ電子配置になります。またヘリウム(He)に電子が一つ結合する場合、リチウム(Li)と同じ電子配置になります。これは非常に不安定な状態です。
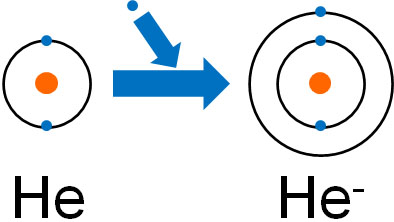
化学物質は不安定な状態を嫌います。また電子親和力というのは、電子を受け取ることによって放出するエネルギーを指します。
ヘリウム(He)やネオン(Ne)、アルゴン(Ar)が一つの電子を受け取るためには、むしろ大きなエネルギーが必要になります。そのため、ハロゲンとは違って電子親和力が最低となるのです。電子親和力については、大小関係は以下のようになります。
イオン化エネルギーとほぼ同じであるものの、電子親和力は独自の特徴があります。なぜハロゲンの電子親和力が最大であり、希ガスの電子親和力が最小なのか理由を理解しましょう。
イオンの性質や半径、エネルギー関係を学ぶ
化学で必ず学ぶ内容がイオンです。イオンの性質を学ぶとき、暗記してはいけません。暗記しても確実に忘れるからです。その代わり、理由を理解しましょう。
原子半径やイオン半径で重要なのが電子殻(K殻、L殻、M殻など)と陽子の数です。電子殻が増えると、その分だけ原子半径やイオン半径は大きくなります。また陽子の数が多ければ、その分だけ原子半径やイオン半径は小さくなります。
また原子半径を理解すれば、元素周期表の左下にある原子であるほど、なぜイオン化エネルギーが小さくなるのかわかります。原子核から遠いほど、陽子の数が少ないほど(電子を引き寄せる力が弱いほど)、一つの電子をくっつけるときに小さいエネルギーで済みます。
なお電子親和力はイオン化エネルギーと似ています。ただハロゲンで電子親和力が最大になり、希ガスで電子親和力が最小になる理由を学びましょう。これらを理解することにより、イオンの性質を把握できるようになります。






